基于网络药理学探讨白花蛇舌草-半枝莲抗肝细胞癌的作用机制
浙江中医药大学 杭州 310053
原发性肝癌(primary hepatic carcinoma,PHC)是一种发病率极高的恶性肿瘤,病情进展快,患者5年生存率低[1]。 肝细胞癌(hepatocellular carcinoma,HCC)是PHC最常见的病理类型,因其早期症状隐匿,大部分HCC患者确诊时已处于中晚期,已错失根治性手术的最佳时机。目前HCC的治疗方式大多为手术、化疗、放疗、分子靶向治疗等,但往往伴随严重的不良反应。因此,如何抑制HCC的发生发展,减少不良反应,延长患者生存期,已成为现今的研究热点。中医药在延缓HCC疾病进展、缓解治疗副反应、提高患者生活质量等方面优势显著[2],日渐成为综合性治疗的重要组成部分。
中医认为,HCC可归属于“肝积”“黄疸”“肥气”等范畴,病机属正虚邪侵,为机体阴阳气血失调,痰湿热毒内生,积聚于胁下而成肿块,故治疗上当清热毒、调气血、益肝用。白花蛇舌草-半枝莲为临床常用清热解毒药对,白花蛇舌草兼有消肿止痛、半枝莲兼有活血化瘀的功效,二者相伍,共奏抗癌奇功。现代药理学研究表明,白花蛇舌草的化学成分主要包括环烯醚萜类、黄酮类、蒽醌类等化合物,具有抗癌、抗氧化、抗炎等多种生物活性[3];半枝莲的主要活性成分为黄酮类、二萜及其内酯类、多糖类化合物,具有良好的抗癌、护肝及抗病毒作用[4]。研究证实,两药联合能够诱导细胞凋亡、增强免疫功能,较单药对肿瘤细胞的抑制作用更加明显[5]。然而由于中药多成分、多靶点的特性,白花蛇舌草-半枝莲药对抗HCC的具体作用机制尚未阐明。
网络药理学作为一门新兴学科,能够对中药活性成分及潜在作用靶点进行系统网络性研究,这恰好与中药多层次、多靶点、多通路的特性相符。故本研究采用网络药理学方法,挖掘白花蛇舌草-半枝莲药对的活性成分及治疗HCC的潜在靶点,并探索其作用机制,为深入研究HCC的诊治奠定基础。本研究整体框架见图1。
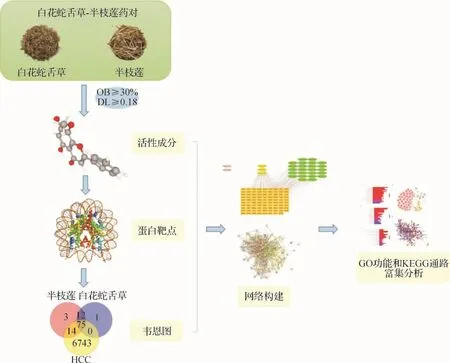
图1 基于网络药理学的整体研究框架Fig.1 The whole framework of the study based on network pharmacology
1 材料和方法
1.1 白花蛇舌草-半枝莲活性成分及靶点的筛选 利用中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)(http://lsp.nwsuaf.edu.cn/)检索白花蛇舌草、半枝莲的化学成分,同时收集其药物动力学参数,以口服生物利用度(oral bioavailability,OB)≥30%和类药性(druglikeness,DL)≥0.18为标准[6],筛选其有效活性成分,将收集到的药物活性成分导入到Drugbank 数据库(https://www.drugbank.ca/)中进行蛋白靶点的筛选匹配。为了提高数据的标准性及统一性,进一步运用Uniprot数据库(https://www.uniprot.org/),查询其蛋白靶点名所对应的人类基因名称,并匹配整理药物靶点。
1.2 HCC相关靶点的筛选 选择GeneCards(https://www.genecards.org/)数据库、人类在线孟德尔遗传(Online Mendelian Inheritance in Man,OMIM)数 据 库(http://www.omim.org/)、 治疗目标数据库(Therapeutic Target Database,TTD)(http://db.idrblab.net/ttd/)、Drugbank数据库(https://www.drugbank.ca/)、肝细胞癌肿瘤数据库(Oncogenomic Database of Hepatocellular Carcinoma,OncoDB.HCC) (http://oncodb.hcc.ibms.sinica.edu.tw)和Liverome数据库(http://liverome.kobic.re.kr/),以“Hepatocellular carcinoma”或“HCC”为关键词检索HCC相关靶点,整合并删除重复项。通过R语言(Version 3.6.1)将药物靶点与疾病靶点进行匹配,取交集作为白花蛇舌草-半枝莲药对治疗HCC的潜在作用靶点。
1.3 构建“药物-活性成分-靶点”网络 选用可视化软件Cytoscape(Version 3.7.1)构建“药物-活性成分-靶点”关系网络,以阐明白花蛇舌草-半枝莲药对中活性成分与疾病靶点的关系。网络下方节点代表筛选后白花蛇舌草-半枝莲药对治疗疾病的潜在作用靶点,网络上方节点代表白花蛇舌草-半枝莲药对的共活性成分,边代表白花蛇舌草-半枝莲药对与其活性成分、活性成分与潜在作用靶点、潜在作用靶点与疾病的相互关系。
1.4 构建靶点蛋白相互作用(protein-protein interaction,PPI)网络 将交集后的潜在作用靶点导入String数据库(https://string-db.org/)处理,限定物种为“Homo sapiens”进行检索,构建白花蛇舌草-半枝莲药对抗HCC作用靶点的PPI网络图。
1.5 网络拓扑分析 对于网络中的每个节点,使用Cytoscape软件中的Network Analyzer工具及cytoNCA插件对其进行拓扑分析。选择3个参数来评估其拓扑特征:(1)连接度中心性(degree centrality,DC),即与一个节点直接相连的节点个数;(2)紧密度中心性(closeness centrality,CC),即从一个节点到其他节点的平均距离;(3)中介中心性(betweeness centrality,BC),即经过某个节点的最短路径数目。这3个参数在网络中起着至关重要的作用,DC越高,CC、BC越大,节点在网络中的核心地位越高。根据上述参数进行网络核心节点的筛选。
1.6 基因本体(gene ontology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析 利用R语言中Bioconductor平台及Cytoscape中Cluego插件对预测得到的关键靶点进行GO和KEGG富集分析,筛选条件为P<0.05,Q<0.05,分析结果以条形图、气泡图及饼状图呈现。随后用Metascape数据库(http://metascape.org/)对富集通路进行整合。
2 结果
2.1 白花蛇舌草-半枝莲药对的活性成分及作用靶点 检索TCMSP数据库得到白花蛇舌草化学成分37个,半枝莲化学成分94个;设定OB≥30%,DL≥0.18进一步筛选后,最终纳入共活性成分3个,白花蛇舌草活性成分4个(除去3个共活性成分),半枝莲活性成分26个(除去3个共活性成分)。见表1。将上述33个活性成分导入到Drugbank数据库,共收集到236个蛋白靶点。进一步查询Uniprot数据库后,得到88个白花蛇舌草、104个半枝莲对应靶点,删除87个重复项后,最终得到105个药物靶点。
2.2 HCC相关靶点 通过检索,在GeneCards、OMIM、TTD、Drugbank、OncoDB.HCC和Liverome数据库中分别获得6 592、200、47、14、325和241个HCC相关靶点,删除重复项后共筛选得到6 832个HCC相关靶点,与105个药物共同靶点匹配后,交集得到89个白花蛇舌草-半枝莲药对治疗HCC的潜在作用靶点。见图2。
2.3 “药物-活性成分-靶点”网络分析 将白花蛇舌草-半枝莲活性成分、潜在作用靶点、HCC靶点及其属性导入到Cytoscape,建立“药物-活性成分-靶点”网络。见图3。利用Network Analyzer计算节点DC,结果发现,白花蛇舌草-半枝莲药对中DC居前5位的活性成分分别为槲皮素(quercetin,degree=121)、木犀草素(luteolin,degree=28)、β-谷甾醇(beta-sitosterol,degree=22)、黄芩素(baicalein,degree=19)及汉黄芩素(wogonin,degree=19)。见表2。以上成分均为白花蛇舌草-半枝莲药对治疗HCC的关键活性成分。分析网络图发现,药对中相同活性成分能同时作用于多个靶点,而相同靶点亦对应多种活性成分,证明白花蛇舌草-半枝莲药对能够多成分、多靶点发挥治疗作用。
2.4 靶点PPI网络分析 将白花蛇舌草-半枝莲药对抗HCC的89个潜在作用靶点导入String数据库平台,剔除1个无相互作用关系的蛋白后,得到由88个节点及864条边组成的PPI网络。见图4。进一步应用CytoNCA计算网络节点的拓扑参数,并进行核心靶点的筛选。DC的中位数为14,CC的中位数为0.52,BC的中位数为0.003868,基于这3个参数的中位数进行第1次筛选,即筛选条件为DC≥14,CC≥0.52,BC≥0.003868,共得到31个关键靶点。随后设定阈值为DC≥40,CC≥0.655462,BC≥0.035574进行第2次筛选,最终得到6个核心靶点,包括白细胞介素-6(interleukin-6,IL-6)、半胱氨酸蛋白酶-3(caspase-3,CASP3)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、myc基因、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、雌激素受体1(estrogen receptor 1,ESR1)。最后构建核心靶点与白花蛇舌草-半枝莲活性成分关系网络。见图5。
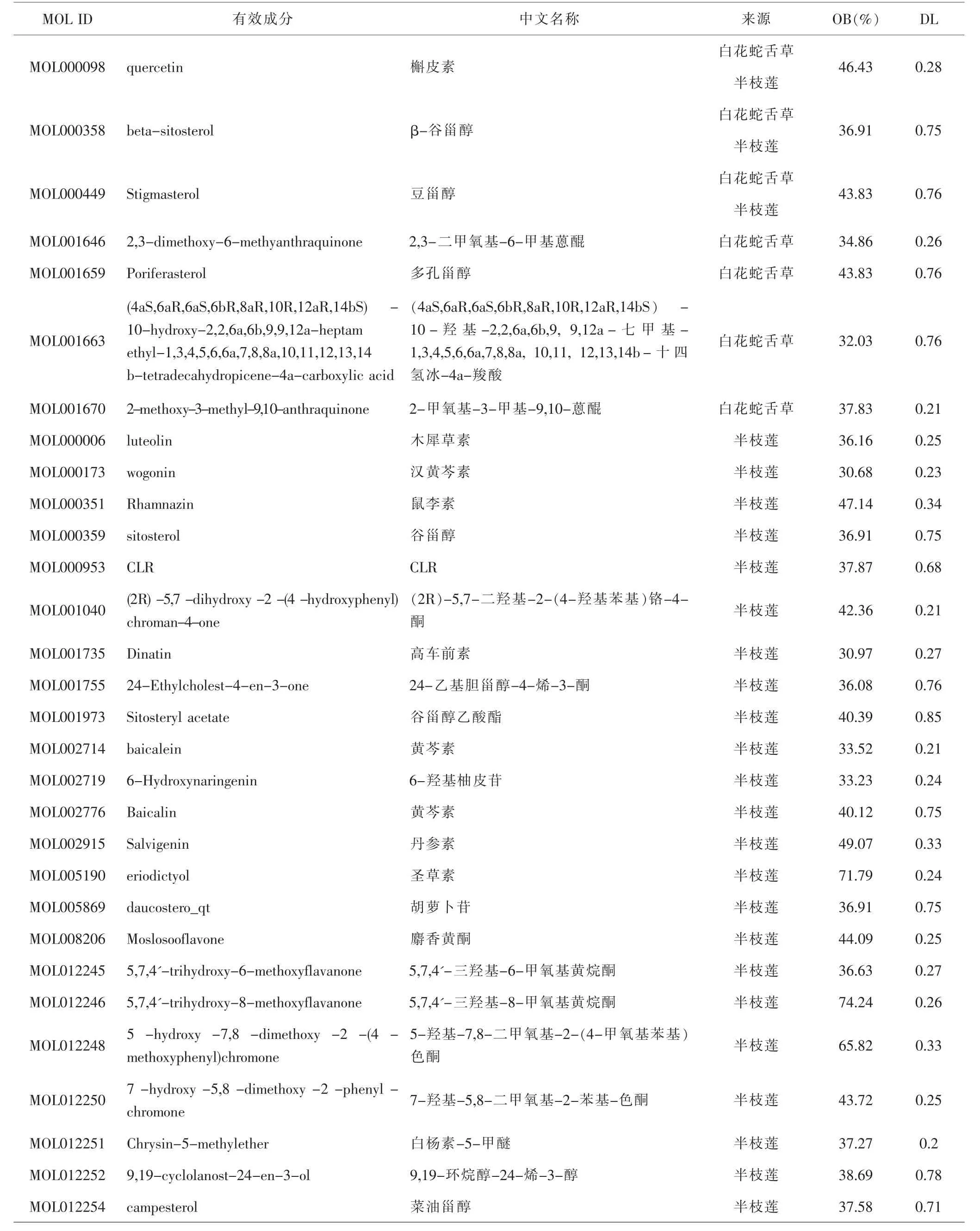
表1 白花蛇舌草-半枝莲潜在活性成分Tab.1 Potential active components of Hedyotis diffusa-Scutellariae barbatae Herba
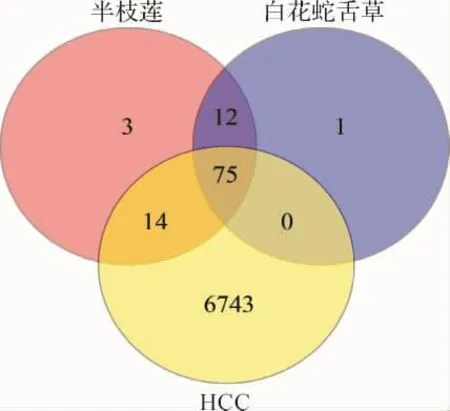
图2 白花蛇舌草-半枝莲作用靶点与HCC相关靶点交集Fig.2 Interaction of Hedyotis diffusa-Scutellariae barbatae Herba related targets and HCC related targets
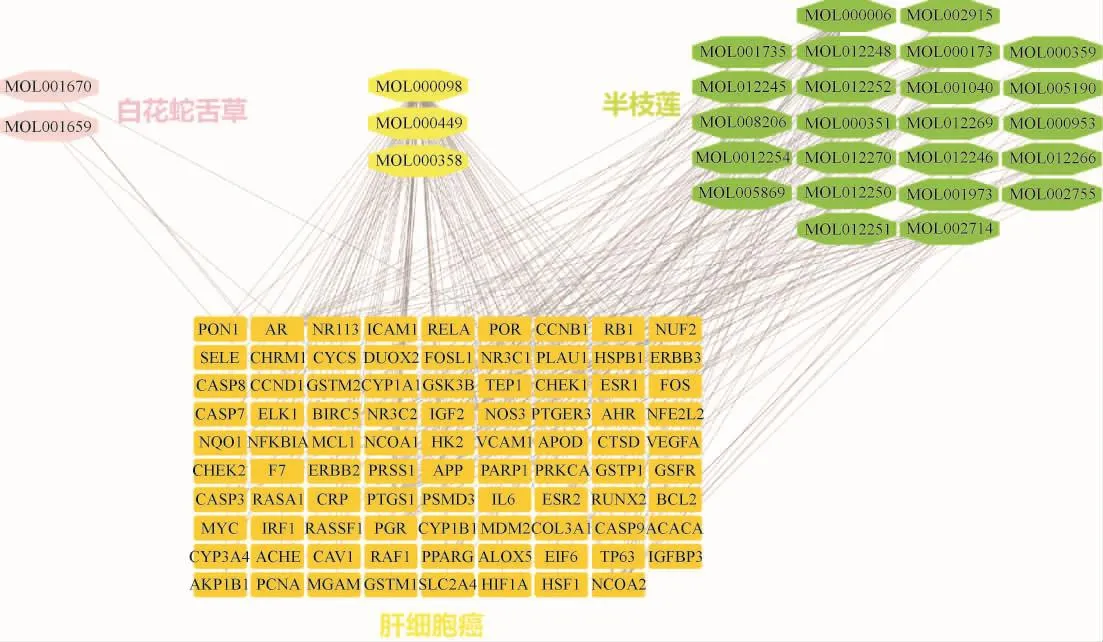
图3 “药物-活性成分-靶点”网络Fig.3 “Drug-component-target” network
2.5 GO功能富集分析 通过R语言对潜在作用靶点进行分析,以P<0.05为条件,共筛选得到1 196个GO条目,其中生物过程(biological process,BP)条目1 067个,细胞组分(cellular component,CC)条目39个,分子功能(molecular function,MF)条目90个。 结果显示,BP方面,白花蛇舌草-半枝莲药对主要参与对类固醇激素、外源刺激、氧化应激等的反应过程;CC方面,白花蛇舌草-半枝莲药对与细胞各个部分均有密切联系,包括细胞膜、细胞核、线粒体等;MF方面,白花蛇舌草-半枝莲药对主要与核受体功能、转录因子活性、近端启动子序列特异性DNA结合等功能有关。此结果证实白花蛇舌草-半枝莲药对可通过调控多种生物学途径发挥对HCC的治疗作用,进一步分析发现这些生物学途径主要与细胞增殖、细胞凋亡、炎症反应和血管生成有关。以条形图展示校正后P值排名前20位的结果。见图6。
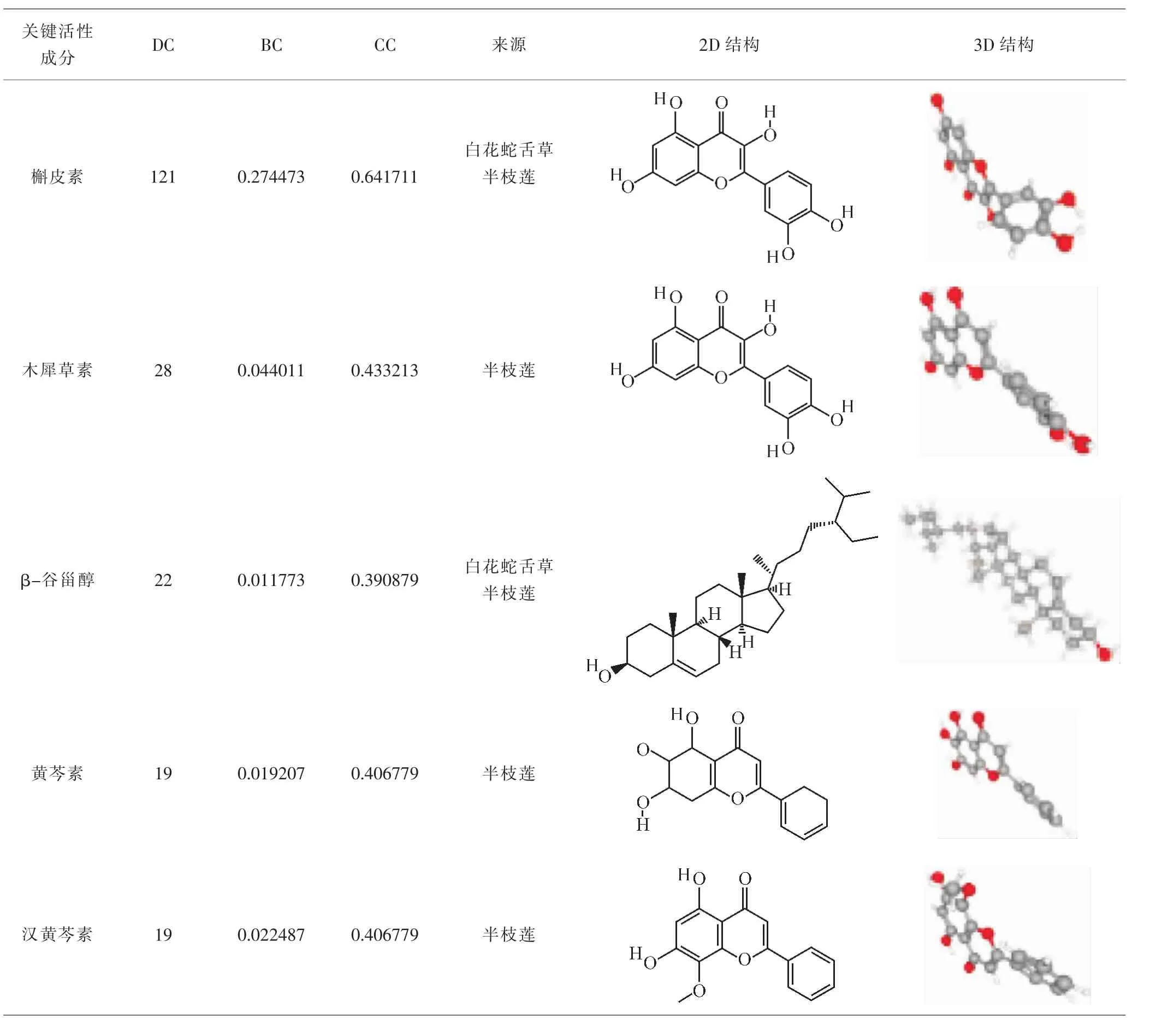
表2 DC居前5位的关键活性成分信息Tab.2 Information of key-components of DC in the top 5
2.6 KEGG通路富集分析 通过Cluego将潜在作用靶点与KEGG信号通路进行匹配,共富集得到80条信号通路,其中p53抑癌基因通路、磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol-3-kinase/protein kinase B,PI3K-Akt) 通路、 缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)通路、核因子-κB(nuclear factor-κB,NF-κB)通路、VEGF通路是关键信号通路。见表3。此外,膀胱癌通路、结直肠癌通路、乳腺癌通路等也被显著富集,这表明白花蛇舌草-半枝莲药对能够通过多个信号通路发挥抗HCC及多种恶性肿瘤的作用,且其作用靶点可能为多种恶性肿瘤的共同靶标。最后,对KEGG通路富集分析行可视化处理,并在Metascape数据库中进行验证。见图7。

图4 PPI网络Fig.4 PPI network

图5 “核心靶点-关键成分”网络Fig.5 “Core targets-key components” network
3 讨论
中医认为,本虚标实为HCC之基本病机。正气先虚,加之情志过极,饮食劳倦,机体阴阳气血失衡,气滞痰凝血瘀而成癌毒。癌毒与痰瘀互结,郁久化热,更成热毒,毒热内结为HCC发生的关键病机。临床上HCC患者也常表现出发热、疼痛、口苦、烦躁、尿黄、便秘等热毒之症。《素问·至真要大论》云:“寒者热之,热者寒之……”因此对于热毒引发的恶性肿瘤,应用清热解毒的寒凉类方药治疗。作为清热解毒类方药的代表,有文献报道,白花蛇舌草联合半枝莲能够有效抑制HCC的发生发展[7]。但由于中药多成分、多靶点作用的特性,该药对治疗HCC的具体成分、靶点及机制至今尚不明确。
本研究通过网络药理学的方法探讨白花蛇舌草-半枝莲药对治疗HCC的潜在靶点及作用机制。根据网络拓扑分析结果,得到5种关键成分,6个核心靶点,结合GO功能及KEGG通路富集分析得到的5条关键通路,白花蛇舌草-半枝莲药对可能通过调节细胞增殖与凋亡、控制炎症、抗血管生成等多途径发挥治疗作用。
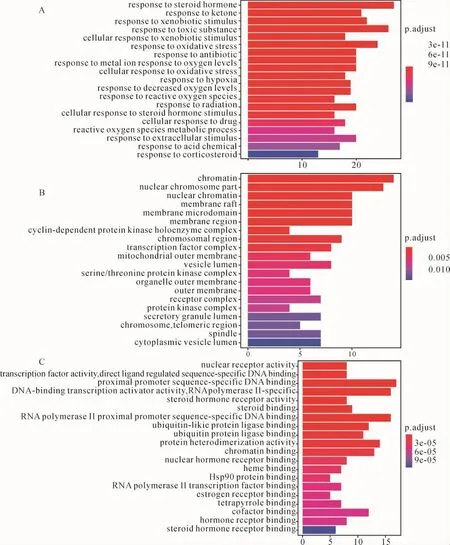
图6 关键靶点的GO功能富集分析Fig.6 GO function enrichment analysis for key targets
3.1 细胞增殖 细胞周期调节失控所致的细胞异常增殖,是恶性肿瘤的关键特征之一[8]。EGFR是表皮细胞生长因子(epidermal growth factor,EGF)的受体,广泛分布于上皮细胞、成纤维细胞等多种细胞表面,参与细胞增殖及信号传导。EGF和EGFR的结合导致EGFR的二聚化,进一步激活PI3K-Akt通路,抑制细胞增殖[9]。myc是细胞增殖和代谢的关键调节因子,调节基因转录程序,从而影响多种人类肿瘤细胞的增殖和代谢[10]。本研究分析筛选得出,白花蛇舌草-半枝莲药对的关键靶点包括与细胞增殖相关的EGFR、myc,关键信号通路包括PI3K-Akt信号通路,说明白花蛇舌草-半枝莲药对的活性成分槲皮素及木犀草素等可能是通过抑制EGFR及myc表达,调节PI3K-Akt信号通路,从而抑制细胞增殖。且有研究证实,槲皮素可抑制EGFR及其下游信号分子PI3K、Akt的表达[11];木犀草素可抑制Akt和PI3K的磷酸化[12],抑制细胞增殖并诱导细胞凋亡,发挥抗HCC的作用,与本研究结果一致。
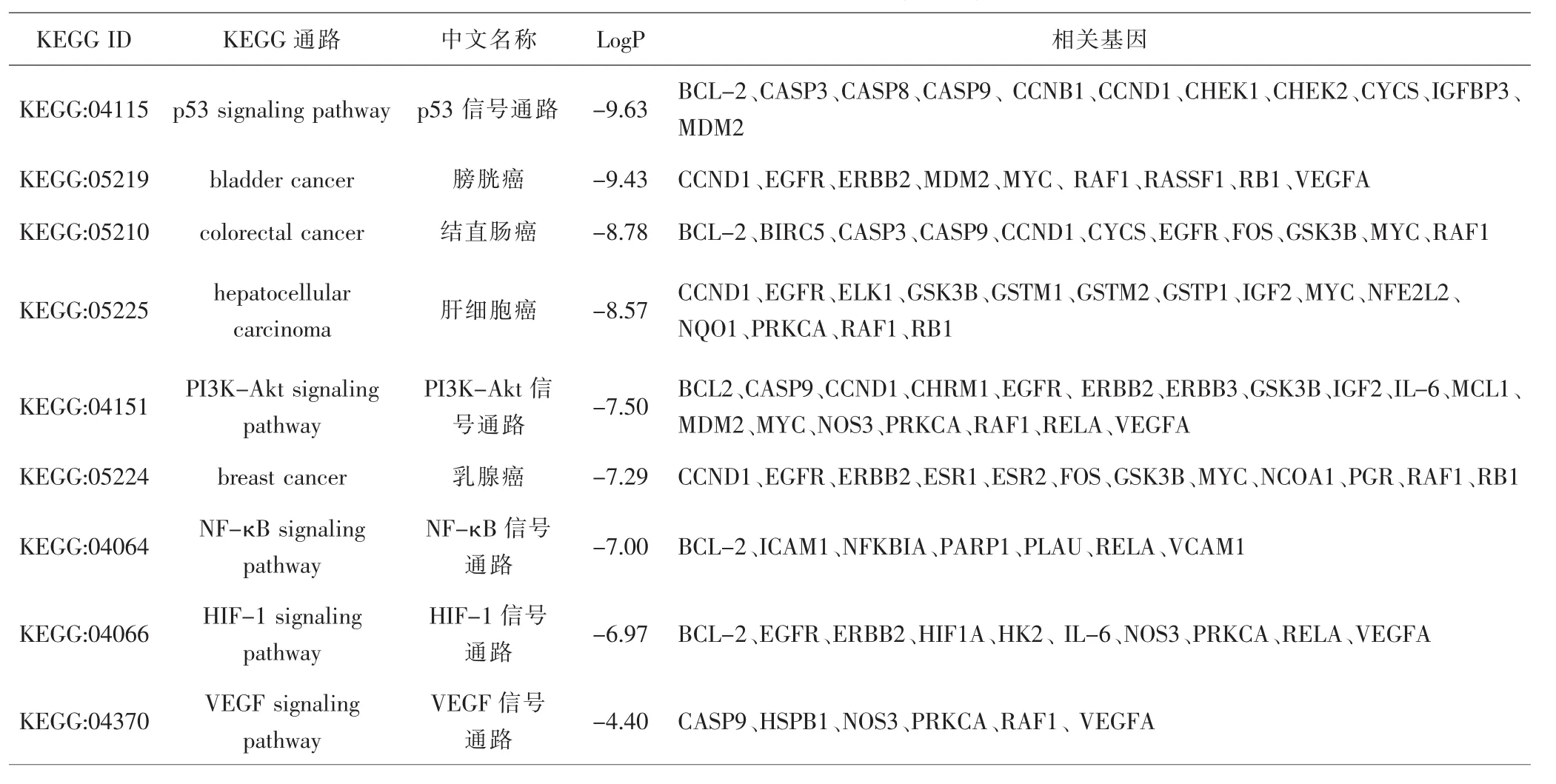
表3 关键KEGG信号通路信息Tab.3 Information on key KEGG signaling pathway
图7 可视化KEGG通路富集分析Fig.7 Visual analysis of KEGG pathway enrichment
3.2 细胞凋亡 研究已证实,细胞增殖与凋亡的稳态失衡是肿瘤的发病机制之一[13]。机体内凋亡信号可激活CASP表达,刺激细胞内多种信号传导通路,而CASP3是CASP家族中最重要的一种,可通过级联放大反应促细胞凋亡。HIF-1和p53信号通路为促细胞凋亡关键通路,其中HIF-1作为一种促凋亡因子,能够激活凋亡前体蛋白表达,同时p53能直接与HIF-1的氧依赖性降解结构域(oxygen-dependent degradation domain,ODDD)相结合,最终诱导细胞凋亡[14]。本研究富集分析结果表明,白花蛇舌草-半枝莲药对的活性成分可能通过调节HIF-1和p53信号通路,诱导下游的CASP级联反应,从而促进肿瘤细胞凋亡。进一步分析提示,白花蛇舌草-半枝莲药对中的相关活性成分包括槲皮素、木犀草素、β-谷甾醇、黄芩素及汉黄芩素等,以上活性成分都能通过CASP3级联反应,促进细胞凋亡。
3.3 炎症反应 肿瘤的发生发展与肿瘤微环境息息相关。炎症反应的刺激能产生多种趋化因子,从而形成炎症微环境,促进肿瘤细胞的增殖迁移。IL-6作为一种重要的炎症细胞因子,可经自分泌和旁分泌途径影响肿瘤细胞的增殖与分化。研究发现,IL-6能够介导正常成纤维细胞与肿瘤细胞之间的相互作用,并促进肿瘤细胞转移[15]。NF-κB是细胞内重要的核转录因子,能够促进肿瘤中炎症基因的转录,刺激机体分泌更多的IL-6等细胞因子,起到抑制肿瘤细胞凋亡的作用[16]。本研究富集分析结果提示,白花蛇舌草-半枝莲药对中的槲皮素、木犀草素、汉黄芩素等成分可能通过降低IL-6水平,减少NF-κB表达,抑制NF-κB信号通路,从而下调下游炎症因子表达水平,控制炎症反应。此外,有研究表明癌性疼痛与某些炎性因子的表达密切相关[17],由此进一步推测白花蛇舌草-半枝莲药对可能通过抑制IL-6、NF-κB信号通路,从而发挥抗炎作用,缓解HCC引起的癌痛。
3.4 血管生成 血管生成在肿瘤细胞的增殖和转移中发挥着重要作用,而HCC组织中存在着丰富的脉管系统。VEGFA是最重要的血管生成因子[18],其在HCC组织中的表达明显高于正常组织[19],VEGFA能够上调HIF-1α的表达,还可以作为一种自分泌生长因子,刺激肿瘤血管的生成[20-21]。本研究筛选发现VEGFA为白花蛇舌草-半枝莲药对的关键靶点,HIF-1及VEGF信号通路为其关键信号通路,提示白花蛇舌草-半枝莲药对可能通过作用于HIF-1α从而下调VEGFA表达水平,进一步抑制VEGF信号通路,抑制肿瘤血管生成。
综上所述,本研究基于网络药理学方法,对白花蛇舌草-半枝莲药对治疗HCC的作用进行了系统分析,明确了白花蛇舌草-半枝莲药对可能通过p53、PI3K-Akt、HIF-1、NF-κB、VEGF等信号通路发挥抗HCC作用,符合中医药多成分、多靶点、多通路的机制特点。本研究的结果为后续实验研究提供了方向。网络药理学的出现极大地推动了现代生物医药技术的发展,但仍存在数据库信息不完整、数据源算法与临床存在差异等问题,有待进一步探究。因此,积极开发智能数据库、进行深入的体内外实验探究,为临床治疗提供新的方向及依据,是中药网络药理学的发展方向之一。

