解毒祛瘀滋肾方对MRL/lpr狼疮小鼠皮肤组织JAK1/STAT3信号通路的影响
浙江中医药大学附属第二医院 杭州 310005
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种慢性自身免疫性疾病,其免疫异常与细胞因子密切相关。在疾病活动期及组织损伤时常表现出细胞因子水平异常,如肿瘤坏死因子(tumor necrosis factor,TNF)、干扰素(interferon,IFN)及白介素-2(interleukin-2,IL-2)、IL-4、IL-6、IL-10、IL-12、IL-13和IL-15等水平上调,而上述细胞因子均可通过酪氨酸蛋白激酶/信号转导与转录激活因子家族(Janus kinase/signal transducers and activators of transcription,JAK/STAT)信号通路发挥其生物学作用[1]。该通路上的关键信号分子包括酪氨酸蛋白激酶1(Janus kinase 1,JAK1)、信号转导与转录激活因子1(signal transducers and activators of transcription 1,STAT1)、STAT3、STAT4、STAT6等。研究表明,JAK/STAT信号通路的异常激活与SLE的皮肤损害、肾脏炎症及中枢神经系统疾病有关[2]。
目前临床上SLE的治疗仍以糖皮质激素加免疫抑制剂为主,虽然能够有效控制疾病活动、改善病情,提高SLE患者的存活率,但也带来了严重的不良反应。实践证明,中医药在自身免疫性疾病的治疗中有着较大的潜力。解毒祛瘀滋肾方是范永升教授经长期临床实践总结出的治疗SLE的经验方[3-4],临床和实验研究证明该方具有明显的抗炎、调节免疫、改善代谢紊乱、降低西药毒副作用及减少感染等作用,并且能显著改善皮肤损害(面部红斑、口腔溃疡、脱发、光过敏等)[5-7],但目前具体机制尚不明确。因此,本研究拟探讨解毒祛瘀滋肾方对MRL/lpr狼疮小鼠皮肤组织JAK1/STAT3信号通路的影响,为阐明解毒祛瘀滋肾方治疗SLE的作用机制提供科学依据。
1 材料和方法
1.1 试剂及药品 JAK1抗体购于美国Abcam公司(批号:ab133666);STAT3和β-actin单克隆抗体均购于武汉赛维尔生物公司(批号:GB11176、GB12001);IL-6、IL-10酶联免疫吸附试验 (enzyme linked immunosorbent assay,ELISA)检测试剂盒均购于美国e-Bioscience公司(批号:109409011、107275015);蛋白定量检测试剂盒、放射免疫沉淀法缓冲液、苯甲基磺酰氟化物(phenylmethyl sulfonylfluoride,PMSF)、过氧化物酶标记羊抗小鼠抗体、增强化学发光法(enhanced chemiluminescence,ECL)试剂盒均购自武汉赛维尔生物公司(批号:G2026、G2002、G2008、GB23301、G2014)。解毒祛瘀滋肾方由生地黄15g、炙鳖甲12g、青蒿12g、升麻9g、积雪草15g、赤芍12g、炒薏苡仁15g、佛手片9g、生甘草6g、白花蛇舌草15g组成,以上中药由浙江中医药大学附属第二医院中药房提供,并制成生药浓度为0.5g·mL-1的浓缩液;强的松片购于浙江仙琚制药股份有限公司(批号:150428),以蒸馏水溶解,制备成浓度为0.5mg·mL-1的混悬液。
1.2 主要仪器 ISO9001型电子天平购于德国Sartorius公司;Eppendorf 5417R型台式高速冷冻离心机为德国Eppendorf公司产品;V300型扫描仪购于EPSON公司;Thermo Multiskan MK3全自动酶标仪购于芬兰雷勃公司。
1.3 实验动物分组和干预 8周龄雌性无特殊病原体(specific pathogen free,SPF)级MRL/lpr小鼠30只和C57BL/6小鼠10只,均由上海斯莱克实验动物有限公司提供[实验动物生产许可证号码:SCXK(沪)2012-0005]。所有动物均于浙江中医药大学动物实验研究中心实验室全封闭SPF状态下饲养[实验动物使用许可证号:SYXK(浙)2018-0012],自由采食饮水。 适应性喂养1周后,将MRL/lpr小鼠随机分为西药组(强的松组)、中药组(解毒祛瘀滋肾方组)和模型组,每组10只;另将C57BL/6小鼠作为对照组。中药组予解毒祛瘀滋肾方水煎剂灌胃,西药组予强的松片混悬液灌胃,模型组和对照组予0.9%氯化钠溶液灌胃。各组均每次灌胃体积均为0.01mL/g,1次/d,共8周。连续干预8周后,从眼眶静脉采血,室温静置4h,3 000r/min离心10min,分离血清样本,-80℃保存待用。采血后处死小鼠,选取皮损组织分成2份,一份用甲醛固定,另一份-80°C保存,以备蛋白表达检测。
1.4 观察指标及方法
1.4.1 一般情况观察 观察各组小鼠的毛色光泽、脱毛情况、活动状态及颈部、腋下、腹股沟淋巴结肿大的情况。
1.4.2 血清免疫指标检测 采用ELISA检测试剂盒检测小鼠血清IL-6、IL-10含量,具体操作依据试剂盒说明书进行,根据标准品的含量及对应的光密度(optical density,OD)值计算出标准曲线的直线回归方程,再根据样品的OD值在回归方程上计算出对应的样品含量。
1.4.3 皮肤组织病理学观察 将甲醛固定的小鼠皮损组织制成石蜡块,4μm切片后依次脱蜡脱水,苏木精-伊红(hema toxylin-eosin,HE)染色,分别在200、400倍光镜下观察各组皮肤病理改变情况。
1.4.4 皮肤组织JAK1和STAT3蛋白表达检测 取-80℃保存的小鼠皮损组织,采用Western blot法检测。皮肤组织块称重,利用液氮、研钵粉碎组织块,加入细胞裂解液,按说明书进行操作,提取的蛋白-20℃保存备用。取等量的蛋白提取物30μg(体积×蛋白质浓度),十二烷基硫酸钠-SDS经聚丙烯酰胺凝胶电泳(sodium dodecylsulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)电泳后转膜;分别加入JAK1、STAT3单克隆抗体 (稀释比例:1:1 000),4℃孵育过夜,以三乙醇胺吐温缓冲液(triethanolamine buffered saline solution-tween,TBS-T)洗涤3次,每次10min,加入二抗,4℃缓慢摇动孵育1h,洗涤后以ECL试剂盒进行化学发光,暗室曝光4min显像。将胶片进行扫描存档,Photoshop整理去色,Alpha软件处理系统分析目标条带的光密度值。
1.5 统计学分析 采用SPSS 19.0统计软件进行统计学分析,计量资料以±s表示,组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠一般情况结果比较 对照组小鼠皮毛和活动正常,颈部、腋下、腹股沟未见明显肿大的淋巴结;模型组小鼠皮毛晦暗枯槁、缺乏光泽,头部皮肤毛发缺损,肿大淋巴结数量明显增多;与模型组比较,中药组和西药组小鼠毛色、皮损明显减轻,均未见毛发缺损,中药组小鼠肿大淋巴结的数量明显减少,西药组未见明显肿大的淋巴结。
2.2 各组小鼠血清IL-6、IL-10含量比较 与对照组比较,模型组小鼠血清IL-6、IL-10含量均明显升高(P<0.01)。与模型组比较,中药组、西药组血清IL-6、IL-10含量均明显下降(P<0.01)。与西药组比较,中药组血清IL-6含量差异无统计学意义(P>0.05);血清IL-10含量明显升高(P<0.05)。见表1。表明解毒祛瘀滋肾方和强的松均能有效降低小鼠血清IL-6、IL-10含量,但解毒祛瘀滋肾方降低血清IL-10的能力弱于强的松。
2.3 皮肤组织形态学观察结果 对照组小鼠基底细胞未见明显液化变性,真皮层无明显淋巴细胞浸润。见图1A1~2。与对照组比较,镜下可见模型组小鼠真皮层被增生的结缔组织取代,可见大量成纤维细胞与纤维细胞,并有较多淋巴细胞与中性粒细胞浸润;皮肤表皮层基底细胞液化变性。见图1B1~2。中药组表皮层少见基底细胞液化变性,真皮层可见少量淋巴细胞浸润。见图1C1~2。与模型组比较,中药组小鼠皮肤组织基底细胞液化变性明显减轻,淋巴细胞浸润明显减少。西药组表皮层可见少量基底细胞液化变性,真皮层可见极少量淋巴细胞浸润。见图1D1~2。
表1 各组小鼠血清IL-6、IL-10含量比较(μg·mL-1,±s)Tab.1 Comparison of serum contents of IL-6 and IL-10 in each group(μg·mL-1,±s)

表1 各组小鼠血清IL-6、IL-10含量比较(μg·mL-1,±s)Tab.1 Comparison of serum contents of IL-6 and IL-10 in each group(μg·mL-1,±s)
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,△△P<0.01;与西药组比较,#P<0.05Note:Compared with control group, *P<0.05, **P<0.01;compared with model group,△△P<0.01;compared with western medicine group,#P<0.05
组别 n IL-6 IL-10对照组 10 9.46±1.99 20.36±3.48模型组 10 39.28±8.73** 113.85±25.07**中药组 10 18.65±5.02**△△ 39.20±10.60**△△#西药组 10 15.79±5.18*△△ 28.01±7.25△△
2.4 各组小鼠皮肤组织JAK1和STAT3蛋白表达比较与对照组比较,模型组JAK1、STAT3蛋白表达水平均明显升高(P<0.01);与模型组比较,中药组、西药组JAK1、STAT3蛋白表达水平均明显降低(P<0.01);与西药组比较,中药组JAK1、STAT3蛋白表达水平差异无统计学意义(P>0.05)。见图2、表2。
3 讨论
SLE作为一种典型的自身免疫性疾病,临床表现差异较大,通常包括皮疹、关节炎和肾炎等[8-9]。皮肤损害如颊部红斑、脱发、黏膜溃疡、盘状病变等是SLE最常见的临床症状之一,发生率80%~90%[10]。因其出现较早,且与病情密切相关,因此在SLE的诊断及治疗中有着重要的意义[11]。
SLE在中医学中属 “日晒疮”“蝴蝶斑”“阴阳毒”等范畴。实践证明,中医药在SLE的临床治疗中表现出较大的潜力,解毒祛瘀滋肾方是范永升教授临床治疗该疾病的经验方。SLE以肝肾阴虚为本,热毒血瘀为标,解毒祛瘀滋肾方以生地黄为君,清热凉血益阴;臣以白花蛇舌草、升麻清热解毒消斑,鳖甲补阴益肾退热;佐以赤芍、积雪草活血散血,青蒿退热开胃醒脾、疏理少阳气机;佛手、生甘草为使药疏理气机、调和诸药,诸药合用,标本兼治,共奏清热解毒、活血化瘀、益肾养阴之功。研究发现,解毒祛瘀滋肾方具有明显的抗炎、调节免疫、改善代谢紊乱、降低西药毒副作用及减少感染等作用,并且能显著改善SLE引起的皮肤损害[4,7,12]。 本研究中,与模型组比较,解毒祛瘀滋肾方干预后的MRL/lpr小鼠脱毛现象及皮肤病理损害均得到一定程度的改善,再一次验证了解毒祛瘀滋肾方对SLE皮肤损害的治疗作用。
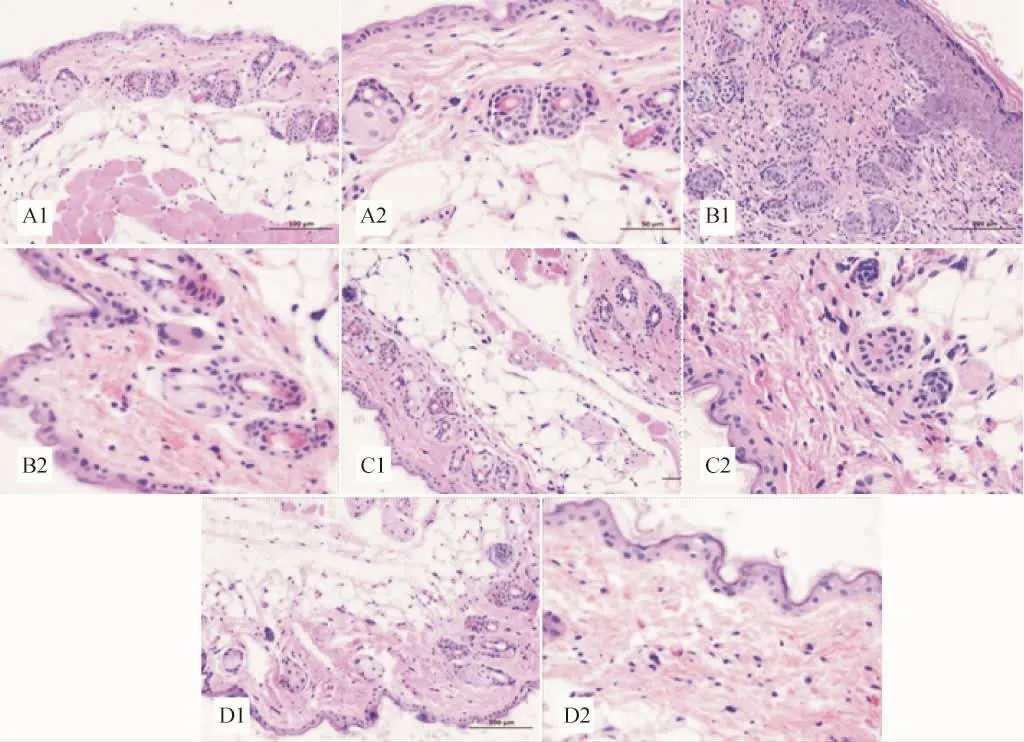
图1 各组小鼠皮肤组织病理切片(HE染色)Fig.1 Pathological sections of skin tissue in each group (HE staining)
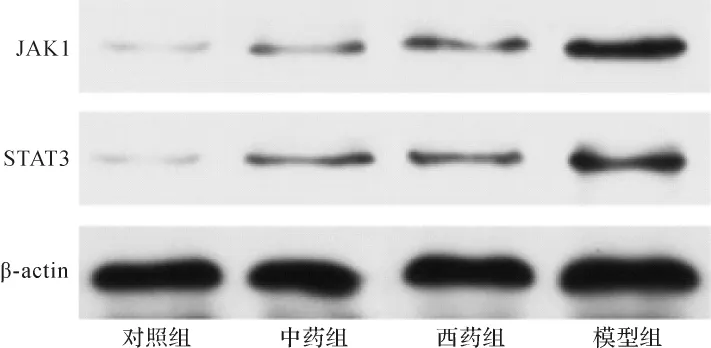
图2 各组小鼠皮肤组织JAK1、STAT3蛋白表达比较Fig.2 Comparison of protein expression of JAK1 and STAT3 in skin tissue in each group
表2 各组小鼠皮肤组织JAK1、STAT3蛋白表达比较(±s)Tab.2 Comparison of protein expression of JAK1 and STAT3 in skin tissue in each group(±s)

表2 各组小鼠皮肤组织JAK1、STAT3蛋白表达比较(±s)Tab.2 Comparison of protein expression of JAK1 and STAT3 in skin tissue in each group(±s)
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,△△P<0.01Note:Compared with control group, *P<0.05, **P<0.01;compared with model group,△△P<0.01
组别 n JAK1相对表达量 STAT3相对表达量对照组 10 0.076±0.040 0.092±0.065模型组 10 0.596±0.186** 0.629±0.215**中药组 10 0.197±0.486*△△ 0.230±0.106*△△西药组 10 0.235±0.087**△△ 0.336±0.141**△△
SLE疾病活动期表现出T、B淋巴细胞的过度活化、细胞因子网络失衡。IL-6、IL-10是辅助性T细胞2(helper T lymphocyte 2,Th2)分泌的细胞因子,在SLE活动期血清IL-6、IL-10含量上调,能够促进B细胞的增殖分化,并可通过JAK1/STAT3通路刺激自身抗体产生,进而导致循环免疫复合物堆积,引起组织和器官损伤[13-15]。JAK/STAT是一种多效联级信号通路,主要传导细胞增殖凋亡以及免疫调节等信号,是大量细胞因子和生长因子信号传导的主要途径,其中也包括IL-6、IL-10。IL-6、IL-10分别通过与白介素-6受体(interleukin-6 receptor,IL-6R)、白介素-10受体(interleukin-10 receptor,IL-10R) 结合, 启动JAK1/STAT3信号转导通路。IL-6、IL-10分别与相应受体结合后,产生IL-6/IL-6R、IL-10/IL-10R复合体,促使JAK1活化,进而促进STAT3的酪氨酸残基磷酸化,使STAT3与其受体分离,形成同源或者异源二聚体,转移到细胞核中并与靶基因结合,调控基因转录[16]。研究表明在SLE疾病过程中,调节血清细胞因子水平和抑制JAK/STAT3信号通路均可抑制自身抗体的产生[17],缓解疾病状态。本研究中,与对照组比较,模型组小鼠血清IL-6、IL-10含量明显增高,皮损组织中JAK1、STAT3蛋白表达水平也明显增高。经强的松、解毒祛瘀滋肾方治疗后血清IL-6、IL-10含量明显降低,皮肤组织JAK1、STAT3蛋白表达亦明显降低。与西药组比较,中药组血清IL-6含量及皮损组织中JAK1、STAT3蛋白表达水平差异无统计学意义,但血清IL-10含量明显升高。以上研究结果表明,解毒祛瘀滋肾方、强的松均能有效降低小鼠血清IL-6、IL-10含量,并能有效抑制皮肤组织JAK1、STAT3蛋白表达,但解毒祛瘀滋肾方降低血清IL-10的能力弱于强的松。
综上所述,本研究在前期临床观察基础上探讨了解毒祛瘀滋肾方对SLE皮损组织JAK/STAT信号通路的影响。结果表明,解毒祛瘀滋肾方有抗炎、免疫调节等多方面的作用,其作用机制可能与抑制JAK/STAT信号通路的过度激活有关。后续研究将进行其他信号通路相关指标检测,以进一步明确解毒祛瘀滋肾方对SLE的多靶点作用机制。

