花生清蛋白的分离纯化及抗氧化、DNA酶活性研究
俞 超 胡攀婧 蔡旭正 沈 磊 周晓玲 王荣兵 汪财生
(浙江万里学院生物与环境学院,浙江 宁波 315100)
花生(ArachishypogaeaL.)为双子叶植物,富含脂肪、糖类、蛋白质、维生素等营养物质,且花生仁中富含油脂,也是一种重要的油料作物,在全球范围内广泛种植。花生蛋白属于贮藏蛋白,按其溶解性可分为水溶性蛋白和盐溶性蛋白,水溶性蛋白主要为花生2S清蛋白,约占21%;盐溶性蛋白主要包括花生球蛋白和伴花生球蛋白,约占79%[1]。对50份花生种质中的贮藏蛋白的分析结果表明,球蛋白显示出最大的多样性(77.2%),其次是清蛋白(52.3%),表明种子蛋白质组分可以作为评估花生种质间变异性的重要标记[2]。花生蛋白的提取方法包括冷冻沉淀法[3]、碱提酸沉法[4]和硫酸铵沉淀法[5]。硫酸铵沉淀法通过调节硫酸铵浓度,沉淀不同颗粒大小的蛋白,且蛋白在硫酸铵中较稳定,是应用较广泛的蛋白组分分离方法。目前关于花生种子中的不同蛋白组分的研究少有报道,尤其是水溶性清蛋白。
植物清蛋白是一类沉降系数为2的混合贮藏蛋白,分子量范围为10~20 kDa[6],有10~12个亚基[7],氨基酸成分中含有大量含硫氨基酸[8],可溶于水、稀盐、稀酸或稀碱溶液,并可加热固化。研究发现,植物种子清蛋白具有过敏原特性,如花生、芥菜、蓖麻、芝麻子、桃核及腰果等植物种子[8-9]。随着研究的不断深入,植物种子清蛋白其他的生物学活性也逐渐被发现,如抗细菌[10]、抗真菌[11-12]、DNA酶活[6]、胰蛋白酶抑制活性[13]、抗氧化[14]等,具有重要的价值和抗菌潜力,已成为生命科学研究的一个热点。
植物蛋白抗氧化性可以保护组织免受氧化损伤,防止细胞老化;植物DNA酶对DNA的剪切催化是生命体必不可少的生化过程,DNA降解与生命体抵御外界病原微生物有密切关系[15-16],DNA酶催化DNA降解的过程可依赖金属离子,也可不依赖金属离子。花生蛋白活性研究侧重于抗氧化肽[17]、抗菌肽[18]等,目前,有关花生清蛋白生物活性的研究甚少,其抗氧化性及DNA酶活性鲜有报道。本试验从脱脂的花生粕中提取并纯化获得花生种子清蛋白,并研究其抗氧化、DNA酶活性,以期深入了解花生清蛋白在氧化应激和免疫应激系统中的作用,为获得高效花生抗氧化肽和抗菌肽开拓新途径。
1 材料与方法
1.1 材料与试剂
试验所用花生为山东产鲁花9号,剥壳后烘干备用。
1,1-二苯基-2 -三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,6- 二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT)、标准蛋白、pET28a质粒,购于生物工程(上海)有限公司;其余常规生化试剂均为分析纯。
1.2 主要仪器与设备
TU-1810紫外分光光度计,北京普析通用仪器有限责任公司;AKTA Prime Plus蛋白层析系统、SE250垂直电泳槽,美国GE公司;5804R离心机,德国Eppendorf公司;BG-subMIDI水平电泳槽,北京百晶生物技术有限公司;Gel Dcode XR+凝胶成像系统,美国Bio-Rad公司;FW135粉碎机,天津市泰斯特仪器有限公司。
1.3 试验方法
1.3.1 花生脱脂处理 将花生仁除外衣后放入中草药粉碎机粉碎,按6 mL·g-1加入正己烷,混匀后置4℃冰箱过夜进行第一次脱脂处理。将脱脂后样品抽滤,除去滤液,按3 mL·g-1再次加入正己烷,混匀,置4℃冰箱过夜进行第二次脱脂处理。取出二次脱脂后的花生样品,抽滤风干后即为脱脂花生粉,于4℃冰箱保存备用。
1.3.2 花生清蛋白的提取与初步分离 参照文献[19]采用硫酸铵分级沉淀法。脱脂花生粉中加入磷酸缓冲溶液(pH值9.0),液料比10∶1(mL·g-1),60℃提取60 min,15 294×g离心20 min,上清液即为花生粗蛋白提取液。加入硫酸铵至饱和度45%,室温静置过夜,425×g离心20 min,取上清液于3 500 D透析袋4℃透析24 h后为一级沉淀花生清蛋白AHP1;向AHP1中加入硫酸铵粉末至饱和度65%,4℃静置过夜,6 797×g离心20 min,取上清液3 500 D透析袋4℃透析24 h后为二级沉淀花生清蛋白AHP2; 向AHP2中加入硫酸铵粉末至饱和度85%,4℃静置过夜,956×g离心20 min,取上清液4℃透析(3 500 D)24 h后为三级沉淀花生清蛋白AHP3。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)检测所有蛋白样品,并将蛋白样品-40℃真空冷冻干燥48~36 h至粉末,保存于4℃冰箱。
1.3.3 花生清蛋白的纯化 采用DEAE-52 (φ 2.0 cm×25 cm)阴离子交换柱纯化清蛋白。2 g花生清蛋白冻干粉溶于50 mL 0.01 mol·L-1磷酸缓冲液(含0.14 mol·L-1NaCl,pH值9.0),上样量3 mL,280 nm波长扫描吸收峰,收集纯化后的清蛋白,SDS-PAGE电泳检测其相对分子量。
1.3.4 花生清蛋白抗氧化性测定 DPPH自由基清除能力参照丁浩淼等[20]的方法测定,配制0.02、0.04、0.06、0.08、0.10 mg·mL-1花生清蛋白溶液,以无水乙醇为空白,于517 nm波长处测定吸光度值。按照公式计算DPPH自由基清除率(P):
P=[A0-(Ai-Aj)]/A0×100%
(1)
式中,A0为2 mL DPPH溶液与2 mL无水乙醇的吸光度值;Ai为2 mL DPPH溶液与2 mL不同浓度的花生2S清蛋白的吸光度值;Aj为2 mL清蛋白溶液与2 mL无水乙醇的吸光度值。
羟基自由基清除能力参考Avellar等[21]的方法测定,以蒸馏水为空白,在510 nm波长处测量各浓度下的吸光度值。按照公式计算羟基自由基清除率:
羟基自由基清除率=(A0-Ax)/A0×100%
(2)
式中,A0为空白对照组的吸光度值,Ax为加入样品后的吸光度值。
抗氧化性试验均以抗氧化剂BHT为阳性对照。
1.3.5 花生清蛋白DNA酶活性测定 参考Tomar等[22]的方法测定。用50 mmol·L-1Tris-HCl(pH值7.4)缓冲液将花生2S清蛋白分别稀释至0.1、0.2、0.4、0.6、0.8 mg·mL-1,取各浓度的清蛋白15 μL,分别与5 μL的0.1 mg·mL-1pET28a质粒混合,37℃条件下保温2 h后进行电泳试验,观察DNA条带。以Tris-HCl缓冲液和质粒的混合液为对照。
配制浓度为100 mmol·L-1一价金属离子KCl、NaCl溶液,以及浓度为10 mmol·L-1的二价金属离子MgCl2、CaCl2溶液。取5 μL pET28a质粒、10 μL 0.1 mg·mL-1清蛋白、5 μL金属离子溶液制成混合液,37℃保温2 h后进行电泳试验,观察DNA条带。以质粒、清蛋白混合液为对照。
1.4 数据分析
采用Excel 2007 软件进行数据分析,采用Origin 9.0软件制图。
2 结果与分析
2.1 花生清蛋白的提取
由图1可知,45%硫酸铵沉淀所得AHP1蛋白种类较多,且既有大于97.4 kDa的大分子量蛋白,也有小于20 kDa的小分子量蛋白,不能完全分离出清蛋白。经85%硫酸铵沉淀所得AHP3蛋白中,有小于20 kDa的小分子量蛋白,但浓度较低,且分子量在66.2 kDa左右的杂蛋白浓度较高,可能是伴花生球蛋白。65%硫酸铵所得AHP2蛋白,分子量几乎都介于14.4~20 kDa之间,与清蛋白分子量范围相符,且其他杂蛋白含量较少,因此选用AHP2蛋白样品进行下一步的纯化。
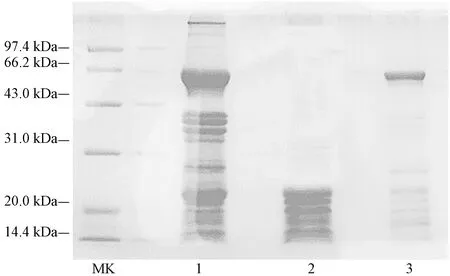
注:MK:标准蛋白;1:AHP1;2:AHP2;3:AHP3。Note:MK:Marker. 1:AHP1. 2:AHP2. 3:AHP3.图1 分级沉淀分离花生蛋白电泳图Fig.1 SDS-PAGE of of protein separated from Arachis hypogaea L. by fractional precipitation
2.2 花生清蛋白的纯化
DEAE-52柱纯化后的花生清蛋白出现一个明显吸收峰(图2),电泳显示在14.4~20.0 kDa分子量范围内有3条较清晰条带(图3),利用相对迁移率计算得到其相对分子质量分别为 14.5、15.5、17.2 kDa。
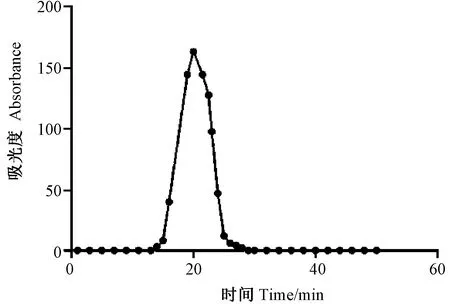
图2 DEAE-52柱纯化花生清蛋白Fig.2 Purification of albumin of Arachis hypogaea L. by DEAE-52 column
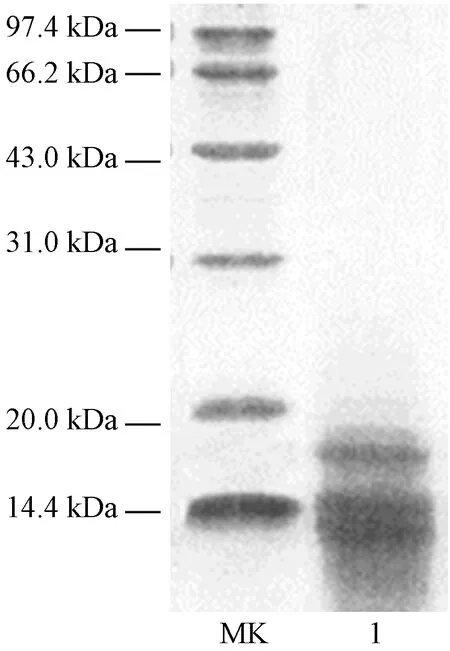
注:MK:标准蛋白;1:纯化后的花生清蛋白。Note:MK: Marker. 1: Purified peanut albumin.图3 纯化后花生清蛋白电泳图Fig.3 SDS-PAGE of purified albumin of Arachis hypogaea L.
2.3 花生清蛋白的抗氧化性
由图4可知,花生清蛋白浓度从0.02 mg·mL-1增加到0.10 mg·mL-1时,其DPPH自由基清除率从26.3%升至45.0%左右,DPPH自由基清除活力与花生清蛋白浓度呈正相关,不同BHT浓度对DPPH自由基清除率影响不大,保持在80%左右。由图5可知,花生清蛋白对羟基自由基清除活力与花生清蛋白浓度也呈明显正相关,当其蛋白浓度从0.02 mg·mL-1增加至0.10 mg·mL-1时,对羟基自由基的清除率从10.8%增加至93.5%;当花生清蛋白浓度大于0.06 mg·mL-1时,对羟基自由基的清除率超过了BHT。
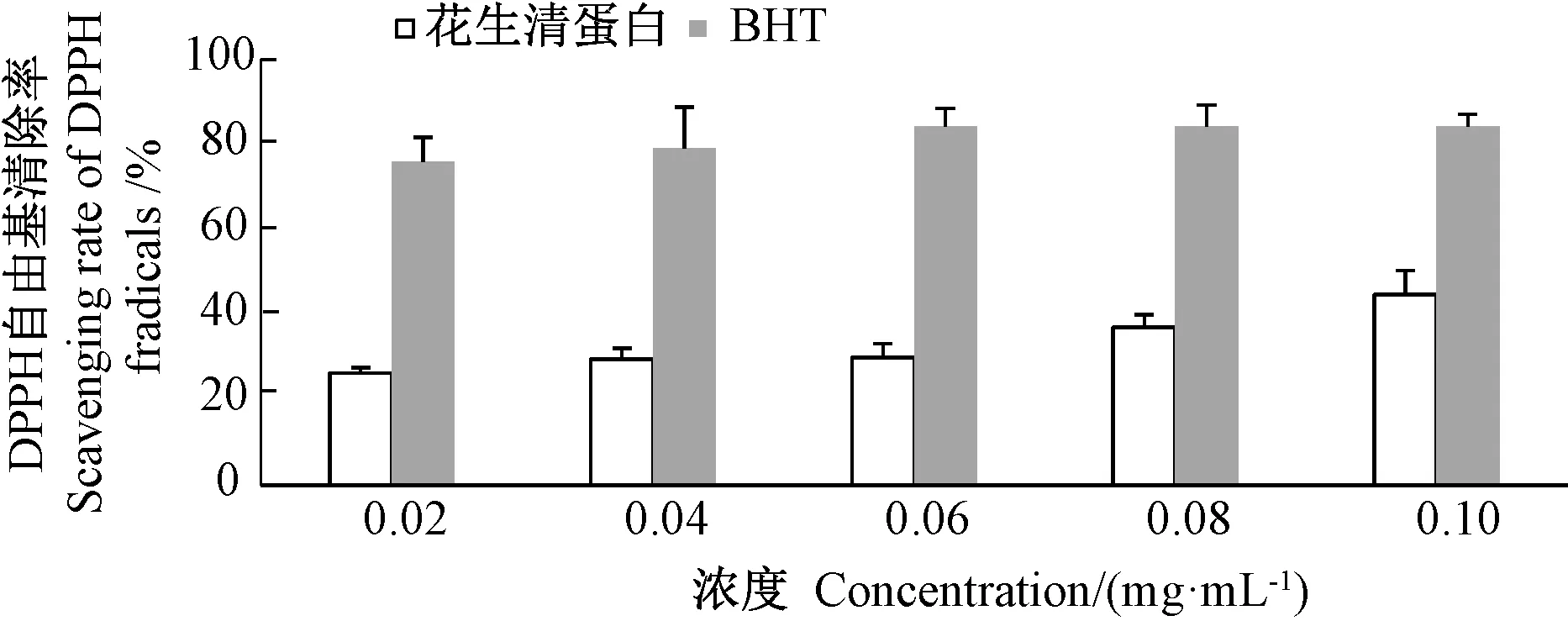
图4 花生清蛋白对DPPH自由基清除活力Fig.4 DPPH radical scavenging activity of albumin of Arachis hypogaea L.
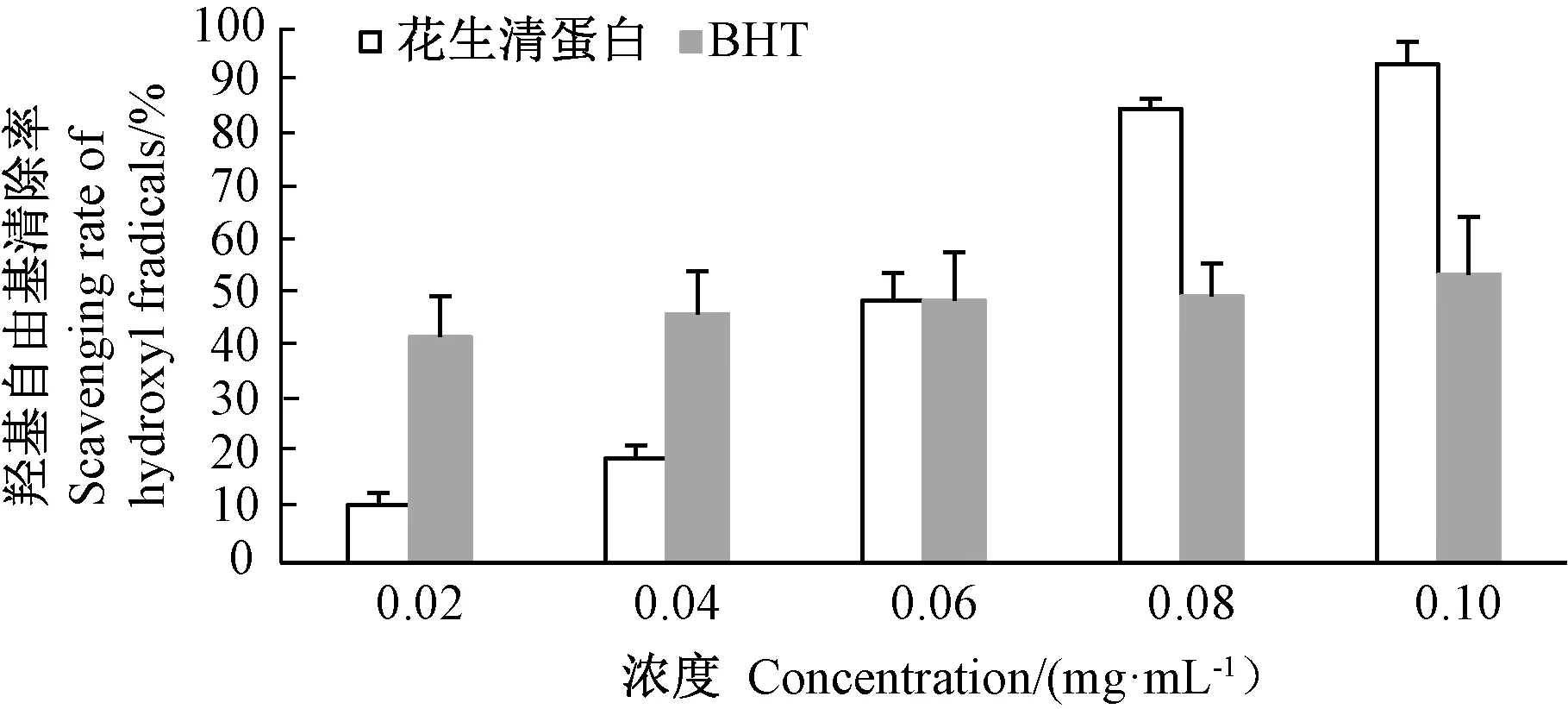
图5 花生清蛋白对羟基自由基清除活力Fig.5 Hydroxyl scavenging activity of albumin of Arachis hypogaea L.
2.4 花生2S清蛋白的DNA酶活性
由图6可知,电泳图中质粒3条带分别显示开环型、线型、闭合环型3种构型,随着花生清蛋白浓度的升高,质粒条带逐渐变暗;当清蛋白浓度为0.8 mg·mL-1时,质粒条带完全消失,产生降解后的小分子DNA拖带。表明花生清蛋白DNA酶活性与其浓度有关,浓度越高降解效果越好。

注:1:CK;2~6:花生清蛋白浓度依次为0.1、0.2、0.4、0.6、0.8 mg·mL-1。Note:1: CK. 2-6: 0.1、0.2、0.4、0.6、0.8 mg·mL-1albumin.图6 蛋白浓度对花生清蛋白DNA酶活性的影响Fig.6 Effect of protein concentration on DNase degradation activity of albumin of Arachis hypogaea L.
2.5 金属离子对花生2S清蛋白DNA酶活性的影响
由图7可知, Ca2+、Mg2+、K+、Na+4种金属离子均有增强清蛋白DNA酶活性的作用,尤其在二价金属离子Ca2+、Mg2+的促进作用下,质粒条带彻底降解;而一价金属离子K+、Na+并未促进花生清蛋白完全降解质粒,质粒条带仍可见。比较质粒条带及降解后小分子量DNA条带的亮度,4种金属离子增强清蛋白DNA酶活性的能力由大到小依次是Mg2+>Ca2+>Na+>K+。

注:1:CK; 2~5: 花生清蛋白样品中依次加入Ca2+、Mg2+、K+、Na+。Note:1: CK. 2-5:Mixture added Ca2+、Mg2+、K+、Na+ in sequence.图7 金属离子对花生清蛋白DNA酶活性的影响Fig.7 Effect of metal ions on DNase activity of albumin of Arachis hypogaea L.
3 讨论
硫酸铵分级沉淀法中硫酸铵的浓度是分离蛋白的关键,此法已应用于各种植物种子蛋白的提取。该方法用于提取枸杞蛋白,40%硫酸铵浓度是枸杞的最佳提取条件[23]。落葵种子蛋白提取工艺优化试验中,95%饱和硫酸铵沉淀效果最好[24]。硫酸铵分级沉淀法是一种分离富硒大豆蛋白组分的有效方法,且60%硫酸铵较佳[25]。用90%饱和硫酸铵从扁豆种子中提取的清蛋白的分子量为26.5 kDa[26],说明植物蛋白提取的最适硫酸铵饱和度与不同来源蛋白的溶解度有关。本研究发现,采用65%硫酸铵分离花生清蛋白的效果最好,且纯化后的花生清蛋白电泳结果表明其有3个亚基,相对分子质量均小于20 kDa,与巴西坚果分子量(12 kDa)相似[27]。硫酸铵分级沉淀法步骤简便、效果明显,适合分离小分子量花生清蛋白,且能够较好地保留花生清蛋白的活性。
花生清蛋白在清除DPPH自由基和羟基自由基中均表现出较强的能力。花生清蛋白DPPH自由基清除能力与荞麦清蛋白相当,但花生2S清蛋白的羟基自由基清除效果更佳[28]。本试验中花生清蛋白的自由基的清除能力与其蛋白浓度呈正相关,这一结果与火龙果籽清蛋白抗氧化特性一致[29]。最新研究发现,花生叶中可溶性蛋白也具有抗氧化性[30],其DPPH自由基清除能力高于花生清蛋白,但羟基自由基清除能力弱于花生清蛋白。
花生清蛋白具有DNA酶活性,可降解DNA,Ca2+、Mg2+、Na+、K+金属离子均可增强花生清蛋白的DNA酶活性。这是继葫芦科南瓜[22]、夹竹桃科靛木[31]后,首次在豆科植物花生的清蛋白中发现有DNA酶活性,这可能是小分子量的清蛋白所特有的功能。已知Mg2+对多种酶活力都有促进作用,如DNA聚合酶、磷酸酶等,广泛参与生物体各种能量物质代谢。本研究中Mg2+也是花生清蛋白最佳的DNA酶活促进剂,这可能与其蛋白结构性质有关,具体机理有待进一步研究。此外,花生粕中含丰富的蛋白质[32-33],下一步可深入研究蛋白结构与功能间的关系,从蛋白组学层面挖掘更多有开发利用价值的活性功能,为花生的产品开发、高值化利用提供基础。
4 结论
本试验从花生粕中分离纯化得到花生清蛋白,电泳结果表明,其由3个亚基组成,相对分子质量分别为 14.5、15.5、17.2 kDa。花生清蛋白具有体外抗氧化性及DNA酶活性,且Ca2+、Mg2+、K+、Na+4种金属离子均能增强清蛋白DNA酶活性,DPPH自由基和羟基自由基清除活力均与清蛋白浓度呈正相关。

