特发性膜性肾病患者抗磷脂酶A2受体抗体和C5a补体水平与疾病活动及预后的关系
张林波 姜文
膜性肾病(MN)是以电子显微镜观察到的上皮下免疫复合物沉积为主要病理特征,70%~75%的MN属于抗祖细胞抗原自身抗体的自身免疫性疾病,如抗磷脂酶A2受体(PLA2R)抗体、1型血小板反应蛋白7A域等[1-3]。60%~75%的特发性MN(IMN)是由于抗PLA2R抗体所致。有研究结果发现,肾脏组织中的PLA2R抗体阳性、血清PLA2R抗体滴度升高与疾病活动度增加和肾移植后MN复发风险增高相关,揭示了抗PLA2R抗体对MN的直接致病性[4-6]。本研究旨在探讨抗PLA2R抗体和IMN疾病活动度的相关性,并比较抗PLA2R抗体滴度和补体激活产物C5a与IMN短期预后的相关性。
对象与方法
1.对象:纳入2015年1月~2016年12月于我院治疗的IMN患者72例。纳入标准:(1)年龄20~80岁;(2)病理检查结果确诊为IMN;(3)在免疫抑制剂治疗前进行肾脏病理活检。排除标准:(1)1年内失访;(2)合并恶性肿瘤、系统性红斑狼疮或肝炎;(3)实验室检查结果不完整。根据血清抗PLA2R抗体检测结果,将72例患者分为抗PLA2R抗体阳性组(阳性组,50例)和抗PLA2R抗体阴性(阴性组,22例),其中阳性组男33例,女17例,年龄37~79岁,平均年龄(60.42±12.31)岁;阴性组男15例,女25例,年龄34~78岁,平均年龄(58.22±14.63)岁。本研究经我院伦理委员会审批通过,所有患者均签署知情同意书。
2.方法
(1)临床资料收集:收集所有患者的临床资料,包括性别、年龄、是否合并糖尿病、高血压、高脂血症。收集患者肾穿刺病理活检前的血清白蛋白、总胆固醇、血清肌酐、估算的肾小球滤过率(eGFR)和尿蛋白丢失量(尿蛋白/肌酐比值,UPCR)。以UPCR反映蛋白尿严重程度,UPCR<0.3为完全缓解,0.3≤UPCR≤3.5或蛋白尿从初始值降低至少50%且至少2周UPCR<3.5为部分缓解[7]。1年内病情持续患者指患者UPCP>0.3持续1年及1年以上。
(2)血浆抗PLA2R抗体和C5a滴度检测:采用酶联免疫吸附试验(ELISA)检测血浆中抗PLA2R抗体及C5a水平。在室温下全血离心10 min分离血清,通过抗PLA2R抗体 ELISA试剂盒(Thermo Fisher公司)和C5a Elisa试剂盒(Thermo Fisher公司)分别测定血清中抗PLA2R抗体和C5a水平。血清中抗PLA2R抗体滴度≥20 RU/ml即可诊断为抗PLA2R抗体阳性。
(3)肾脏组织病理活检:在普通光学显微镜检测中,将肾脏组织病理标本用福尔马林固定后用石蜡包埋,并进行苏木素-伊红(HE)染色。在电子显微镜检测中,根据标准流程,将肾脏病理组织标本浸泡于2.5%戊二醛溶液中进行固定,并经锇酸染色、树脂包埋后切成70 nm厚薄片放置在铜网上,复染后进行透射电子显微镜观察。采用免疫荧光染色检测肾脏组织中免疫球蛋白(Ig),包括IgA、IgG和IgM,并根据荧光强度,采用半定量方法进行含量评估分析,总分为0~5分,分值越高,则Ig表达量越强,其中0分为阴性,1分为极弱阳性,2分为弱阳性,3分为中等阳性,4分为强阳性,5分为极强阳性。通过免疫荧光染色法对肾脏组织IgG亚型沉积情况进行分析,包括IgG1、IgG2、IgG3和IgG4。通过免疫组织化学染色检测肾脏组织中抗PLA2R抗体的表达情况,并根据染色阳性细胞百分比,分为高表达(≥50%阳性率)和低表达(<50%阳性率)。

结 果
1.两组患者临床资料比较:与阴性组比较,阳性组患者血清白蛋白水平更低、抗PLA2R抗体滴度更高(P<0.05)。但两组患者性别、年龄、合并疾病、UPCR、总胆固醇、血清肌酐、eGFR、C5a水平和免疫抑制剂使用率比较差异均无统计学意义(P>0.05)。见表1。

表1 两组患者临床资料比较
2.血浆与肾脏组织中抗PLA2R抗体表达量的相关性分析结果:血浆与肾脏组织中抗PLA2R抗体表达具有较强的一致性(χ2=31.001,P<0.001)。见表2。

表2 血浆与肾脏组织中抗PLA2R抗体表达量的相关性分析
3.血浆抗PLA2R抗体滴度与UPCR的关系:Spearman相关分析结果显示,血浆抗PLA2R抗体滴度与IMN患者的UPCR呈正相关(r=0.323,P=0.028)。但血浆C5a浓度与IMN患者的UPCR无明显相关性(r=-1.023,P=0.362)。
4.血浆抗PLA2R抗体滴度与肾小球Ig沉积程度的相关性分析结果:根据肾脏病理活检结果发现,IgG强阳性(IgG评分4~5分)患者的PLAR2抗体滴度明显高于IgG弱阳性患者[IgG评分0~3分,(154.32±24.21)RU/ml比(67.82±15.81)RU/ml,P=0.039]。对不同IgG亚型进行分析,IgG1、IgG2、IgG3和IgG4亚型患者的血浆抗PLA2R抗体水平比较差异无统计学意义[(102.31±21.18)RU/ml、(98.26±25.01)RU/ml、(116.29±27.84)RU/ml及(108.39±15.20)RU/ml,P>0.05]。肾脏组织中IgA阴性与IgA阳性沉积患者的血浆抗PLA2R抗体水平比较差异无统计学意义[(103.9±21.2)RU/ml比(107.8±25.3)RU/ml,P>0.05],且IgM阴性与IgM阳性沉积患者的血浆抗PLA2R抗体水平比较差异无统计学意义[(108.3±25.0)RU/ml比(105.2±21.7)RU/ml,P>0.05]。
5.影响IMN患者1年内病情持续的独立危险因素分析结果:抗PLA2R抗体阳性和未使用免疫抑制剂治疗是影响IMN患者1年内病情持续的独立危险因素(P<0.05)。见表3。
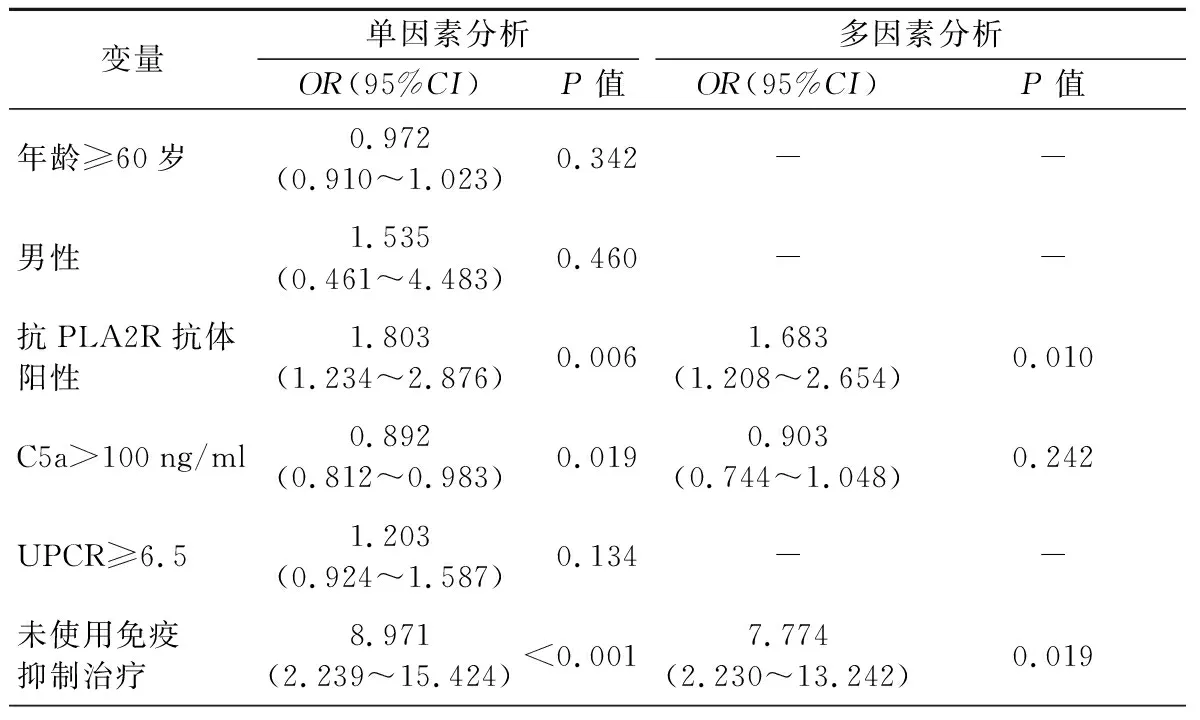
表3 影响IMN患者1年内病情持续的独立危险因素分析
讨 论
Beck等[4]最早发现抗PLA2R抗体是IMN患者自身免疫性抗体的靶标。随后Hofstra等[8]研究发现抗PLA2R抗体与MN疾病活动度相关。尽管有研究认为抗PLA2R抗体与蛋白尿的严重程度无关[9],但其与疾病缓解程度密切相关。本研究显示抗PLA2R抗体与蛋白尿严重程度呈正相关,血浆抗PLA2R抗体滴度与肾脏组织中的IgG沉积也密切相关。肾小球内低IgG沉积表明免疫复合物形成较少,提示肾小球破坏和蛋白尿程度较低。
在自身抗体与足细胞抗原结合后,免疫复合物形成可启动补体系统激活,导致膜攻击复合物插入足细胞,从而起到细胞毒性作用,进而破坏过滤屏障产生蛋白尿。在补体激活过程中存在补体剪切产物产生。C3剪切成C5是经典凝集素或补体替代途径的最终共同途径。剪切的补体片段可沉积在肾小球组织中如C3c,或释放到外周循环中如C5a。更多自身抗体可能在肾脏组织中形成更多免疫复合物,刺激更多补体激活,并导致更严重蛋白尿。此外,C5a是一种强烈的炎症激活物,可影响T淋巴细胞和树突状细胞功能。本研究发现抗PLA2R抗体阴性组与阳性组C5a水平比较差异无统计学意义。血浆C5a水平反映了补体激活和器官清除而产生的平衡状态。由于免疫复合物形成,在肾小球中产生的C5a可释放到外周循环中,因此IMN患者血浆C5a水平明显升高。由于C5a分子量较小,可轻易透过损伤肾小球而滤出。此外,血浆C5a可被高度血管化器官清除,或在肾小球中与炎症或肾小球细胞一起被螯合而清除,因此本研究中并未发现抗PLA2R抗体阴性组与阳性组C5a水平比较差异有统计学意义。
抗PLA2R抗体滴度是否与IMN患者预后相关目前尚无定论。Hoxha等[10]认为抗PLA2R抗体滴度较高IMN患者的蛋白尿缓解周期明显延长。而Bech等[11]则认为抗PLA2R抗体滴度不能有效评估IMN患者疾病预后情况。Medrano等[12]提出血浆抗PLA2R抗体滴度的改变早于蛋白尿的出现,且抗PLA2R抗体滴度下降与蛋白尿缓解存在时间滞后性。Tomas等[13]则进一步发现血浆高抗PLA2R抗体滴度与IMN患者肾功能的快速丧失有关。本研究也显示了抗PLA2R抗体滴度的升高是IMN患者病情持续的独立危险因素,抗PLA2R抗体滴度升高与IMN患者的预后降低密切相关。
综上所述,血浆抗PLA2R抗体滴度的升高可有效评估IMN患者疾病活动度和预后,为IMN患者的治疗和疾病活动度动态检测提供了新的生物学标志物。

