建立检测酱油中8种生物胺的液相色谱-串联质谱方法(LC-MS)
沙丽娜,吐尔洪·买买提,阿孜古丽·衣该木,艾买提江·阿衣甫别克,张明玥
(1.新疆维吾尔自治区药品检验研究院,乌鲁木齐 830011;2.新疆大学 化学学院 能源材料化学教育部重点实验室,乌鲁木齐 830046)
生物胺(biogenic amine, BA)是一种有生物活性的、低分子量的、含氮有机化合物的总称。生物胺对内脏功能和免疫系统的代谢过程起着非常重要的作用,主要存在于各种各样含蛋白质比较丰富的食物中,比如乳制品类、饮料、鱼产品类和各种发酵食品。据报道,生物胺是由原料中的微生物或者酶通过代谢产生的氨基酸脱羧酶作用形成的。它不仅在各种动植物的组织中存在,也微量存在于人体中。目前虽然制定食品中生物胺禁限用标准比较困难,但部分国家已经尝试根据不同食品的特性给出生物胺的限量标准。美国对水产品中组胺的限量为50 mg/kg,酪胺的限量范围为100~800 mg/kg;欧盟对食品中组胺的限量为100 mg/kg,酪胺的限量范围为100~800 mg/kg,对水产品中组胺的限量为100 mg/kg;而我国对鲐鲹鱼中组胺的限量为1000 mg/kg,对其他海产鱼类中组胺的限量为300 mg/kg。
酱油是一种世界流行的色、香、味俱全的液体调味品[1],具有特殊的香气、色泽、风味和体态[2],是人们在日常生活中获取盐类的一个重要来源[3],也是经常使用到的含有生物胺的发酵食品,有研究报道称高含量的酪胺可能与生产酱油过程中卫生条件不好有关,同时与尸胺和腐胺的高含量有关。人类食用到的微量的生物胺一般不会对自身造成不良影响,但积累到一定程度时,在体内就会产生毒害作用,比如血压变化、呼吸紊乱等不良反应。但是目前现行有效的酱油检测国家标准GB/T 5009.39-2003《酱油卫生标准的分析方法》中却没有生物胺的相关检测[4],故以人体健康和食品安全为起点,建立一种简易、灵敏、快速、高通量的生物胺含量检测方法有重要的意义。
如目前多数方法一样,食品中生物胺检测现行有效的国家标准GB/T 5009.208-2016《食品中生物胺的测定》中样品前处理需要衍生化[5-7],有些需要固相萃取小柱净化处理,而本次试验采用连续三相液液萃取的前处理方法,简单易行,毒害小。目前常用的检测方法主要包括高效液相色谱法、生物传感器法、气相色谱法、气相色谱-串联质谱法、液相色谱-质谱法、电化学法、离子色谱法、荧光光度法、分子印迹法和紫外可见光分光光度法等[8-15]。国标检测方法对于一些痕量的物质无法进行定量分析,故本次试验使用液相色谱-串联质谱法,并做了方法学试验。该方法检测时间短,且质谱法的检测灵敏度要远远高于液相色谱法,提高了对一些含量较低的样品检测的准确性,尤其对一些只需要定性检测的样品,提供了快速简便的检测方法。
1 材料与方法
1.1 材料与仪器
1.1.1 试验材料与试剂
生物胺标准品:色胺(纯度98%)、尸胺(纯度98%)、组胺(纯度≥98%)、苯乙胺(纯度99%)、腐胺(纯度≥98%)、酪胺(纯度≥98.5%)、精胺(纯度≥97%)、亚精胺(纯度≥98%),均购自上海源叶生物科技有限公司;乙醇:分析纯,天津市北联精细化学品开发有限公司;甲酸铵:色谱纯,赛默飞世尔科技(中国)有限公司;乙酸铵:色谱纯,ANPEL Laboratory Technologies(Shanghai) Inc.;甲醇、乙腈:均为色谱纯,购自赛默飞世尔科技(中国)有限公司;品牌1及品牌2生抽酱油、红烧酱油、老抽酱油、味极鲜和海鲜酱油:均购自本地超市。
1.1.2 试验仪器
XEVO-TQS Micro型液相色谱-串联质谱仪 美国Waters公司;CPA 225D型电子分析天平(感量十万分之一) 德国赛多利斯公司;RP-1D型磁力搅拌器 Wiggens Labortechnik公司;DMT-2500型涡旋混合仪 Miulab公司;MAXQ4000型震荡摇床 美国Thermo Scientific公司;Milli-Q超纯水制备仪 美国Millipore公司。
1.2 试验方法
1.2.1 对照品溶液的制备
分别称取8种生物胺标准品各约20 mg(精确至0.00001 g),置于10 mL容量瓶中,作为标准溶液储备液,再分别取适量制成系列浓度为1,5,10,20,50,100 ng/mL的标准溶液,待测。混合标准溶液的总离子流(total ion chromatography,TIC)图见图1。

图1 8种生物胺的混合标准溶液TIC图
1.2.2 供试品溶液的制备
取酱油样品3 mL加入5 mL、pH值为13的氢氧化钠溶液中,放在转速为500 r/min的磁力搅拌器上,用二氯甲烷进行萃取,通过选择性透过膜后,由于浓度差进入另一边的二氯甲烷中,最终被反萃取至浓度为0.4 mol/L的盐酸溶液中,最后用滴管小心将混有样品的盐酸溶液吸取出来,过滤,待测。具体萃取装置图见图2。
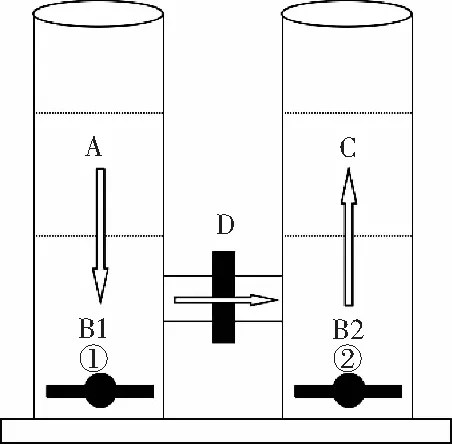
图2 萃取装置及过程图
1.2.3 试验条件

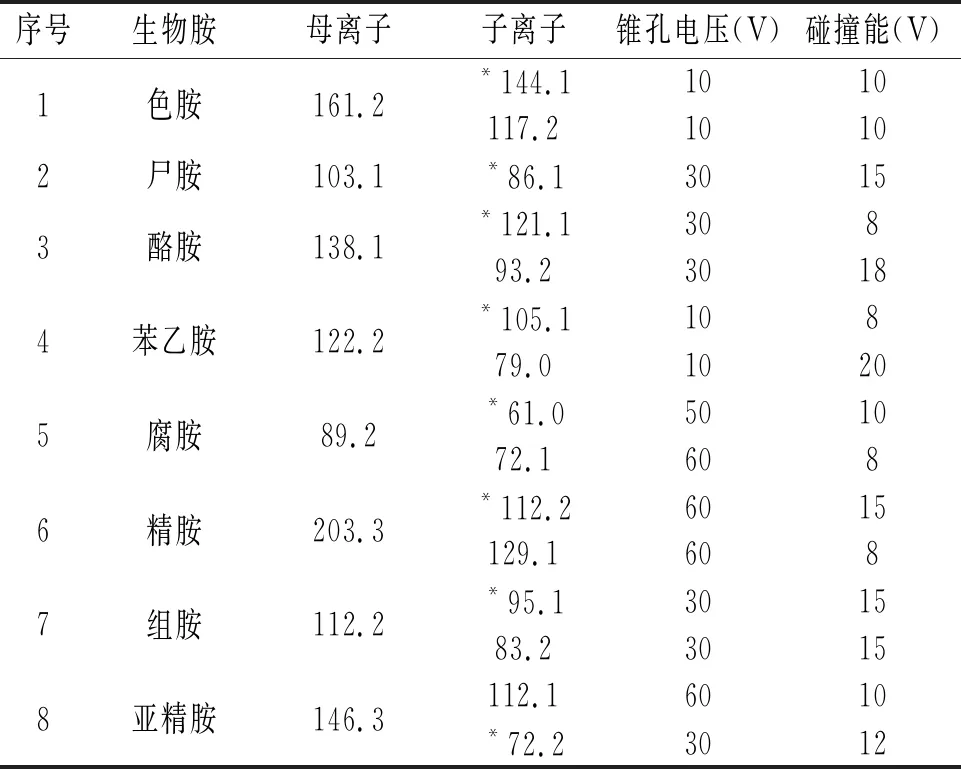
表1 8种生物胺的质谱检测条件
1.3 数据处理
根据测得的供试品溶液中生物胺的峰面积值,带入2.1得到的生物胺标准曲线回归方程中,计算出对应的生物胺浓度,按照下式计算待测供试品中生物胺的含量ω:
式中:ω表示样品中激素类组分的质量分数,μg/g;ρ表示从标准曲线得到待测组分的质量浓度,μg/mL;V表示样品定容体积,mL;m表示样品取样量,g。
2 结果与分析
2.1 方法学试验
2.1.1 标准曲线
按照“1.2.3”项下的试验条件,将上述样品及标准品溶液注入液相色谱中,进行生物胺的含量检测,所得的生物胺的标准曲线见表2。

表2 8种生物胺的标准曲线
2.1.2 精密度试验
取标准品溶液,连续测定6次,记录结果数据。测定标准品溶液的生物胺含量结果的RSD(n=6)为0.30%~0.86%。
2.1.3 稳定性试验
选取标曲中间点(即浓度为20 ng/mL左右)的标准品溶液,测量其在6,12,24,30,40,48 h时的峰面积,标准品溶液的生物胺含量结果的RSD(n=6)为2.19%~6.44%。
2.1.4 检出限与定量限
经试验验证,选取标曲的最低点(约1.0 ng/mL)作为生物胺的定量限(苯乙胺因响应值较低,故其定量限约为3.0 ng/mL);将标曲最低点精密称取3 mL,用0.1 mol/L的盐酸溶液定容至10 mL容量瓶中,即浓度为约0.3 ng/mL作为仪器的检出限(苯乙胺因响应值较低,故其定量限约为1.0 ng/mL)。
2.1.5 加标回收率
将8种生物胺的混合标准品溶液加入空白样品(与酱油基质相同的纯净水)中,一般选取标准曲线中间点的浓度(本次试验选取生物胺的浓度约为20 ng/mL),分别平行加入6份空白样品中,按照“1.2.2”项下供试品溶液的制备方法制备,待测。得到的加标回收率的具体数据见表3。
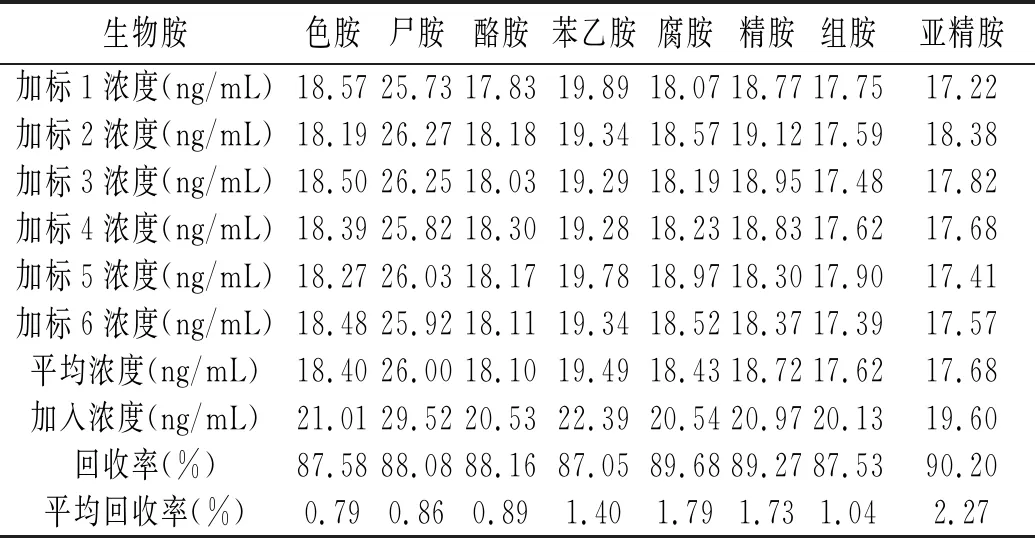
表3 8种生物胺的加标回收率结果(n=6)
2.1.6 样品测定结果
购买了2个品牌10个批次的酱油,其中,生抽和老抽都是经过酿造发酵加工成的酱油,红烧酱油属于老抽的一种;高盐稀态发酵工艺适合制作生抽及味极鲜[16],海天味业则以广式高盐稀态发酵工艺为主,该方法便于实现工业化、节约化、清洁化生产, 并且酿制出的酱油呈香浓郁、品质优良[17];海鲜酱油是以特级生抽酱油为主料,配以经现代工艺提炼出的海鱼虾的精华液。按照“1.2.2”项下方法制成供试品溶液,按照“1.2.3”项下的试验条件分别进行测定,记录结果数据,结果见表4。
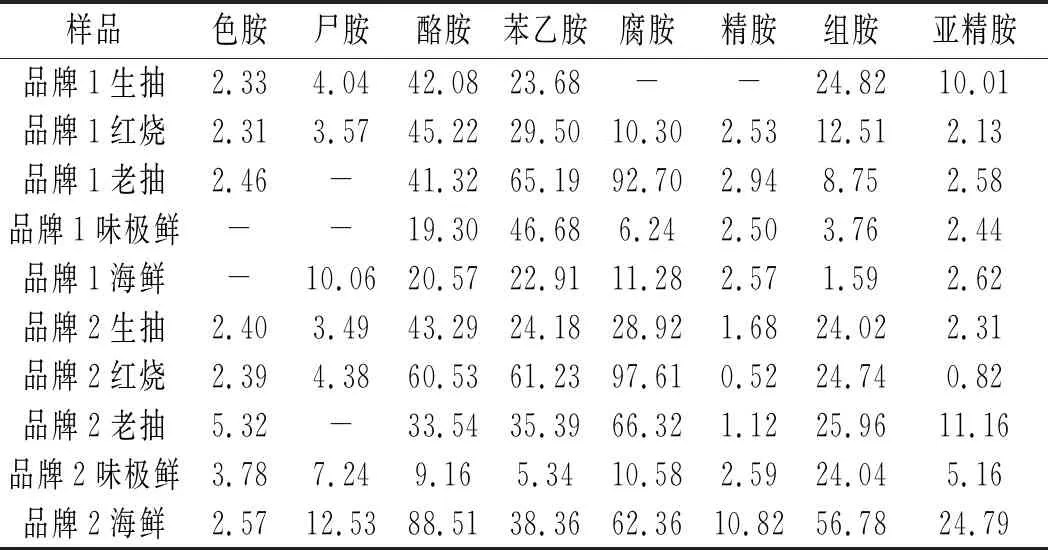
表4 市售10酱油中生物胺的含量(ng/mL)
由表4可知,不同品牌不同品种酱油中生物胺的种类和含量差异均较大,其中苯乙胺、腐胺和酪胺的相对含量较高,色胺和精胺的相对含量较低,但是没有一种品牌的酱油是不含有生物胺的。有研究报道称高含量的酪胺可能与生产酱油过程中卫生条件不好有关,同时与尸胺和腐胺的高含量有关。
2.2 样品前处理条件的优化
2.2.1 有机溶剂的考察
选择合适的有机溶剂是液-液萃取过程的关键因素,在连续三相液相萃取中,萃取溶剂应满足以下条件:分析物在该有机溶剂中有足够大的溶解度;与水不互混溶,尽可量减少在萃取过程中的损失[18];使用正L型萃取池时,有机溶剂的密度要大于水的密度,反之相反;毒性要低,避免对环境的污染及试验操作人员的危害;与微孔滤膜不能发生作用;不与目标物发生化学反应,且稳定性好。故本次试验中考察了二氯甲烷、氯仿和四氯化碳萃取剂对生物胺萃取效率的影响。根据试验结果选择萃取率最高的二氯甲烷作为提取溶剂,具体试验结果见图3。
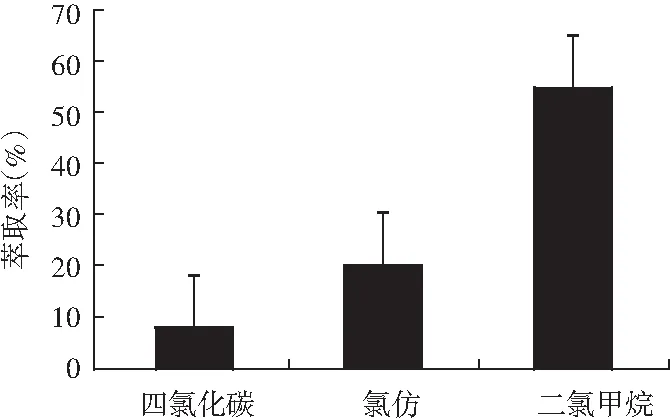
图3 不同萃取溶剂对生物胺萃取率的影响
2.2.2 微孔滤膜的考察
在连续三相液相萃取过程中微孔滤膜的选择非常重要,微孔滤膜应该具有以下特征:微孔滤膜应该是疏水性膜;不能与有机溶剂发生相互作用;微孔滤膜的厚度要适中,微孔滤膜太厚则透过率低,引起萃取效率的下降;如果微孔滤膜太薄,在萃取过程中容易引起误差。微孔滤膜的孔径也要适宜;孔径太大会导致水和其他大分子杂质物直接透过膜;如果孔径太小会引起萃取效率的下降。试验中考察了聚四氟乙烯(其中1号孔径为37 μm,2号孔径为106 μm)、聚丙烯、尼龙、不锈钢网4种不同的膜对生物胺萃取率的影响。根据试验结果选择萃取率最高的聚四氟乙烯(2号孔径为106 μm)作为微孔滤膜,具体试验结果见图4。

图4 不同滤膜材质对生物胺萃取率的影响
2.2.3 给体相pH的考察
给体相与接受相pH在液-液-液三相萃取中起到重要作用。液-液-液三相体系包含给体相、有机相、接受相3个液相,对于碱性分析物通过向给体相中加入碱调节给体相的pH值大于目标物的pKa值,使目标物去离子化以降低其在给体相中的溶解度。通过搅拌使给体相中的目标分析物扩散并依靠疏水作用进入有机相,接受相中加酸是为了提供质子在有机相和接受相界面使目标分析物质子化,则被萃取到接受相[19]。本文考察了给体相10~14范围内的pH值对生物胺萃取效率的影响。根据试验结果选择萃取率最高的13作为给体相的pH值,具体试验结果见图5。

图5 不同给体相的pH对生物胺萃取率的影响
2.2.4 接受相盐酸浓度的考察
鉴于接受相盐酸浓度对生物胺萃取效率的影响,本文考察了接受相在0.1~0.5 mol/L范围内的盐酸浓度对生物胺萃取效率的影响。根据试验结果选择萃取率最高的0.4 mol/L作为接受相的盐酸浓度,具体试验结果见图6。

图6 不同盐酸浓度对生物胺萃取率的影响
2.2.5 搅拌速率的考察
搅拌速率是影响萃取效率的另一重要因素。由于搅拌增加接触面从而可以提高萃取效率,尤其是连续三相液相萃取中,通过搅拌增加待测组分快速透过微孔滤膜并缩短平衡时间。同时,快速搅拌可能造成萃取剂的挥发损失与产生大量气泡从而降低萃取效率。在试验中选择200,300,400,500,600 r/min 5个不同的搅拌速率进行考察。根据试验结果选择萃取率最高的500 r/min作为搅拌速率,具体试验结果见图7。

图7 不同转速对生物胺萃取率的影响
2.2.6 萃取时间的考察
一般随时间的增长萃取效率也增大。但时间过长,有机溶剂挥发,不利于萃取。本试验在5~50 min时间内进行考察。根据试验结果选择萃取率最高的20 min作为萃取时间,具体试验结果见图8。
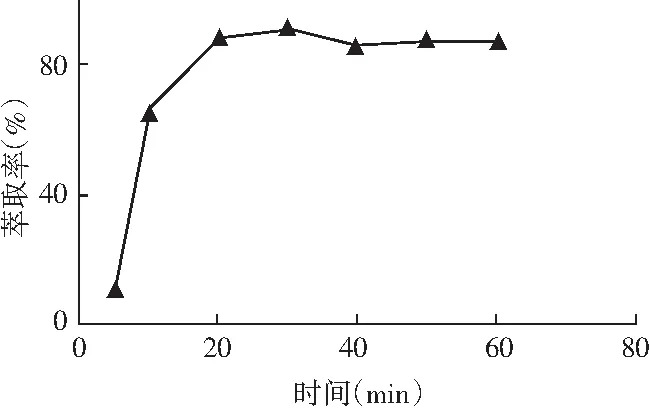
图8 不同萃取时间对生物胺萃取率的影响
2.2.7 混匀方式的考察
一般的混匀方式有磁力搅拌、涡旋混匀及摇床振荡3种方式,本次试验对3种混匀方式对生物胺的萃取率比对进行了考察。根据试验结果选择萃取率最高的涡旋混匀作为混匀方式,具体试验结果见图9。
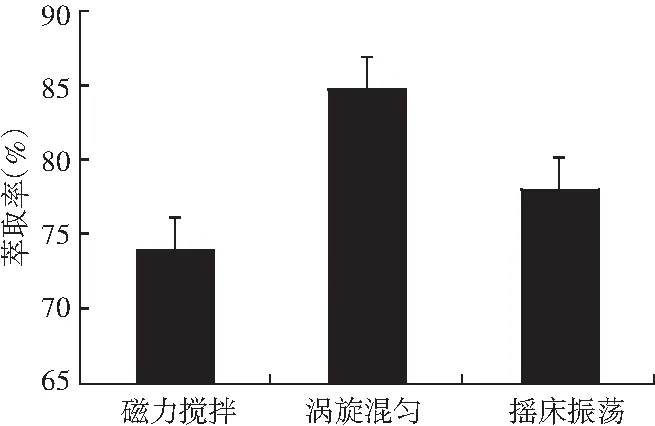
图9 不同混匀方式对生物胺萃取率的影响
2.3 试验条件的优化
2.3.1 色谱柱的优化
选取Waters公司的C18(2.1 mm×100 mm,1.7 μm)、C8(2.1 mm×100 mm,3.5 μm)、HILIC(2.1 mm×100 mm,3.5 μm)3种不同填料的色谱柱对8种生物胺进行检测,结果发现HILIC柱及C8柱无法完全检测出8种生物胺,最终选择8种生物胺均可检出的Waters公司的C18柱。
2.3.2 耐用性的考察
分别选取①C18(50 mm×2.1 mm,内径1.7 μm)、②C18(100 mm×2.1 mm,内径1.7 μm)、③C8(50 mm×2.1 mm,内径3.5 μm)、④C8(100 mm×2.1 mm,内径3.5 μm)4种型号和规格的色谱柱,对生物胺的系统适用性进行考察,包括色谱柱的理论板数(n)、分离度(R)、拖尾因子(T)等。试验结果显示①C18(50 mm×2.1 mm,内径1.7 μm)的色谱柱得到的理论板数、分离度及拖尾因子最好,因此选择该规格色谱柱。
2.3.3 流动相的优化
选取甲醇和乙酸铵水溶液(浓度为5 mmol/L)以及乙腈和甲酸水溶液(浓度为0.1%)两种不同的流动相对8种生物胺进行检测,结果表明,以乙腈和甲酸水溶液(浓度为0.1%)为流动相时,8种生物胺能获得较好的峰形、分离效果和检测灵敏度。因此,选择乙腈和甲酸水溶液(浓度为0.1%)作为流动相。
2.3.4 质谱条件的优化
根据仪器自动调谐的结果进样检测,结果发现还是有部分生物胺无法检测出来,故需对自动调谐的结果进行微量的手动调谐,优化质谱调谐中的毛细管电压、脱溶剂气温度、脱溶剂气流量等参数,根据响应值的大小,确定最终的生物胺的质谱检测条件。按照试验确定的质谱方法中质谱检测条件(8种生物胺的母离子、碎片离子、锥孔电压以及碰撞能等条件),对毛细管电压、离子源温度、脱溶剂气流量和脱溶剂气温度进行4种数据的测试,并对生物胺的响应值进行检测,最终选择1.2.3中的质谱条件。
3 结论
采用的连续三相液液萃取法互补了膜分离和三相液液萃取技术的缺点,提高了方法的准确性、灵敏度、选择性,并且缩短了萃取时间,装置简单,成本低,膜过滤和两次萃取同时完成,且重现性好。采用的液相色谱-串联质谱法作为生物胺的检测方法分析时间更短(10.0 min),检出浓度更低(苯乙胺为1.0 ng/mL,其余7种为0.3 ng/mL),更适用于微量生物胺的检测。本次方法学试验检测结果显示8种生物胺的线性关系良好,相关系数均大于0.99;精密度RSD范围为0.30%~0.86%;稳定性RSD范围为2.19%~6.44%;回收率范围为87.02%~90.20%,说明采用此质谱方法进行检测结果良好,对8种生物胺具有普遍适用性。通过对上述市售的10批次酱油的检测,证实本试验的样品提取方法简单、快速,可用于酱油中8种生物胺的检测,同时可以继续推广作为红酒、牛奶、饮料及果汁等其他液态食品中8种生物胺的检测方法。

