鸡新城疫、传染性法氏囊和传染性支气管炎病毒三重RT-PCR检测方法建立
王通辉 杨伟 姜玲玲 吴松成 张亚楠 杨先富 吴政明 余波*
(1,贵州省剑河县岑松镇农业服务中心 556400;2,贵州省农科院畜牧兽医研究所 550000;3,贵州省黔东南州动物疫病预防控制中心 556000;4,贵州省黔东南州畜牧技术推广站 556000)
新城疫(ND)、传染性法氏囊(IBD)和传染性支气管炎(IB) 是严重危害禽类的病毒性疾病,常以单独或混合感染的方式感染家禽,发病率和死亡率都很高,给家禽养殖业造成巨大的经济损失[1]。新城疫(Newcastle Disease,ND)是一种由属副黏病毒科腮腺炎病毒属新城疫病毒(Newcastle Disease Virus,NDV)感染引起的急性、高度传染性、病毒性禽类疾病[2-4]。传染性法氏囊(Infectious Bursal Disease,IBD)是一种由双RNA病毒科、禽双RNA 病毒属的传染性法氏囊病毒 (Infectious Bursal Disease Virus,IBDV)感染引起的一种急性、高度接触性、病毒性禽类传染病,以法氏囊发炎、坏死、萎缩等为主要特征[5-8]。传染性支气管炎(Infectious Bronchitis,IB)是一种由冠状病毒科冠状病毒属的传染性支气管炎病毒(Infectious Bronchitis Virus,IBV)感染引起的高度接触性禽类呼吸道急性传染病[9-11]。由于这些疫病均能导致严重的禽类呼吸道疾病[12],且流行病学、发病特征、临床症状和剖检变化极为相似,且不易区分[13-15]。传统的病原分离鉴定和血清学方法无法进行快速检测和鉴别诊断,严重影响对这些疫病的有效防制。因此,建立一种可同时检测NDV、IBDV 和IBV3 种病毒的特异、敏感、快速的检测方法,对于上述3 种病毒性传染病的诊断和防控十分必要。
随着聚合酶链式反应技术 (Polymerase Chain Reaction,PCR)的出现及其技术不断改进,这种针对病原核酸的诊断方法具有更准确、灵敏、特异的特点,完全可用于早期快速诊断目的,并具有其自身独特的优势和广阔的应用前景。利用普通PCR、实时荧光定量PCR、核酸探针、环介导等温扩增、固相基因芯片、液相芯片等技术检测病毒已有很多报道,其中PCR技术已被广泛应用于多种疫病检测诊断中。多重PCR (Multiplex Polymerase Chain Reaction,mPCR)技术不仅具有普通PCR特异性强、敏感性高、快捷简便等优点,而且可在一个反应体系中同时扩增多份DNA 或RNA 样本的不同目的基因片段,由此可以检测鉴别多种不同的病原体,特别适用快速诊断多种混合感染的临床样本。本研究建立针对上述3 种RNA 病毒的多重PCR 检测方法,以达到在同一反应体系中同时扩增出对应病原体特异核酸片段的目的,为早期、快速、特异、敏感地实现对鸡新城疫、传染性法氏囊和传染性支气管炎病原的单一或混合感染的快速准确检测奠定基础,为鸡新城疫、传染性法氏囊和传染性支气管炎的流行病学调查和诊断防控提供了有效的理论和技术支撑。
1 材料和方法
1.1 参考菌株
鸡新城疫病毒、传染性法氏囊病毒与传染性支气管炎病毒毒株均由贵州省畜牧兽医研究所畜禽疫病研究室提供。
1.2 引物设计
参照NCBI 中NDV-NP (KT445901.1)、IBDV(LM651365.1)和IBV-N (FJ548847.1)的基因序列,应用SnapGene、DNAStar、Primer5.0、Oligo 等软件,分别设计3 对特异性引物,并通过http://www.ncbi.nlm.nih.gov/BLAST/对这3 对引物特异性进行鉴定,均具有良好的特异性。PAGE 级,OD 值为2.0,引物由上海英骏生物技术有限公司合成。详细引物序列,见表1。
1.3 主要试剂
Mini BEST Universal Genomic DNA&RNA Extraction Kit Ver.4.0 核酸提取试剂盒、PrimeScriptTM One Step RT-PCR Kit Ver.2均购自宝生物工程 (大连)有限公司;氨苄西林、RNA Inhibitor、pMD18-T Vector、DH-5α 感受态细胞、E.Z.N.A.TM Gel Extraction Kit (50) 胶回收试剂盒、普通质粒小提试剂盒、去离子水均购自天根生化科技(北京)有限公司;琼脂粉、异丙醇、醋酸、无水乙醇等国产分析纯购自索来宝科技(北京)有限公司。
1.4 主要仪器
核酸提取仪(Lab-Aid820)购自厦门百维信生物科技有限公司,电子天平(AR2140)购自美国奥豪斯,紫外分光光度计(NanoDrop 2000/2000c)、高速冷冻离心机(艾本德5810R)购自美国赛默飞,pH 测量仪(Delta 320A/C)购自梅特勒-托利多,梯度PCR 扩增仪、电泳仪、紫外透射仪、Gel DOC XR 凝胶成像系统(University Hood Ⅱ) 均购自美国BIO-RAD;超纯水器(ATZ-10-T)购自台湾艾科蒲,枪头、PCR 管与离心管等耗材购自美国AXYGEN。
1.5 DNA 的提取
病毒RNA 的提取参照MiniBEST Viral RNA/DNA Extraction Kit Ver.4.0 核酸提取试剂盒说明书进行。将提取的RNA 于-20 ℃保存。
1.6 单一RT-PCR 方法的建立
1.6.1 pMD-18T-NP、VP、N 阳性标准质粒的构建
以鸡新城疫病毒、传染性法氏囊病毒与传染性支气管炎病毒毒株各自RNA 为模板进行RT-PCR 扩增,反应条件为:50℃40min;95℃5min;94℃30s,54℃30s,72℃45s,35 个循环;最后72℃10min;12℃,∞。
将扩增的PCR 产物与pMD-18T 克隆载体连接,转化感受态细胞DH-5α,重组质粒命名为pMD-18T-NP、VP、N,将建构的阳性标准重组质粒送上海英骏生物技术有限公司测序。
1.6.2 单一RT-PCR 扩增体系的优化
单一病毒的RT-PCR 反应体系为25μl,其中NDV、IBDV和IBV 的反应体系分别为2×1 Step Buffer 12.5μl,上下游引物分别各为1.0μl,RNA 模板为1.0μl,PrimeScript One Step Enzyme Mix 为1.0μl,RNase Free H2O 各为8.5μl、RT-PCR 反应条件为50℃40min;95℃5min;94℃30s,预设8 个退火温度54~59.5.0℃ (54.0、54.4、55.2、56.3、57.7、58.8 和59.5℃)30s,72℃45s,共进行35 个循环;72℃10min;以确定最佳的退火温度。
1.7 多重RT-PCR 的建立
1.7.1 三重RT-PCR 反应条件的优化
将方法1.3.2 获得的NDV、IBDV 和IBV 这3 种病毒基因重组质粒进行相应稀释,并等比例混合作为多重PCR 反应模板。对三重PCR 反应预设置8 个梯度的退火温度54~60.0℃(54.0、54.4、55.2、56.3、57.7、58.8、59.5 和60.0℃)进行优化,以确定最佳退火温度。扩增产物经1.5%的琼脂糖凝胶电泳检测。
1.7.2 三重RT-PCR 特异性、敏感性及重复性试验
通过建立的三重RT-PCR 方法分别以NDV、IBDV 和IBV的病毒基因重组质粒核酸与多杀性巴氏杆菌、沙门氏菌、E.coli及正常组织的DNA/cDNA 模板进行RT-PCR 扩增,检测该三重RT-PCR 方法是否具有特异性;用灭菌三蒸水对3 个病毒的核酸进行10 倍系列稀释,然后取每个稀释度的核酸为模板分别运用三重PCR 方法检测其敏感性;选取3 种病毒最佳浓度的病毒基因重组质粒核酸混合核酸作为模板及最佳的反应体系及条件,进行3 次三重RT-PCR 重复性试验。扩增产物经1.5%的琼脂糖凝胶电泳检测。
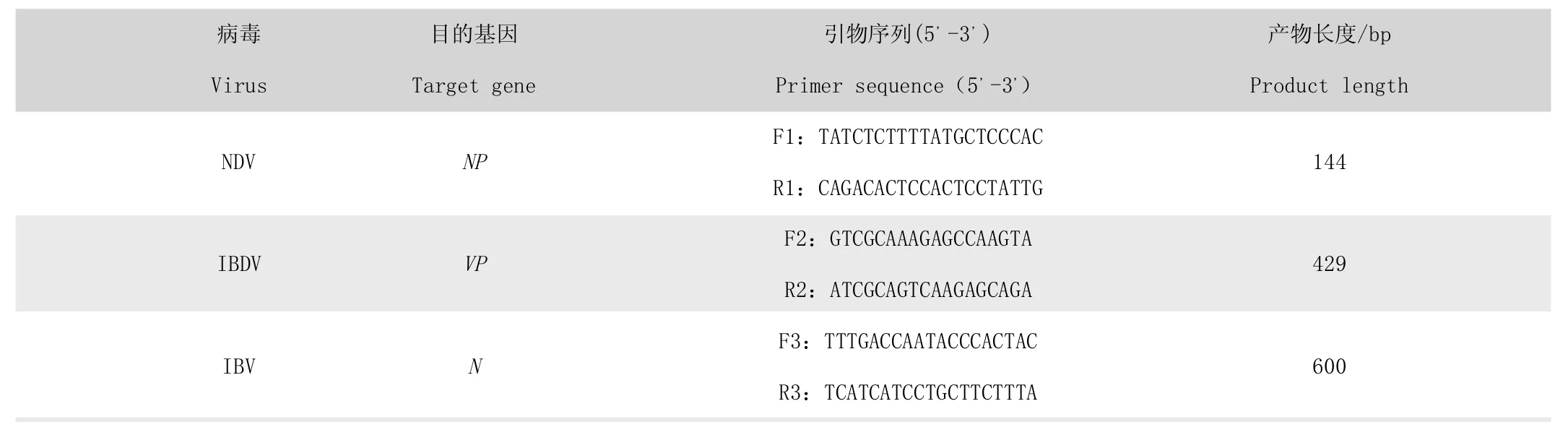
表1 引物序列及片段大小
1.7.3 三重RT-PCR 对临床病料的检测
利用已建立的三重RT-PCR 方法对2018~2019 年收集于贵州省内的共xx 份疑似新城疫、传染性法氏囊与鸡传染性支气管炎临床样品进行检测。取采集到的拭子、组织和血液与PBS 溶液(0.01 mol/L) 按1:1 体积比混合。4℃条件下,12000×g 离心10min,取上清分装于灭菌处理后的EP 管中并做好标记,置于-20℃冰箱中保存备用。各取200μl 上清,参照DNA&RNA的提取参照核酸提取试剂盒说明书进行,对提取到的核酸进行三重RT-PCR 扩增。扩增产物经1.5%的琼脂糖凝胶电泳检测。
2 结果
2.1 单一RT-PCR 方法的建立
2.1.1 阳性标准质粒的构建
测序结果表明,构建阳性标准质粒与鸡新城疫病毒NP 基因、传染性法氏囊病毒VP 基因及传染性支气管炎病毒N 基因相似性为100%。
2.1.2 单一RT-PCR 扩增体系的优化
在25μl 体系中,通过固定阳性质粒模板量,改变引物浓度的系列试验,确定反应体系的最佳引物量。结果表明在3 对引物中,NDV、IBDV 和IBV 上下游引物各1.0μl 时RT-PCR检测效果最明显。NDV、IBDV 和IBV 最佳反应体系(25μl),见表2。

表2
对单一RT-PCR 反应的退火温度54.0~59.5℃(54.0、54.4、55.2、56.3、57.7、58.8 和59.5℃)进行优化,以确定最佳反应条件。试验结果表明,火温度在54.0~60.0℃之间均可扩增出目的条带,其中NDV 和IBDV 最佳反应程序为50℃40min;95℃5min;94℃30s,56.5℃30s,72℃30s,35 cycles;72℃10min;12℃,∞。IBV 最佳反应程序为50℃40min;95℃5 min;94℃30s,56.5℃30s,72℃45s,35 cycles;72℃10min;12℃,∞。各退火温度优化扩增结果见图1、图2 与图3。
2.2 三重RT-PCR 的构建
2.2.1 三重RT-PCR 反应条件的优化

图1 NDV 退火温度优化
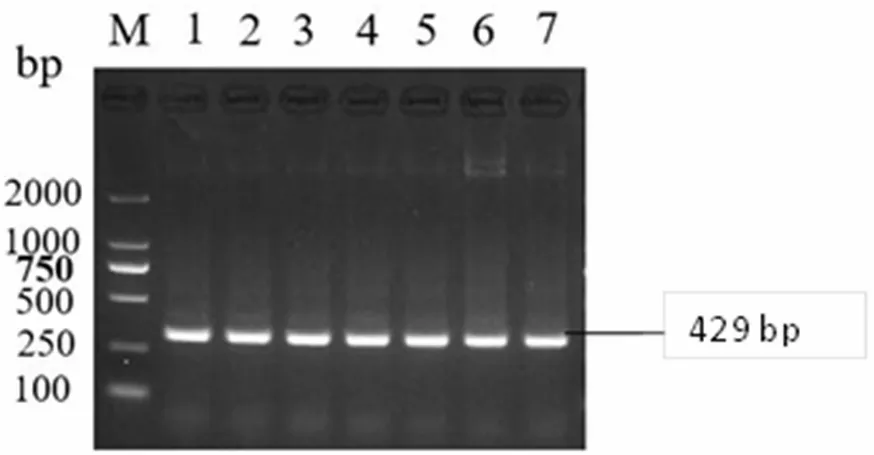
图2 IBDV 退火温度优化
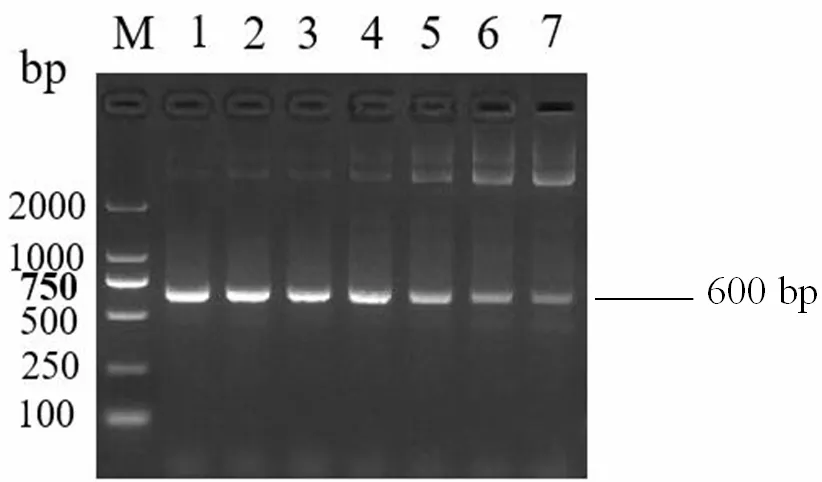
图3 IBV 退火温度优化
通过固定阳性质粒模板量,改变引物浓度的系列试验,确定反应体系的最佳引物量。结果表明,三重PCR 反应在50μl反应体系条件下最佳,其中2×1 Step Buffer 25.0μl,3 对引物上下游引物浓度各1.75μl,NDV、IBDV 和IBV 模板各1.0μl,PrimeScript One Step Enzyme Mix 2.0μl,RNase Free H2O 9.5μl;当反应循环数为30 个循环,退火温度为54.5℃时三重RT-PCR扩增效果最佳,三重RT-PCR 最佳反应条件:50℃40min;95℃5min;94℃30s,57.7℃30s,72℃45s,30cycles;72℃10min。每个基因均能出现特异性条带,且无非特异性扩增,见图4。
2.2.2 三重PCR 特异性、敏感性及重复性试验
三重RT-PCR 特异性试验结果表明,禽白血病毒、马立克氏病病毒、多杀性巴氏杆菌、沙门氏菌、E.coli 及正常组织的模板均未扩增出条带,而NDV、IBDV 和IBV 模板均扩增出与目的片段大小相符的特异性条带,见图5;对NDV、IBDV 和IBV3 个病毒的核酸进行10 倍梯度稀释,在建立的三重RTPCR 检测方法反应条件下进行扩增,敏感性结果显示,各种病毒的最低检测量分别为NDV6.18×101copies/μl、IBDV 8.64×106copies/μl 和IBV2.57×102copies/μl,见图6;重复性试验结果表明,3 次重复试验均能扩增出均匀一致的目的条带,具有良好的重复性,表明建立的三重RT-PCR 方法具有较好的重复性。
2.2.3 三重RT-PCR 对临床样品的检测
不同来源的75 份临床病料检测结果表明:鸡场存在不同程度的NDV、IBDV 和IBV 混合感染现象。在75 份样品中,其中病毒单一感染率为46.6% (35/75),NDV 与IBDV 的二重感染阳性率为16.0% (12/75),NDV 与IBV 的二重感染率为14.6% (11/75),IBDV 和IBV 的二重感染率为10.6% (8/75),NDV、IBDV 和IBV 的三重感染率为5.3% (4/75)。
3 讨论
随着规模化养殖业的快速发展,病毒感染在养鸡业较为常见,尤其是NDV、IBDV 及IBV 感染,一直对养鸡业的发展造成严重危害,禽类病毒病的流行特别是多种病毒病的混合感染,而其病理变化和临床特征均十分相似,实际工作中难以区分给养禽业带来巨大的经济损失[16-18]。临床上这3 种病原混合感染的情况日益增多,常规诊断诊断方法难以满足临床诊断的需要。mPCR 是在普通PCR 的基础上,在同一个反应体系中加入不同的引物对,针对不同的模板或同一模板的不同区域进行特异性的扩增,从而得到多个目的片段,结合一定的检测手段进而实现同时对多个靶标进行诊断的技术[19]。和普通PCR 相比,mPCR 不但保留了高特异性、高敏感性的优点,且操作更加简洁快速,省时省力,已成功应用于基因检测的多个领域,包括转基因鉴定、食品检测、病原体检测、肿瘤诊断等[20]。
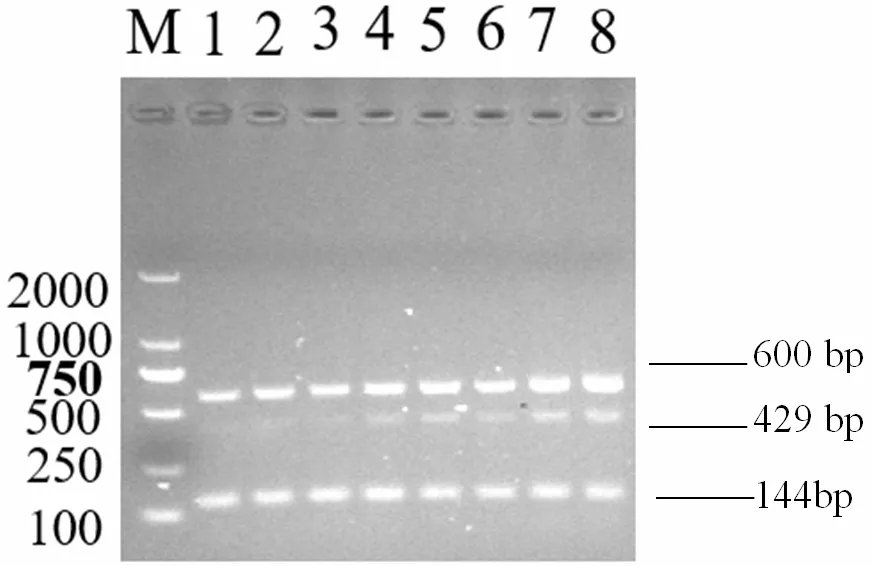
图4 NDV、IBV 和IBDV 三重退火温度优化
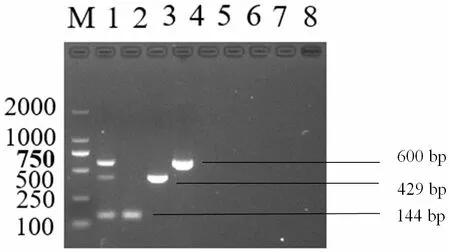
图5 NDV、IBDV 和IBV 三重RT-PCR 特异性优化

图6 NDV、IBDV 和IBV 三重RT-PCR 敏感性
本研究参考Gen Bank 中鸡新城疫、传染性法氏囊和传染性支气管炎相应靶基因的保守序列设计特异性引物。选择新城疫NP 基因,传染性法氏囊VP 基因,传染性支气管炎N 基因作为靶序列,应用Primer Premier5.0 分别设计3 对特异性引物,通过NCBI BLAST 比对和DNAStar 软件分析确保不同引物对之间没有同源关系,不会形成稳定的引物二聚体。分别设计3 个目的片段为144bp、429bp、600bp,PCR 产物经琼脂糖凝胶电泳后大小之差约在200bp 左右,使目的片段分布在Marker 不同标尺大小的区域,具有辨识度,不易造成误判[21]。多重PCR技术的反应体系较常规PCR 有较高的要求,们在对本研究中的每种待检病毒进行普通PCR 检测成功的基础上,通过不断优化反应体系及反应程序中的退火温度,确保每一重的扩增效率保持一致,以降低引物二聚体甚至多聚体的形成。且在试验过程中选取了沙门氏菌核酸、大肠杆菌核酸、禽白血病病毒核酸以及禽支原体核酸进行特异性检测,结果均未检出这几类常见禽类病原核酸,证实了本试验建立的mPCR 具有较好的特异性。同时本研究在单一RT-PCR 检测方法的基础上,建立了一步法多重RT-PCR,在一个反应体系中进行反转录(RT)与聚合酶链式反应(PCR),节省了时间和操作步骤,大大提高了病原检测的效率。在本研究中,不仅可以从组织器官、排泄物、鼻腔拭子以及细胞培养物等临床样本中提取到病毒总RNA,还可以直接从血清、全血等血液样本中提取出病毒总RNA。本研究建立的一步法多重RT-PCR 方法特异性强,敏感性比较高,其最低RNA 检测下限达到了NDV6.18×101copies/μl、IBDV8.64×106copies/μl 和IBV2.57×102copies/μl,可以用来检测血清中含量较低的NDV、IBDV 和IBV,因此,本方法可以用于血清病原筛查,可应用于临床大样本量的快速检测。
利用本研究中建立的多重RT-PCR 方法,对采集自贵州省不同时间和地点的疑似鸡呼吸道症状的鸡场的胚胎、内脏、血液、血清和泄殖腔拭子,在75 份样品中,其中病毒单一感染率为46.6% (35/75),NDV 与IBDV 的二重感染阳性率为16.0% (12/75),NDV 与IBV 的二重感染率为14.6% (11/75),IBDV 和IBV 的二重感染率为10.6% (8/75),NDV、IBDV 和IBV 的三重感染率为5.3% (4/75)。经RT-PCR 检测为阳性的样本PCR 产物,进一步进行克隆回收纯化,进一步进行DNA序列验证,结果均与NDV、IBDV 和IBV 目的片段一致。上述研究表明,本研究建立的多重RT-PCR 检测方法敏感性高、特异强,可应用于临床NDV、IBDV 和IBV 的大样本检测,为基层兽医工作者开展NDV、IBDV 和IBV 的诊断和流行病学调查提供了有效的诊断方法。同时,建立的方法可以用于引种检疫。
需要注意的是,鸡场在防控常见病毒性疫病时免疫接种弱毒疫苗,如新城疫、传染性法氏囊都有弱毒疫苗,疫苗免疫可能会影响对检测结果的准确判定。弱毒疫苗株可能会造成多重RT-PCR 检测出现假阳性结果,这也是流行病学调查许多禽畜传染病时的一个难题[22]。所以在使用该技术时,应考虑疫苗接种史,紧密结合临床症状、解剖病变及流行病学进行综合诊断,必要时对扩增产物进行基因测序,以帮助正确判断疫情。

