桦木酸对环磷酰胺致小鼠肝脏损伤的保护作用
马朝阳,朱利娟,罗晨曦,朱子寒,孔 丽,林 星,高鑫禹,马玉容,欧朝萍,易金娥,2,3,*
(1.湖南农业大学动物医学院,湖南 长沙 410128;2.畜禽保健湖南省工程研究中心,湖南 长沙 410128;3.湖南畜禽安全生产协同创新中心,湖南 长沙 410128)
环磷酰胺(cyclophosphamide,CYP)属于氮芥类烷化剂抗肿瘤药,在临床上使用超过40 年,主要用于癌症、免疫缺陷类疾病的治疗[1-2],因其对组织缺乏特异选择性,过量使用会导致免疫系统受损,出现免疫缺陷[3],并且还可能导致骨髓抑制、氧化应激和其他副作用,甚至威胁生命[4]。CYP通过促进干扰素-γ(interferon-γ,IFN-γ)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的分泌,降低白细胞介素-10(interleukin-10,IL-10)的分泌,破坏细胞免疫,抑制自然杀伤细胞和巨噬细胞,最终抑制机体的免疫功能[5]。潘航等[6]研究发现,腹腔注射CYP能够降低胸腺、脾脏和血清中超氧化物歧化酶(superoxide dismutase,SOD)活力,提高胸腺和脾脏中丙二醛(malondialdehyde,MDA)的含量,从而导致氧化应激。在临床研究中,CYP常被用于免疫抑制模型和氧化应激模型的建立。
桦木酸(betulinic acid,BA)属于羽扇豆烷型五环三萜类物质[7],具有多种药理作用,如抗肿瘤、抗氧化应激、抗炎和抗菌[8]。BA广泛分布于桦木属植物和其他多种植物中,如酸枣仁、槐花、天门冬、睡菜叶等[9]。前期研究发现,BA具有免疫调节的作用,能够增强小鼠的细胞免疫、体液免疫和非特异性免疫[10-12]。BA对地塞米松致小鼠氧化应激或对酒精性肝损伤具有保护作用[13-16],并且,BA对CYP引起的小鼠免疫器官氧化应激有预防性保护作用[17]。然而BA是否对CYP引起的肝脏损伤具有改善和预防性保护作用还鲜见报道。因此,本实验采用腹腔注射CYP诱导小鼠肝脏损伤模型,从肝功能相关指标、抗氧化能力以及抗炎作用来研究BA对其预防性保护作用,旨在为BA的临床应用及作为药食同源物的应用提供理论参考。
1 材料与方法
1.1 动物、材料与试剂
50 只健康雄性昆明小鼠,4~5 周龄,无特定病原体(SPF)级,体质量为(15±2)g,生产许可证号:SCXK(湘)2009-0004。饲料为大小鼠维持饲料,由湖南斯莱克景达实验动物有限公司提供,其主要原料为玉米、小麦、豆粕、鱼粉、啤酒酵母粉、苜蓿草粉、麦麸等;主要营养成分(以干质量计):粗蛋白(≥18%,质量分数,下同)、粗脂肪(≥4%)、粗纤维(≤5%)、钙(1.0%~1.8%)、磷(0.6%~1.2%)、赖氨酸(≥0.82%)、蛋氨酸+胱氨酸(≥0.53%)。
BA、CYP 美国Sigma公司;TRIzol提取试剂盒美国L i f e 公司;反转录聚合酶链式反应(r e v e r s e transcription polymerase chain reaction,RT-PCR)试剂盒、SYBR Green荧光染料 日本Takara公司;实时荧光定量PCR(quantitative real-time PCR,qPCR)引物上海生工生物工程股份有限公司;SOD、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)、还原型谷胱甘肽(glutathione,GSH)和MDA试剂盒 南京建成生物工程研究所;谷丙转氨酶(alanine aminotransferase,ALT)和谷草转氨酶(aspartate aminotransferase,AST)试剂盒 深圳迈瑞生物医疗电子股份有限公司。
1.2 仪器与设备
JXFSTPRP-24组织匀浆机 上海净信实业发展有限公司;5404EQ220531高速冷冻离心机 德国Eppendorf公司;AY220电子分析天平 日本岛津有限公司;BS-200自动生化分析仪 深圳迈瑞公司;Infinite 200 PRO酶标仪 美国Bio Tek公司;788BR03720 qPCR仪美国Bio-Rad公司;EM UC7超薄切片机 德国Leica公司;ECLIPSE C1正置显微镜 日本尼康公司。
1.3 方法
1.3.1 小鼠分组及喂养
根据前期研究,确定了BA和CYP的给药时间和剂量[16,18]。将小鼠放置在环境温度为22~25 ℃,相对湿度为40%~70%,氨浓度不超过14 mg/m3的饲养房中饲养1 周后,随机分为5 组,即空白组、CYP组以及BA低、中、高剂量(0.25、0.50、1.00 mg/kgmbBA+CYP)组,每组10 只。将不同剂量的BA混悬于质量分数1%的可溶性淀粉糊,按0.01 mL/gmb灌胃,空白组和CYP组给予1%可溶性淀粉糊,每天9∶00给药一次,连续给药14 d。第15和第16天,CYP组,BA低、中、高剂量组腹腔注射50 mg/kgmbCYP诱导氧化应激模型,空白组注射等量的生理盐水。禁食16 h(自由饮水)后,眼眶采血,颈椎脱臼处死。血液在室温静置2 h,3 000 r/min离心10 min,收集血清用于检测生化指标。无菌条件下摘取肝脏(称质量),按下式计算肝脏指数。
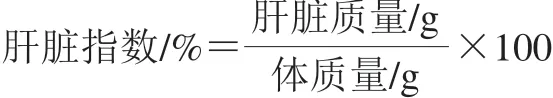
一部分肝脏用预冷生理盐水按1∶9(m/V)配制成10%组织匀浆液,3 000 r/min离心15 min,收集上清液于用于检测SOD、CAT、GSH-Px活力以及GSH和MDA含量。另一部分肝脏储存于-80 ℃用于细胞因子mRNA的相对表达量检测。
1.3.2 血清指标检测
用BS-200全自动生化分析仪检测血清中ALT、AST的活力。
1.3.3 肝脏抗氧化能力指标检测
SOD活力采用羟胺法测定;GSH-Px活力和GSH含量均采用二硫代二硝基苯甲酸法测定;MDA含量采用硫代巴比妥酸显色法测定;CAT活力采用钼酸铵比色法测定。SOD、CAT、GSH-Px、MDA和GSH水平的检测均按试剂盒说明书严格操作。
1.3.4 qPCR检测肝脏炎性因子相关基因的表达量
1.3.4.1 引物的设计
按照qPCR引物设计要求来设计引物,引物见表1。引物由生工生物工程(上海)股份有限公司合成。

表1 引物序列Table 1 Primer sequences used for qPCR
1.3.4.2 表达量的测定
取0.06 g肝组织进行匀浆,使用TRIzol法提取总RNA,用逆转录试剂盒和PCR仪反转录成cDNA,使用SYBR Green I试剂盒和qPCR仪对目的基因相对表达量进行测定。目的基因的表达以β-actin作为内参进行矫正,保存数据采用2-ΔΔCt法计算mRNA的相对表达量。
1.4 数据统计分析
采用SPSS 17.0软件对数据进行统计分析,采用单因素方差分析进行差异显著性比较,两两比较采用q检验,结果以平均值±标准差表示,P<0.05为差异显著具有统计学意义。
2 结果与分析
2.1 BA对小鼠体质量和肝脏指数的影响
由图1 可见,各组小鼠初始体质量无显著差异(P>0.05);实验结束后,与空白组相比,CYP组小鼠体质量差异不显著(P>0.05),肝脏指数增加,但差异不显著(P>0.05);与CYP组相比,BA预处理使小鼠体质量增加,以0.50 mg/kgmbBA差异显著(P<0.05),同时使肝脏指数降低,以0.50 mg/kgmb和1.00 mg/kgmbBA差异显著(P<0.05)。
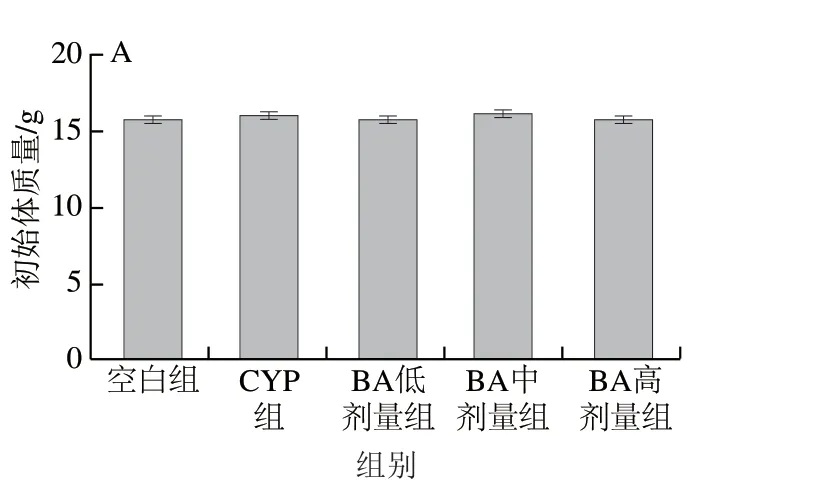

图1 BA对CYP致小鼠初始(A)、终末(B)体质量和肝脏指数(C)的影响Fig. 1 Effect of BA on initial body mass (A), final body mass (B) and liver index (C) of mice with CYP-induced liver injury
2.2 BA对CYP致小鼠血清酶活力的影响
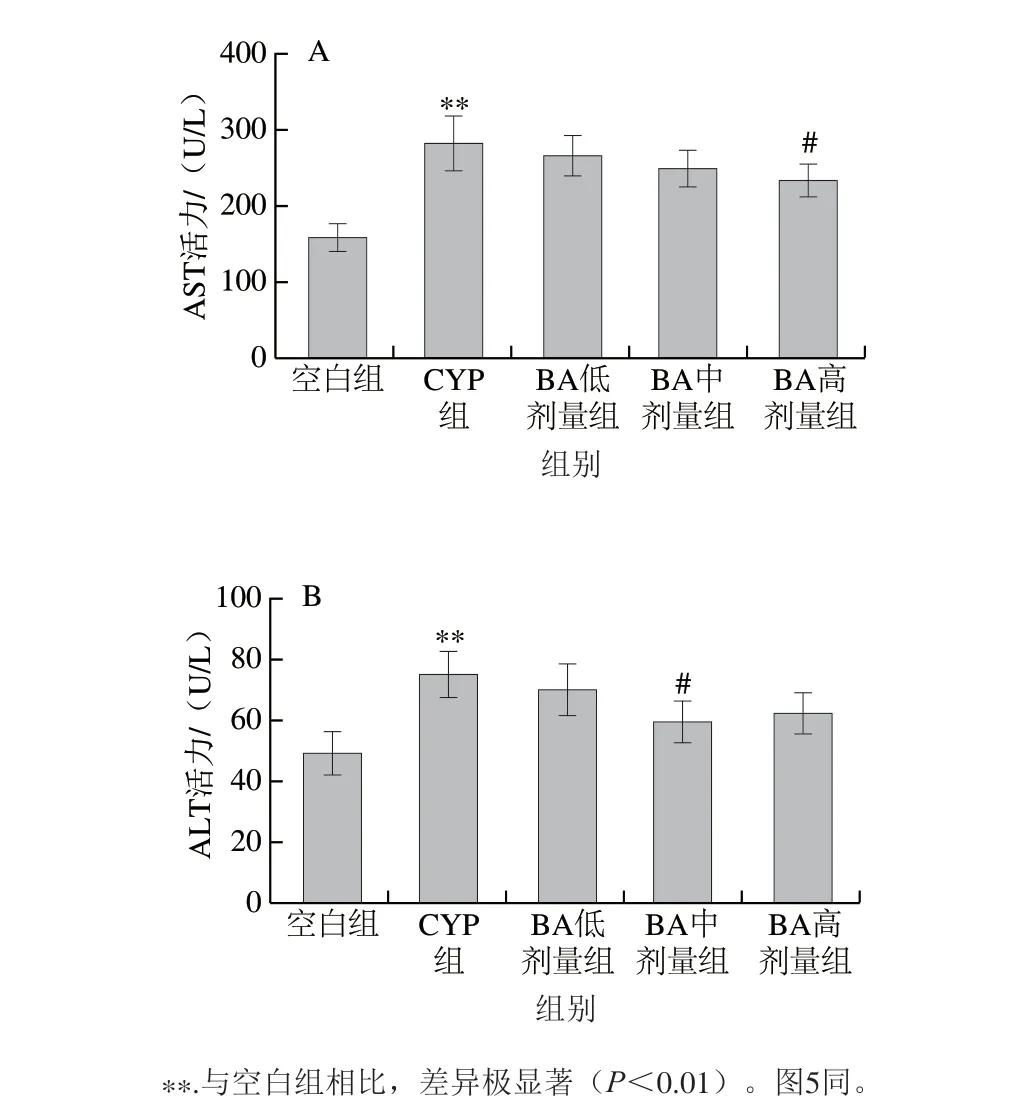
图2 BA对CYP致小鼠血清AST(A)和ALT(B)活力的影响Fig. 2 Effect of BA on the activities of AST (A) and ALT (B) in serum of mice with CYP-induced liver injury
由图2可见,与空白组相比,CYP组小鼠血清中AST和ALT的活力极显著升高(P<0.01);与CYP组相比,BA呈剂量依赖性降低AST的活力,其中以1.00 mg/kg mbBA组差异显著(P<0.05);同时,BA降低血清中ALT活力,以0.50 mg/kg mbBA组差异显著(P<0.05)。
2.3 BA对CYP致小鼠肝组织病理变化的影响
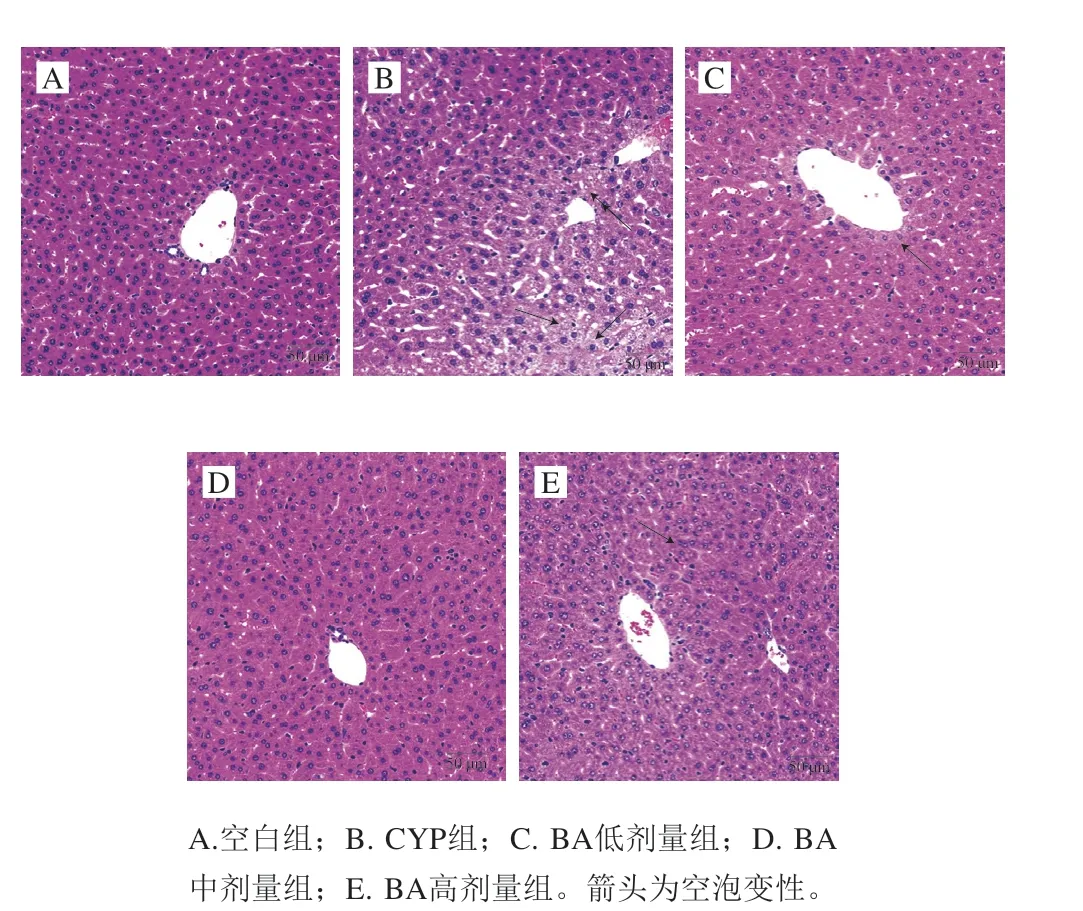
图3 苏木精-伊红染色观察BA对CYP致小鼠肝组织病理变化的影响(20×)Fig. 3 Effect of BA on pathological changes of liver tissues from CYP-induced mice (20 ×)
由图3可见,空白组肝细胞索以中央静脉为中心呈放射状排列,肝窦结构整齐;CYP组肝小叶界限模糊,细胞核周围出现大量空泡;BA预处理后,由CYP引起的肝细胞空泡样变性缓解,以0.50 mg/kg mbBA组改善作用最为明显。
2.4 BA对CYP致小鼠肝脏氧化指标的影响
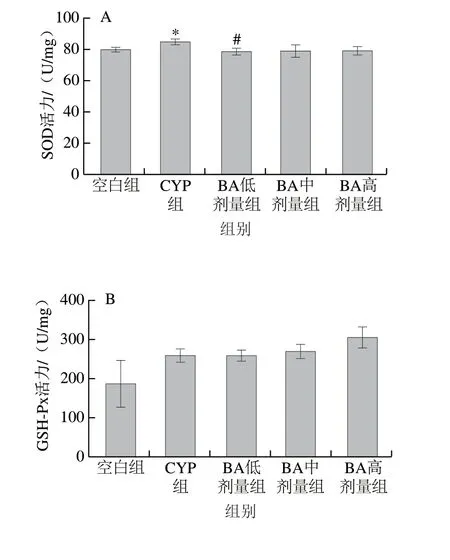
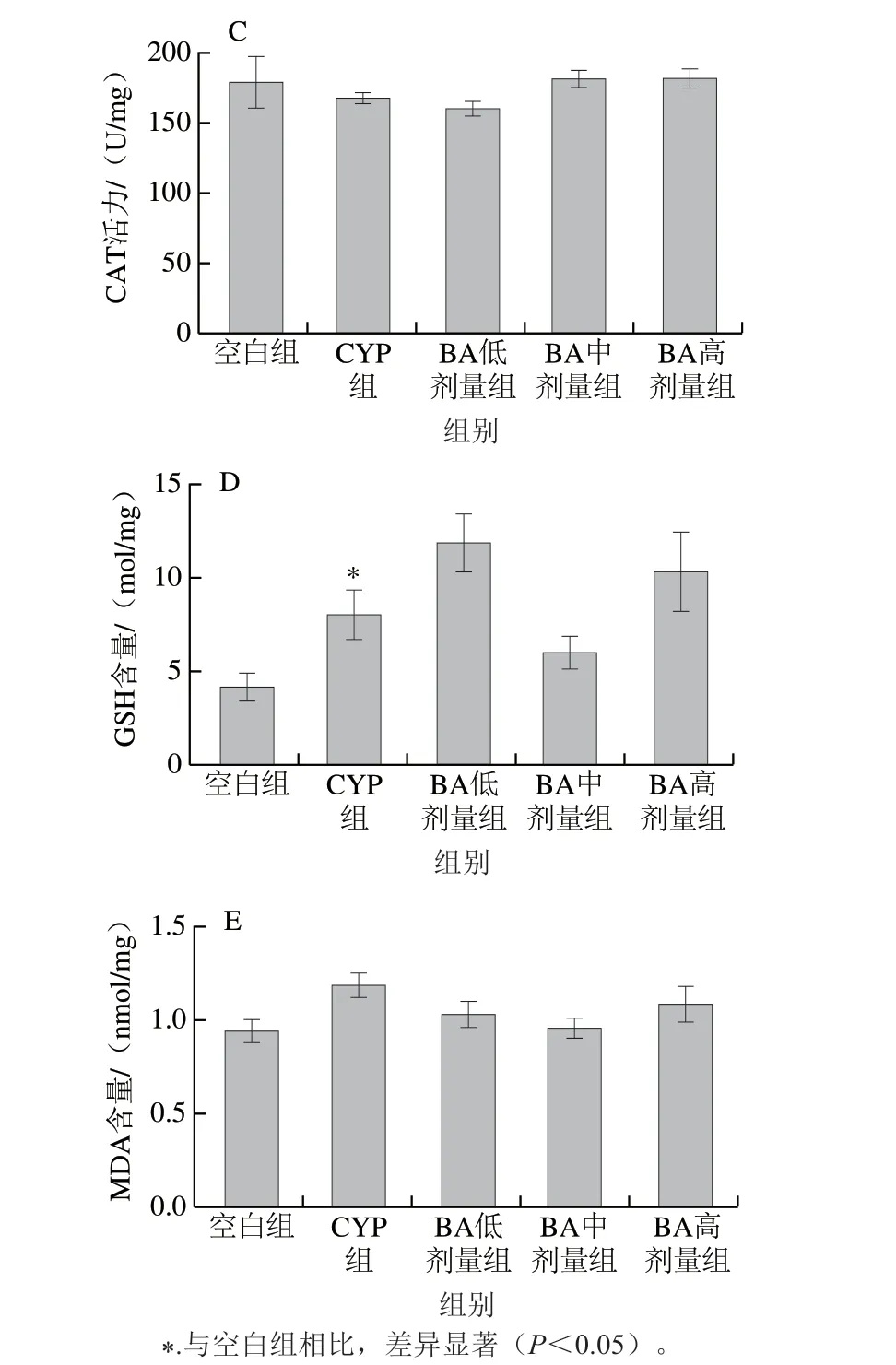
图4 BA对CYP致小鼠肝脏SOD(A)、GSH-Px(B)、CAT(C)活力和GSH(D)、MDA(E)含量的影响Fig. 4 Effect of BA on the levels of SOD (A), GSH-Px (B), CAT (C) and GSH (D), and MDA (E) in liver tissues of CYP-treated mice
由图4可见,与空白组对比,CYP组的SOD活力和GSH含量显著上升(P<0.05),GSH-Px活力和MDA含量升高,CAT活力下降,但差异不显著(P>0.05);与CYP组对比,BA预处理导致SOD的活力下降,以0.25 mg/kg mbBA组差异显著(P<0.05);GSH含量变化无显著性差异(P>0.05);BA预处理对肝脏GSH-Px和CAT活力无显著差异(P>0.05);各BA组的MDA含量均呈下降趋势,差异不显著(P>0.05)。
2.5 BA对CYP致小鼠肝脏细胞因子的影响
由图5 可见,与空白组相比,C Y P 组的I L-1 β和TNF-α mRNA表达量极显著升高(P<0.01),IL-6 mRNA表达量极显著降低(P<0.01),IL-10 mRNA表达量略微降低(P>0.05)。与CYP组相比0.25 mg/kg mb和1.00 mg/kg mbBA预处理后,IL-1β mRNA的表达量显著降低(P<0.05,P<0.01),但0.50 mg/kg mbBA使IL-1β表达量升高,但差异不显著(P>0.05);BA预处理使IL-6表达量呈剂量依赖式上升(P<0.01);0.50 mg/kg mb和1.00 mg/kg mbBA使TNF-α的表达量极显著下降(P<0.01),但0.25 mg/kg mbBA预处理使肝脏TNF-α的表达量极显著上升(P<0.01);BA预处理均能提高IL-10 mRNA的相对表达量,以0.50 mg/kg mbBA组差异极显著(P<0.01)。

图5 BA对CYP致小鼠肝脏IL-1β(A)、IL-6(B)、IL-10(C)和TNF-α(D) mRNA表达的影响Fig. 5 Effect of BA on the mRNA expression of IL-1β (A), IL-6 (B),IL-10 (C) and TNF-α (D) in liver tissues of CYP-induced mice
3 讨 论
CYP作为氮芥类烷化剂,其抗癌谱广,广泛用于治疗各种癌症,因其胃肠道和肝脏等毒性作用临床应用受到限制。高剂量CYP可引起急性肝毒性效应,其特征是通过肝脏产生炎性细胞因子和自由基来诱导炎症级联反应和氧化应激。CYP可诱导肝细胞抗氧化能力下降,引起脂质过氧化,导致肝细胞受损,表现为肝功能指标ALT、AST和胆红素的增加以及血清白蛋白浓度的降低等[19],血清酶活力急剧升高表明肝脏中的细胞损伤和细胞膜功能完整性的丧失。本实验结果显示,CYP引起了肝脏中AST和ALT水平的上升,并且从病理切片中可以看出CYP引起肝细胞出现大量空泡,说明CYP造成了肝损伤,破坏肝细胞细胞膜的完整性;而用BA预处理后,能够下调由CYP引起的小鼠肝指数的上升以及血清酶活力的升高,说明BA通过具有潜在的修复细胞膜的稳定性,改善肝细胞形态结构,从而缓解CYP引起的肝脏损伤。
CYP在肝脏中经细胞色素P450氧化酶参与生物转化,形成具有高度毒性的代谢物——丙烯醛和磷酰胺,丙烯醛与GSH结合,干扰组织抗氧化防御系统,并诱导活性氧的过量生成,活性氧攻击细胞膜上的不饱和脂肪酸,引发脂质过氧化反应,产生MDA等物质[20]。本实验中,CYP组肝脏MDA含量升高,与Mahmoud等[21]的结果相似,说明CYP诱导产生肝脏的氧化损伤;用BA预处理后MDA含量下降,说明BA通过减少脂质过氧化,缓解机体的氧化损伤。CAT、SOD、GSH和GSH-Px作为抗氧化酶系统的重要组成部分,通过与其他酶协同完成细胞内的抗氧化作用。CAT主要存在于组织细胞的微粒体内,清除体内的羟自由基,催化H2O2的分解;SOD清除超氧阴离子自由基,保护细胞免受氧化损伤;而GSH-Px则主要通过催化GSH的活力,还原状态的GSH直接与活性氧自由基结合反应,从而清除体内的氧自由基,保护细胞免受有毒物质及氧化物的攻击[22]。Alqahtani等[19]研究发现,CYP引起小鼠肝脏CAT、SOD和GSH-Px的活力及GSH含量降低,诱导氧化损伤。本研究结果显示,CYP组CAT活力降低,说明CYP引起肝脏氧化应激;但SOD、GSH和GSH-Px水平升高,可能是CYP诱导的急性损伤引起的机体代偿性反应,刺激了SOD、GSH和GSH-Px的过度分泌,维持了机体氧化系统的平衡。据研究报道,头颈部癌症患者组织中GSH含量升高,但血液中GSH含量降低[23]。乳腺癌患者血液和组织中GSH含量随着疾病的发展而降低[24]。基于此,认为氧化应激引起初期组织损伤,GSH被谷氨酰胺转肽酶快速降解,以抵抗氧化应激引起的损伤,机体捕获到相关信号后,诱导组织中GSH快速合成和释放,来适应环境的变化;随着疾病的发展和组织的进一步损伤,GSH的消耗率高于合成率。因此,在氧化应激引起组织损伤的早期,损伤组织中GSH的水平高于正常组织[25]。BA预处理后,肝组织中CAT的活力以及0.25、1.00 mg/kg mbBA组GSH含量继续升高,说明BA通过增强抗氧化酶的活力,对CYP致肝脏氧化损伤起到预防性保护作用。但是BA预处理后,SOD活力出现下降趋势,说明BA通过恢复SOD活力和GSH的水平,改变氧化状态,维持氧化还原系统的稳定。有趣的是0.50 mg/kg mbBA组GSH水平出现下降趋势,这可能是因为药物在体内的效果是呈现U形趋势,即在一定的浓度范围内,随着药物浓度的升高,药效也升高,当达到最高药效时,继续增加药物的浓度会引起相反的结果,也就是说药物是有合适的浓度范围,过高或者过低可能会导致不良的结果[26]。因此,在本研究中,0.50 mg/kg mb的BA缓解了由CYP引起的GSH水平的上升。以上结果说明BA通过清除自由基和抗氧化特性对CYP诱导的氧化应激和肝脏损伤起保护作用。
氧化应激参与多种生理过程,尤其是在炎症应答中发挥类似“第二信使”的作用。越来越多的研究表明,炎性细胞因子是炎症反应的生理信使分子[27]。炎症包括炎症细胞的激活,促炎因子的分泌,以及不同炎症介质的释放,其中IL-1β、IL-6和TNF-α作为促炎因子,是研究炎症反应的重要细胞因子。已有研究证明,CYP诱导促炎因子IL-1β、IL-6和TNF-α分泌,抑制抗炎因子IL-10水平升高,导致炎症的发生[28-29];研究发现,小鼠腹腔注射CYP,刺激肝脏IL-1β和TNF-α mRNA表达增加,抑制IL-10 mRNA表达,诱导炎症反应。BA预处理缓解了CYP致肝脏IL-1β、TNF-α mRNA表达升高,降低IL-10 mRNA表达,Ajala-Lawal[30]和Li Nan[31]等研究发现,BA引起血液中IL-1β和成纤维滑膜细胞TNF-α mRNA的表达量下降;BA可恢复IL-10的表达量对肾脏起到预保护作用[32],这说明BA通过抑制促炎因子的分泌,促进抗炎因子的分泌,对CYP诱导的炎症反应起到预防性保护作用。虽然大量的动物实验显示CYP具有促炎效果[33-35],但有研究发现,CYP能抑制TNF-α和IL-12的分泌或者对IL-6、IL-10、TNF-α分泌没有影响[36-37],还有研究发现,CYP既能促进又能降低机体IL-6、IL-10、IFN-g和IL-1β水平[38-39]。CYP这种矛盾的现象可能是由于其对细胞因子产生的影响主要依赖于产生细胞因子和刺激的细胞,也有可能是几条通路共同参与了这一过程。本实验中,CYP使小鼠肝脏IL-6 mRNA表达水平显著降低,这可能是抑制促炎反应的对抗机制的一部分,CYP的促炎反应最终会引起代偿性抗炎反应。在BA预处理后缓解CYP致肝脏IL-6表达水平下降,此结果与Wang Xihong[25]报道一致。据研究报道,IL-6在大脑损伤后8~18 h内达到最高水平,而TNF-α在3~8 h达到最高水平,说明在代偿性反应中,细胞因子的改变与时间呈现一定的关系[40],出现IL-6、IL-1β和TNF-α表达量不同步情况。所以,在本研究BA引起IL-6 mRNA的表达呈相反趋势,并且不同剂量的BA对IL-1β和TNF-α mRNA表达水平的影响不同。综上所述说明BA能调控炎性因子的平衡对肝脏炎症损伤起到预防性保护作用。

