血卟啉单甲醚介导的声动力疗法对菌斑细菌生物膜作用效果的研究
闫春阳,王碧琳,庄德舒,张 祎,魏子征,毕良佳
菌斑细菌生物膜作为公认的口腔慢性感染性疾病的始动因子,导致慢性牙周炎的发生、发展。由于口腔是对外开放环境,更易被不同细菌附着[1]。细菌一旦形成有膜的结构,将具备远大于浮游、单个、散在致病菌的10~1 000倍强耐药性、强侵袭力、群体感应性及较低的抗生素敏感性,成为口腔细菌感染的始动因素。当微环境因子(micro-environmental factors)、β-内酰胺酶(β-lactamase)在特定部位达到较高浓度时对抗菌剂产生影响。口腔生物膜的群结构极其复杂,由表面到深层质地增密,氧气含量却逐渐降低,存在不易被唾液缓冲和稀释的弱酸成分。针对口腔内的致病菌,简单的刷牙虽有一定效果但不能完全去除[2],抗菌治疗是当前被广泛应用的治疗手段。抗生素的治疗方法分为局部治疗及全身治疗,但二者都存在局限性。常表现为:不能完全抵达炎症部位,不能有效破坏牙菌斑中的主要致病菌构成的生物膜结构,存在化学毒性、耐药性及二重感染性,因此治疗效果不佳。例如,广谱抗生素虽可有效杀灭口腔致病菌,但同样也会引起口腔内细菌的菌群失调并伴随口腔溃疡、糜烂等问题。且与单个浮游的细菌相比,菌斑生物膜的耐药性能更强,难以做到完全被清除。机械疗法在口腔临床操作中常分为洁治和刮治,对医生的临床操作水平要求较高且对周围无炎症的健康牙周组织损伤较大。研究表明菌斑生物膜的复杂结构、细菌组成和可变的表面形态是其耐药性的根源[3-5],其特定的酸碱度微生态环境[6]影响着菌斑生物膜中物质的运输。
超声(ultrasound, US)是一种靶向定位性强、穿透能力优良的机械波,可联合抗菌药物或声敏剂(以卟啉及卟啉类衍生物为主,产生单线态氧、活性氧、过氧化氢等物质),在杀菌方面效果突出。声动力疗法(sonodynamic therapy, SDT)是由声敏剂血卟啉单甲醚(hematoporphyrin monomethyl ether, HMME)介导的一种治疗方法,日本科学家Umemura等[7-8]首次提出,基于光动力疗法(photodynamic therapy, PDT)作用原理,在外界刺激下产生高氧化性能的物质。SDT中的US在组织内定位精确、穿过组织时不易扩散、穿透的深度强于PDT,其非侵入性、更小不良反应性、不易产生细菌耐药性及靶向治疗的特点具有优良的潜力。已有研究表明,由US激活HMME产生的单线态氧、过氧化氢等活性氧物质在治疗实体肿瘤细胞中有明显效果。本实验旨在研究SDT对菌斑细菌生物膜活性及膜性结构的影响,为临床慢性牙周炎治疗提供有效依据。
1 材料与方法
1.1 材料
牙周炎患者牙菌斑;哥伦比亚血平皿(含50 ml/L脱纤羊血、5 mg/L氯化血红素、1 mg/L维生素K1,海博生物,中国);HMME(上海先辉医药科技有限公司,中国);CM1135B脑心浸液培养基(500 g/瓶、Oxoid,英国);厌氧袋(三菱公司,日本);厌氧产气袋(三菱公司,日本);厌氧指数剂(三菱公司,日本);LIVE/DEADTMBacLightTMBacterial Viability Kit试剂盒(L7007,Thermo Fisher Science,中国);二甲基亚砜(DMSO,江苏永健化工有限公司,中国);24孔配套细胞爬片(上海联硕生物科技有限公司,中国);96、24孔细胞培养板(北京泽平科技有限责任公司,中国);35 mm平皿(北京冬歌博业生物科技有限公司,中国);无菌Gracy牙周刮治器(Hu-Friedy,美国);量程为0~20 μL、0~1 000 μL移液枪(力辰科技有限公司,中国)。
1.2 方法
1.2.1 仪器 CO2、37 ℃培养箱(Heraeus公司,德国);脉冲超声波仪器(哈尔滨工业大学物理凝聚态实验室,中国);可见光分光光度计UV762型(东莞市谱标实验器材科技有限公司,中国);超净工作台DL-CJ-1NDⅡ型(北京东联哈尔仪器制造有限公司,中国);立式高压灭菌器YXQ-LS-75G型(上海博讯实业有限公司,中国);高压灭菌器SX500型(上海莱睿科学仪器有限公司,中国);水浴震荡器HZS-H型(哈尔滨东联电子技术有限公司,中国)。
1.2.2 细菌培养 用无菌牙周刮治器刮取牙周炎患者的龈下菌斑放置BHI液体37 ℃、厌氧条件下培养,牙菌斑细菌悬液使用分光光度法监测培养,用分光光度计OD600=1.00确定浓度。当OD600=1.00时,样本细菌含量约为1×107个/mL,并加入已配比好的营养成分于无菌EP管中液体培养备用。
1.2.3 HMME制备 HMME由无菌PBS稀释到10、20、30、40、50、60 mg/L,在-20 ℃的冰箱中避光保存备用。使用时经水浴箱避光加热至37 ℃即可。
1.2.3 取样标准 取2018年12月至2019年6月于哈尔滨医科大学附属第四医院口腔科就诊的牙周炎患者6例(患者均签署知情同意书,本研究获得哈尔滨医科大学附属第四医院伦理委员会批准)。用无菌Gracy牙周刮治器刮取上颌颊侧或下颌舌侧龈下菌斑,嘱患者提前24 h不刷牙,且不使用漱口水等破坏口腔龈下菌斑的药物。将临床上收集到的龈下菌斑置于装有0.9%的生理盐水、密封性能良好的无菌EP管中,37 ℃恒温箱、厌氧保存。于离心机(5 000g、10 min)去除上清液,置于装有BHI液体培养基的EP管中37 ℃、厌氧培养。
纳入标准:患者年龄18~70岁;无全身系统性疾病如糖尿病等;无饮酒、吸烟等不良嗜好;近6个月内未曾接受过牙周、牙体牙髓治疗;30 d内无抗生素用药史。
排除标准:患有全身性疾病的患者;孕妇和哺乳期妇女;在检查之前接受过牙周治疗;在研究前30 d内使用过抗生素;口腔急性不可控性损害;牙髓疾病;参与本实验的研究人员。
1.2.4 HMME对龈下菌斑细菌生物膜的最小抑菌浓度 确定HMME在US强度为3 W/cm2、5 min的最小抑菌浓度。吸取均匀含有1.0 mL的牙菌斑细菌悬液置于无菌35 mm平皿上进行厌氧、37 ℃、孵育24 h,形成膜结构(经显微镜观察确定),用移液枪将悬浮液吸去。分别加入浓度为10、20、30、40、50、60 mg/L的HMME进行避光(0 mg/L HMME组为Control组用0.9%生理盐水替代)、厌氧、37 ℃孵育90 min,移液枪吸取平皿中悬浮菌液,置于EP管中,为后续菌落形成单位(colony-forming units,CFU)计算细菌生存率做准备。样本6例,每组重复3次,用计数软件Image J进行分析。
1.2.5 SDT分组 吸取200 μL的OD600=1.00的牙菌斑细菌悬液置于无菌的96孔板中,厌氧、37 ℃孵育24 h后形成带膜结构(经显微镜观察确定),用移液枪轻柔吸去悬浮液。随机分4组,1组为Control组,0.9%生理盐水200 μL;2组为单纯HMME组,HMME溶液(50 mg/L,最小抑菌浓度)200 μL;3组为单纯US组(3 W/cm2、5 min),0.9%生理盐水200 μL;4组为SDT组为US(3 W/cm2、5 min)和HMME溶液(最小抑菌浓度)200 μL均避光孵育90 min。样本6例,每组重复3次,Image J分析得到细菌存活率。
1.2.6 CFU 将处理好的牙菌斑细菌悬液用量程为20 μL的移液枪吸取20 μL溶液均匀分布在BHI血平板上37 ℃、厌氧培养7 d,在同一地点、相同光线下对BHI血平板进行拍照,并用Image J进行计数,将数据用来确定HMME最小抑菌浓度和SDT条件下细菌的生存率。
1.2.7 激光共聚焦扫描电镜(confocal laser scanning microscopy,CLSM)观察菌斑细菌生物膜中细菌死/活菌分布 检测菌斑细菌生物膜的生存结构,利用光学原理不仅可以2D也可以3D重建[9],并观察检测细菌生物的动态变化过程[10]。对SDT组使用LIVE/DEADTMBacLightTMBacterial Viability Kit试剂盒,将1.0 mL牙菌斑细菌悬液在35 mm平皿中37 ℃、厌氧、孵育4 d,成膜(显微镜观察确定)。用移液枪轻柔吸取悬浮液后,用3 μL的SYTO 9和PI混合物分别加入提前处理好成膜的35 mm平皿中,避光、37 ℃、孵育15 min,与LIVE/DEADTMBaclightTMBacterial Viability试剂盒混合。用FITC-TRITC双带激发滤波器对SYTO 9和PI进行细菌染色效果进行观察。激光强度在SYTO 9激发光约为476/500 nm(绿色)通过发射滤光片观察活细胞和PI激发光约为476/635 nm(红色)通过发射滤光片观察死细胞。
1.2.8 扫描电子显微镜(scanning electron microscopy, SEM)观察菌斑细菌生物膜形态结构变化 SDT 4组中选取无菌24孔板、细胞爬片(与24孔板配套、直径12 mm),加入300 μL牙菌斑细菌悬液37 ℃、厌氧、孵育4 d,镜下检查细胞爬片成膜。①取材:将覆有细胞的细胞爬片取出;②固定:用无菌pH=6.8的PBS溶液轻柔地冲洗3次,除去漂浮菌,2.5%戊二醛(pH=7.2)、4 ℃冰箱中固定1.5 h以上;③冲洗:分别用0.1 mL PBS溶液冲洗2~3次,每次10 min;④脱水:依次取30%、50%、70%、80%、90%、100%的乙醇进行脱水,每次10~15 min,100%的乙醇脱水2~3次,每次10~15 min;⑤置换:100%乙醇∶叔丁醇=1∶1,纯叔丁醇各1次,每次15 min;⑥干燥:-20 ℃冷冻、30 min、干燥4 h;⑦粘样:被检测面向上,导电胶带粘在扫描电镜样品台上;⑧镀膜:离子溅射镀膜仪镀金属;⑨膜检测:样品于扫描电子显微镜下观察。
1.3 统计学方法
相应实验数据用SPSS 25.0统计分析软件处理,应用单因素方差分析的统计学方法,采用LSD-t检验比较不同组别之间的差异。当P<0.05时,存在显著统计学差异。
2 结 果
2.1 HMME对菌斑细菌生物膜的最小抑菌浓度
如表1所示,50 mg/L的HMME组的牙菌斑CFU相对于0、10、20、30、40 mg/L HMME组的牙菌斑的CFU明显降低,呈剂量-效应关系明确(P<0.05)。但相比于60 mg/L HMME组,牙菌斑的CFU明显增加(P<0.05)。因此HMME对牙菌斑的最小抑菌浓度为50 mg/L。

表1 HMME对龈下菌斑细菌生物膜的最小抑菌浓度Tab.1 Minimum inhibitory concentration of HMME on bacterial biofilm of subgingival plaque
2.2 SDT对菌斑细菌生物膜的CFU的影响
如图1所示,其中,HMME组CFU与Control组有显著性差异(P<0.05);US组与Control组、HMME组有显著性差异(P<0.05);SDT与Control组、HMME组有显著性差异(P<0.05);US组与SDT组差异性不明显。HMME组、Control组牙菌斑CFU均为正态分布关系。且SDT组细菌存活率仅为0.15%、US组细菌存活率为7.94%、HMME组细菌存活率为61.83%。

HMME组与Control组比,P<0.05;US组与HMME、Control组比,P<0.05;SDT组与HMME、Control组比,P<0.05图1 SDT对菌斑细菌生物膜的杀伤效果Fig.1 The killing effect of SDT on dental plaque bacterial biofilm
2.3 SDT对菌斑细菌生物膜的死/活菌检测
如图2所示,SDT组、US组、50 mg/L HMME组菌斑细菌生物膜的活菌的分布明显低于Control组(P<0.05)。SDT组、US组菌斑细菌生物膜的活菌明显低于50 mg/L HMME组,死菌分布高(P<0.05)。SDT组与US组相比活菌更少,以死菌作为主体存在(P<0.05)。
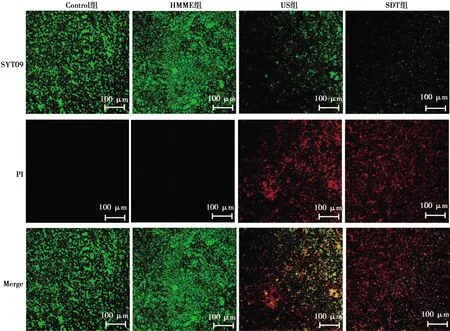
图2 CLSM观察SDT对牙菌斑细菌生物作用的影响Fig.2 Confocal laser scanning microscope to observe the effect of SDT on the biological effects of dental plaque bacteria
2.4 SDT对菌斑细菌生物膜的形态结构影响
如图3所示,Control组的生物膜结构趋于完整、致密,细菌与细菌间粘附集聚呈团状、细菌形态完整、边缘清晰、膜结构及细菌排列密度高。HMME组相比较于Control组差异不明显;SDT组相比于其他3组,变化最为明显,表现为菌斑细菌生物膜结构完整性被破坏伴随疏松状态、细菌形态改变、边缘模糊、膜结构及细菌排列密度低。

图3 SEM观察SDT对菌斑细菌生物膜结构的影响Fig.3 Scanning electron microscopy images to observe of the effect of SDT on the plaque bacterial biofilm structure
3 讨 论
中老年人牙齿缺失的首要因素是慢性牙周炎[11],菌斑生物膜作为一种不易被水冲去[12]的膜结构,临床中易导致牙周炎。菌斑生物膜是由以厌氧菌作为主体构成的膜性结构。细菌膜性结构的耐药性相比较浮游、单个、散在细菌强10~1 000倍,破坏细菌生物膜结构成为目前治疗牙周炎的难点。临床上常见传统方法为:机械疗法包括洁治与刮治但对菌斑生物膜的清除能力不足;抗生素疗法则存在耐药性、二重感染性及不能缓释药物维持药物浓度的缺点。SDT的促渗作用可协同药物作用,增强药物疗效,但目前没有足够实验证实SDT对菌斑细菌生物膜有破坏作用,本课题组通过SDT对菌斑生物膜的细菌活性及膜结构进行检测,完善SDT的相关性能,同时也为进一步探索牙周炎治疗手段提供良好思路。
声敏剂是一类声敏性化合物,在靶组织中被US激活,产生细胞毒性。声敏剂存在众多衍生物,常见为卟啉类化合物、抗癌药、非甾体类抗炎药、黄原酮类化合物及其他声致敏剂[13]。卟啉类化合物作为主流声敏剂应用广泛,Umemura等[14]实验表明,50 mg/L的血卟啉对S-180细胞无细胞毒性,但当增加US强度和照射时间(3.2 W/cm2、 1 min),细胞致死率可高达98%。
US作为外源性刺激常产生空化、热、机械、辐射压力及声流微效应。目前超声空化效应[15]最被大家认可,空化效应是加入额外的周期性变化的US使存在于液体内的微泡被拉开成空化核的一种阈效应[16],可增强靶向药物的浓度、保证半衰期、达到缓释的效果时增强渗透作用。US的频率和强度增加与细菌的存活率呈负相关性[17-18]。US的发展史已有近百年,1929年Harvey等[19]首次发现US在杀菌方面有效果,1991年Scherba等[20]证实US对大肠杆菌等常见致病易感菌群杀伤效果显著,超声空化效应被认为是主要效应机制。1997年Qian等[21]发现庆大霉素介导的US对铜绿假单胞菌有杀伤效果,表明US与抗生素在杀菌方面有着协同作用。Zhuang等[22]体外细菌实验表明,HMME介导的SDT对金黄色葡萄球菌有显著的杀菌效果。随后,蒋治楠等[23]2016年发现US可以增加HMME在金黄色葡萄球菌生物膜的渗透程度,渗透程度与强度、频率和作用时间相关。2018年许亚玲等[24]使用低频超声US作用在表皮葡萄球菌生物膜后,生物膜结构排列不再紧密且表皮葡萄球菌数量下降。
慢性牙周炎致病菌主要为兼性厌氧菌和/或厌氧菌,US同样对厌氧菌存在治疗效果。2019年王玮等[25]研究发现在人离体牙的根管中加入粪肠球菌(兼性厌氧菌),经孵育14 d后形成生物膜结构,当US联合2.5%的NaClO溶液作用时,经扫描电镜显示可有效地破坏并去除人离体牙根管壁上的成熟粪肠球菌生物膜结构。2019年孙菲等[26]通过观察健康种植体、种植体周围炎内龈沟液中牙龈卟啉单胞菌、血链球菌含量,证实种植体周围炎组内龈沟液中牙龈卟啉单胞菌检出含量明显高于健康种植体组;而血链球菌的检出率却明显低于健康种植体组。2019年尚新华等[27]利用US联合甘氨酸行龈下喷砂术可去除种植体表面牙石和附着的菌斑生物膜,使种植体表面恢复光滑平整、细菌生物膜的附着降低。当使用甘氨酸颗粒(直径为65 μm)对实验组内牙6个定位点进行喷砂5 s、0.9%生理盐水冲洗20 s,发现牙龈红肿出血、探诊深度均有所改善。以上实验都可以证实US对厌氧菌的杀伤效果显著,并为SDT治疗厌氧菌组成的膜结构提供有利基础。
综上所述,SDT(强度3 W/cm2、5 min、50 mg/L HMME)对菌斑细菌生物膜有显著的杀伤效果,这为慢性牙周炎的治疗提供有利依据,为早日临床治疗提供可能性。本课题组将利用SDT穿透能力强及定位准确这一优势特性,进一步完善性能满足临床上精准治疗的需求,使其作为新一代潜能良好的治疗方法,早日应用于临床治疗。

