Piezo1离子通道在口腔医学中的研究进展
杨子圆,卢海平,康 婷
人体内的多种器官、组织和细胞均可感受外环境中的力学机械刺激,通过机械敏感性离子通道激活细胞信号转导途径。压电离子通道1(Piezo1 ion channels,Piezo1)是2010年Coste等科学家于N2a细胞(Neuro2A Cells,N2a)中发现的,随后通过序列同源性发现第2个蛋白——压电离子通道2(Piezo1 ion channels,Piezo2)[1]。自这类通道蛋白被发现以来,Piezo通道蛋白家族便迅速引起各个领域学者的广泛关注,成为了一个新的研究热点。本文将针对Piezo1机械敏感性离子通道的一些研究进展及在口腔医学中的研究价值进行归纳和总结。
1 Piezo1离子通道的研究现状概述
离子通道作为活体细胞物质交换的重要途径,其活性对细胞实现各种功能具有重要意义。哺乳动物触觉受体神经元和其他机械敏感性细胞(如内皮细胞或平滑肌细胞)的活化被认为主要是由机械敏感性离子通道的活化所引起的。Piezo1作为Piezo家族的初始成员,首先是被确定为成神经细胞瘤细胞系N2a中膜压痕和膜拉伸诱导电流所必需的机械活化离子通道。后续的多个研究也证实Piezo1在哺乳动物机械转导中具有重要作用[2-3]。
Piezo1广泛存在于人体的器官组织中[2],机体的免疫应答、神经细胞分化、肿瘤发生发展、骨形成与改建等生理病理过程都与Piezo1密切相关。人类染色体疾病——如常染色体隐性全身性淋巴管发育不良伴胎儿免疫性水肿[4-5]和遗传性口形红细胞增多症[6]等与Piezo1蛋白基因变异息息相关。在神经细胞分化过程中,Piezo1是神经干细胞机械敏感谱系选择的重要因素[7],它通过激活Ca2+内流,促进机械反应转录共激活因子YAP蛋白(Yes-associated protein,Yap)的核定位,从而影响神经元与神经质的特性。而Piezo1驱动的Ca2+内流,还可激活钙蛋白酶并组织皮层肌动蛋白支架,将该机械传感器与TCR信号传导联系起来,以调节机体免疫应答[8]。另有学者在癌症相关研究中发现,Piezo1在乳腺上皮细胞系的表达程度与乳腺癌细胞的良恶性程度密切相关[9],表明Piezo1在癌细胞增殖、侵袭和转移中可能发挥作用;Piezo1通过调节胃癌细胞(gastric cancer cells,GC)骨架重组来控制GC的增殖、迁移和侵袭等致癌作用[10-11]。此外,在骨的形成和重塑方面已有研究证实,Piezo1参与了具有多向分化潜能的间充质干细胞(mesenchymal stem cells,MSCs)向成骨细胞分化的过程。有学者在静水压(hydrostatic pressure,HP)对MSCs活动影响的研究中发现,HP促进成骨细胞分化取决于MSCs中成骨转录因子BMP2(bone morphogenetic protein 2,BMP2)的表达,而后者由Piezo1调节,因而Piezo1在MSCs充当中HP的受体,促进了成骨细胞分化[12]。在骨骼系统中,骨细胞作为骨骼内将机械刺激转换为生化信号的机械刺激感觉系统,使机体不断适应机械负荷变化[13-14],而Piezo1通道在小鼠成骨细胞增值分化、骨形成和骨重塑中起着关键作用[15-16]。
2 Piezo1离子通道在口腔医学中的研究现状
2.1 Piezo1离子通道在牙齿感觉系统中的作用
牙本质过敏是临床常见的引起牙齿疼痛的原因。外部刺激引起牙本质小管内液体流动,激活牙本质中的初级传入神经元和成牙本质细胞中相应的神经传导通道,使牙髓神经产生疼痛感受[17-18]。
Piezo在牙齿感觉系统中作为特定的机械传感器起着至关重要的作用[19]。Zhang等通过研究发现,Piezo1在感觉神经元中的异位表达可以使正常小鼠的触觉和本体感觉敏感,并可使因Piezo2基因缺失而丧失触觉和本体感觉的小鼠恢复触觉和本体感觉。因此,Piezo1在感觉神经元中表达水平的显著减少,可抑制机械性疼痛反应,表明Piezo1可以影响触觉,抑制急性机械性疼痛[20]。另有学者在有关Aδ类神经元是否通过成牙本质细胞的神经递质引起动作电位从而介导牙本质感觉转导的研究中,发现Piezo1在成牙本质细胞中存在功能性表达,且Piezo1拮抗剂能够显著抑制成牙本质细胞中机械力诱发的Ca2+内流,从而影响牙齿痛觉的形成[21](见图1)。
2.2 Piezo1通道在人牙髓干细胞组织再生工程方面的作用
细胞感受机械力最常见的方式是将细胞内腺嘌呤核苷三磷酸(Adenosine triphosphate,ATP) 释放到细胞外空间,细胞外ATP可通过激活配体门控离子通道腺嘌呤核苷酸受体X(P2X-purinoceptors,P2X)受体和一些G蛋白-受体来调节多种细胞功能,并介导细胞间通信。目前研究证明,Piezo1通道作为一种内在的机械传感器,可对机械刺激做出响应,触发ATP释放,并在随后的腺嘌呤核苷酸受体(P2-purinoceptors,P2)受体激活中具有信号传导作用[22]。
人牙髓干细胞(human dental pulp stem cells,DPSCs)中同时存在Piezo1通道和Piezo2通道,并且低强度脉冲超声可激活Piezo通道的表达,刺激DPSCs的增殖[23]。Mousawi等研究了DPSCs中Piezo1 mRNA和蛋白质的表达情况,以及将DPSCs分别暴露于Yoda1(Piezo1通道特异性激活剂)和钌红或GsMTx4(两种Piezo1通道抑制剂)时细胞内Ca2+浓度,发现Piezo1通道通过诱导ATP释放和随后的P2受体嘌呤信号传导以及下游蛋白酪氨酸激酶2(prolinerich tyrosine kinase 2,PYK2)和MEK/ERK信号传导通路的激活,从而刺激人牙髓干细胞(DPSCs)迁移。该发现揭示了调节DPSCs迁移的分子和信号传导的新机制,将有助于DPSCs的组织工程和再生医学方面的研究[24](图1)。
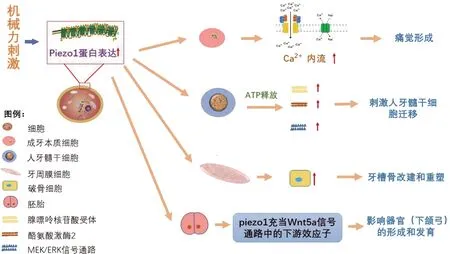
图 1 Piezo1作用机制 Fig.1 Piezo1 mechanism of action
2.3 Piezo1离子通道在牙周组织中的作用
牙周膜是位于牙骨质和牙槽骨之间的一层膜状结构,牙周膜细胞通过向周围细胞发出信号来响应机械应力,调节骨基质的吸收和形成,维持牙槽骨吸收和再生之间的平衡[25-27]。
众所周知,牙周膜细胞是机械敏感性细胞,而作为机械敏感性离子通道一员的Piezo1,其在牙周膜细胞的机械刺激反应中所起的作用引起了研究人员的兴趣。Jin等通过半定量逆转录聚合酶链反应评估了Piezo1和破骨细胞生成标志基因表达的关系,发现增加牙周膜细胞的机械负荷可诱导破骨细胞生成标记基因和Piezo1的上调,Piezo1 mRNA在机械负载0.5 h后会持续增加。该实验证实了Piezo1与牙周膜细胞感受机械刺激密切相关;并在机械应力诱导的破骨细胞形成过程中扮演机械转导的角色[28]。因此,Piezo1是多种牙周组织细胞中的机械换能器(例如,在成牙本质细胞分化过程中将HP信号与细胞内进行传导[29])。
机械敏感性离子通道Piezo1在成骨细胞机械转导中亦具有重要作用[25,30]。Zhang等研究发现鼠成骨细胞在静态机械力作用下,Piezo1通道的介导减少可抑制鼠成骨细胞中的胶凝活性;Piezo1通道的表达与骨保护蛋白(Osteoprotegerin,OPG)的表达之间具有较高的正相关性[31]。此发现为进一步研究正畸引起的牙根吸收和修复机制提供新思路。
牙周膜细胞作为机械敏感性细胞,感应和传导正畸力,引起了牙槽骨改建和重塑,这是正畸牙移动的生物学原理[32]。康婷等对Piezo通道在正畸牙移动过程中的作用进行了研究,利用大鼠牙移动模型,分析了正畸牙移动过程中牙周组织以及三叉神经节中的Piezo mRNA和蛋白的表达情况,结果发现正畸力作用于大鼠牙周组织后,Piezo1 mRNA和蛋白的表达量表现为先增高后下降的趋势;三叉神经节中的Piezo1 mRNA表达则呈现逐渐上升趋势。由此可见,Piezo1在牙周膜细胞感受和传导正畸力中具有重要作用,同时可能参与机械力诱发的牙齿痛觉形成过程[33](图1)。
2.4 Piezo1离子通道在下颌骨形态发生中的作用
颅面畸形是常见的出生缺陷[34]。第一鳃弓的下颌部分产生包括下颌的多个结构,其变异与某些综合征(如Robinow综合征)和一些常见畸形特征(例如下颌后缩和骨性偏颌)相关。已有研究发现,Piezo1通道基因发生突变(常染色体隐性突变)与上述发育不全的面部畸形相关[35-36]。
最新的一项研究发现Robinow综合征的下颌发育不全与细胞极性和迁移相关,而非Wnt5a基因的重复、缺失和过表达所引起。学者将下颌弓两种明显的生长方式作为3D形态发生的两种不同模式的模型进行研究,发现三维立体培养的间充质细胞(3D间充质细胞)的插入对小鼠胚胎下颌弓的形成至关重要;而Piezo1和Yes相关蛋白/转录共激活因子PDZ结合基序(Yes-associated protein/transcriptional co-activator with PDZ-binding motif,YAP/TAZ)充当了 Wnt5a介导的肌动球蛋白极性和定向驱动间充质细胞嵌入的细胞质钙瞬变的下游效应子[37](图1)。该发现促进了我们对发育途径中如何通过调节生物物理特性和力来塑造一个实体器官原基的理解,同时为发育缺陷引起的颅面畸形和某些综合征的防治提供了新思路。
3 总结及展望
机械敏感性离子通道Piezo1广泛存在于人体组织中,与人体的多种疾病和生理活动密切相关,并且在口腔多个组织中充当机械传感器,在细胞的生理功能中具有重要作用。近几年国内外学者已经对Piezo1通道在牙周组织的生理活动、牙本质疼痛以及牙髓间充质干细胞组织再生等方面的作用开展了初步研究。但是,对于Piezo1在口腔组织生理及病理过程中的具体作用机理以及在各相关信号通路中的具体角色仍需进一步探索。对Piezo1更深入的研究将为正畸牙移动以及口腔临床一些疑难病症——如牙本质敏感、颞下颌关节疾病以及颅面畸形等方面提供新的研究和治疗思路。
——人工离子通道

