数控剪应力微流装置评价新加达原散对MRSA生物膜的影响
石岩 齐文升


摘要 目的:通过XTT法和微流体系统观察评价新加达原散对耐甲氧西林的金黄色葡萄球菌标准菌株生物膜内细菌数量生物膜形成的影响作用。方法:1)XTT法观测空白组、万古霉素组及新加达原散组(水提取、醇提取)对MRSA标准菌株生物膜成熟期膜内活菌的影响。2)Bioflux200系统中接种MRSA菌至观察区,细菌生物膜形成后分别在各进孔加入一定浓度的新加达原散水提物、醇提物及万古霉素,同时设立溶剂对照组和空白组。然后在0.5 dyne剪切力作用下连续培养30 h,观察各组生物膜的形成情况。结果:1)XTT法观测结果显示,新加达原散可明显减少形成期及成熟期MRSA生物膜膜内活菌数量。2)2种浓度新加达原散水提物、醇提物组生物膜形成面积明显减少,空白组、溶剂对照组生物膜面积增大,万古霉素组生物膜形成面积较前减少,但无新加达原散2组明显。结论:新加达原散减少了MRSA生物膜膜内细菌数量。在流动状态下,一定浓度新加达原散在剪切力的作用下可抑制MRSA生物膜的形成;Bioflux200可以用于抑制细菌耐药中药的疗效评价。
关键词 新加达原散;耐甲氧西林金黄色葡萄球菌;生物膜;XTT法;微流装置;剪应力;浓度;评价
Abstract Objective:To observe and evaluate the effect of Xinjia Dayuan Powder on the formation of the number of bacteria in the biofilm of methicillin-resistant Staphylococcus aureus standard strains by using The XTT method and microfluidic system Methods:1)The XTT method was used to observe the effects of the blank group,vancomycin group and Xinjia Dayuan Powder group(water extraction,alcohol extraction)on the living bacteria in the MRSA standard strain biofilm at the mature stage.2)We inoculated MRSA bacteria in the Bioflux200 system to the observation area.After the bacterial biofilm was formed,we added a certain concentration of Xinjia Dayuan Powder water extract,alcohol extract,solvent control group,blank group and vancomycin to each inlet hole,and then under the action of 0.5 dyne shearing force,they were continuously cultured for 30 h to observe the formation of biofilm in each group.Results:1)XTT method showed that Xinjia Dayuan Powder can significantly reduce the number of viable bacteria in the MRSA biofilm during the formation and maturation phase.2)The area of biofilm formation in the water extract and alcohol extract group of the 2 concentrations of Xinjia Dayuan Powder decreased significantly,the area of biofilm formation in the blank group and solvent control group increased,and the area of biofilm formation in the vancomycin group decreased compared with the previous one,but not significantly different than the 2 groups of Xinjiada Yuan Powder.Conclusion:Xinjia Dayuan Powder can reduce the number of bacteria in MRSA biofilm.In the flowing state,a certain concentration of Xinjia dayuan Powder can inhibit the formation of MRSA biofilm under the action of shearing force; Bioflux200 can be used to evaluate the curative effect of antibacterial Chinese medicine.
Keywords XinJia Dayuan Power; Methicillin-resistant Staphylococcus aureus; Biofilm; XTT method; Microfluidic device; Shear stress; Concentration; Evaluation
中圖分类号:R285.5 文献标识码:A doi:10.3969/j.issn.1673-7202.2020.20.008
抗生素耐药性已经成为世界范围内的一个重大公共卫生问题。[1]耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus Aureus,MASR)更是临床上常见的耐药细菌。CHINET[2]2017年的统计数据显示,全国金黄色葡萄球菌耐甲氧西林菌株显示出对整组β-内酰胺类抗生素的耐药性。细菌生物膜是细菌在生长过程中为了适应环境而分泌出多糖基质、脂蛋白等多种物质复合的多糖复合物,是能够粘连、缠绕并聚集不同细菌在多糖复合物内而形成的膜样物[3]。由于MASR膜形成能力极强[4],引起感染的特点往往为不同期交替发作、易复发以及难治愈[5]。有研究[6]发现,耐甲氧西林金黄色葡萄球菌的耐药与其形成生物膜有很大相关性。本实验研宄通过对照观察空白组、新加达原散组(水提取和酯提取)和万古霉素组对耐甲氧西林金黄色葡萄球菌標准菌株细菌生物膜成熟期内活菌数量的影响,及数控剪应力微流装置对4组成熟期生物膜形成动态缠绕并聚集不同细菌在多糖复合物内而形成的膜样物影响的观察,探究新加达原散对体外生物膜形成的影响以及膜内细菌的抑制作用。报道如下。
1 材料与方法
1.1 材料
1.1.1 菌株 MRSA(ATCC,美国,型号:43300),购自美国典型微生物菌种保藏中心,接种至LB平板,4°冰箱保存。
1.1.2 药物 新加达原散颗粒剂:柴胡、青黛等(新绿色药业股份有限公司提供,由中国中医科学院广安门医院药剂科对每枇煎剂样本进行纹图分析比照);注射用盐酸万古霉素Vancomycin(ELILILLY ITALIA S.P.A,意大利,批号:C659149);乙醇(国药集团,批号:10009527);胰蛋白胨、酵母提取物(Oxoid,英国,批号:1863590,1390139-02);氯化钠(国药集团,批号:20180509);XTT(SIGMA,美国,型号:X4626);吩嗪硫酸甲酯(PMS)(SIGMA,美国,型号:P9625)。
1.1.3 试剂与仪器
1.1.3.1 试剂 LB培养基(胰蛋白胨10 mg/L,酵母提取物5 mg/L,氯化钠10 mg/L,葡萄糖2.5 mg/L,pH 7.4~7.6,超纯水配制,高压蒸汽灭菌,4°保存);含糖LB培养基(胰蛋白胨10 mg/L,酵母提取物5 mg/L,氯化钠10 mg/L,pH 7.4~7.6,超纯水配制,高压蒸汽灭菌,4°保存);磷酸盐缓冲液(PBS)(北京索莱宝科技有限公司,批号:P1010)超纯水定容2L,髙压蒸汽灭菌,室温保存;0.9%氯化钠溶液(氯化钠9 g/L。用超纯水配制);XTT溶液(将称量好的XTT粉末加含糖LB培养基配成1 mg/mL的溶液,水浴70 ℃加热至充分溶解实验时现配现用,注意避光);PMS溶液(将称量好的PMS粉末加超纯水配成3.06 mg/mL的溶液,0.22 pm微孔滤膜过滤除菌,置4 ℃冰箱避光保存);新加达原散醇提物(精确称量新加达原散颗粒剂,反复用乙酸乙酯溶解中药颗粒剂,1 000 r/min离心5 min,取上清液至一烧杯;直到所收集的乙酸乙酯上清液肉眼观为无色透明;将收集的上清液经旋蒸仪蒸干至粉末状,用无水乙醇溶出,制成按颗粒原剂量计算为5 g/mL的浓缩液,置4 ℃冰箱保存备用);新加达原散水提物(将上述乙酸乙酯提物余下的药液用水充分溶解,水溶液离心除杂质;上清液水浴蒸干后用定量的LB培养基溶解制成250 mg/mL的溶液,0.22 μm微孔滤膜过滤除菌分装入EP管内置置4 ℃冰箱保存备用)。
1.1.3.2 仪器 24孔板(康宁,美国,型号:3524),接菌环(Biologix,美国,型号:65-0001),生物安全柜(西班牙泰事达公司,西班牙,型号:BIO II Advance),恒温恒湿培养箱(BINDER,德国,型号:KMF240),全自动八道洗板机(美国伯腾仪器有限公司,美国,型号:ELX50),分光光度计(三洋电机株式会社,日本,型号:MLS-3750),恒温振荡器(江苏太仓市实验设备,型号:THZ-D),Bioflux200型数控剪切流活细胞自动分析平台系统(Fluxion Biosciences,美国,型号:Bioflux200)酶标仪(Bio-Rad公司,美国,型号:iMark),共聚焦激光扫描显微镜(Oympus公司,日本,型号:FV1000),Bio Flux WPM 48 Well Plates(Fluxion Biosciences,美国,型号:910-0003)。
1.2 方法
1.2.1 XTT法检测药物作用后MASR生物膜膜内形成期和成熟期活菌量 1)菌液配制:从MASR的LB培养皿上挑取单菌落置于少许LB液体培养基中,恒温280 r/min震荡16 h,后将菌液稀释至OD600=0.1[7]。2)XTT法检测:将新加达原散水提物、醇提物分别用含糖LB培养基倍,万古霉素为溶剂1 mg/mL;乙醇稀释浓度同醇提部分[8]。最后微孔板法检测MRSA生物膜成熟期的活菌量,取2个96孔板,空白对照组加入如下同体积的培养液菌液和药液(倍比稀释法加药[9]),37 ℃恒温恒湿48 h后洗板机洗板后加入XTT-PMS,1.5 h后酶标仪测定OD值。
1.2.2 数控剪应力微流装置评价药物作用后耐甲氧西林金黄色葡萄球菌生物膜影响 1)菌液配制:方法同上。2)药液配制:取上述实验结果进行药液浓度配置,将新加达原散水提物用含糖LB培养基配125 mg/mL,醇提物配成250 mg/mL;万古霉素配成终末浓度0.08 mg/mL。空白对照(培养基)、乙醇稀释浓度同醇提部分溶剂对照(无水乙醇)。
1.2.3 Bioflux系统下观察药后MRSA菌生物膜的影响 1)将Bioflux系统[10]切开孔的薄膜后,先用培养基将BioFlux Plate润湿。于出口加入200 μL培养基。出口至入口方向加力5 dyn/cm2,5 min;静置1 h;吸去入口及出口废液。2)加入菌液。入口加入100 μL培养基,出口加入100 μL菌液;出口至入口方向加力2 dyn/cm2,5 s,显微镜下见观察窗内布满细菌;静置2 h;弃去入口及出口废液。3)生物膜培养。入口加入1 mL培养基,出口加入100 μL培养基;入口至出口方向加力0.5 dyn/cm2。于37 ℃培养30 h,每15 h更换培养基。4)分组给药:吸去入口废液后,分为空白组(于入口处加入1 mL培养基)、无水乙醇对照组、水溶实验组、醇溶实验组、万古霉素组。在0.5 dyn/cm2下37 ℃恒温加热板培养。取像1 h/1次。
1.3 统计学方法 采用SPSS 20.00统计软件进行数据分析,计量数据以均数±标准差(±s)表示,采用配对t检验;计数资料用百分比/率(%)表示,采用χ2检验,以P<0.05为差异有统计学意义。利用Bioflux Montage图像处理软件的Fluorescence Adhesion以及Percent area模块进行图像自动分析并统计。利用Graph Pad Prism 5.0绘图。
2 结果
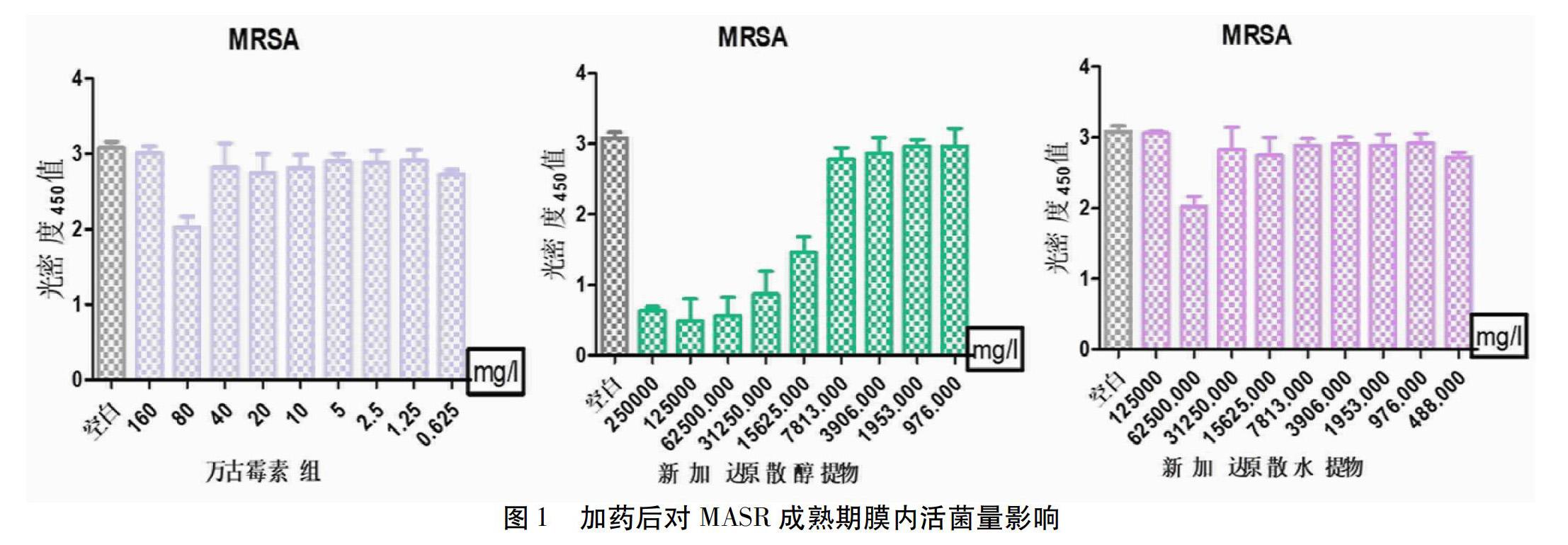
2.1 微孔板法结果 与空白对照组比较,在生物膜成熟后,一定浓度的万古霉素对MASR生物膜形成期内活菌量有作用,而新加达原散水提物在125~62.5 mg/mL浓度范围都能显著减少膜内活菌量,新加达原散醇提物在250~31.25 mg/mL濃度范围都能显著减少膜内活菌量。依据以上结果,在后续实验中将2组新加达原散组浓度分别设定为250 mg/mL(醇提物)、125 mg/mL(水提物),万古霉素组浓度设0.08 mg/mL。见表1,图1。针对乙醇杀灭细菌作用考虑该溶剂对膜内细菌是否有杀灭作用进行了实验,结果示两者差异无统计学意义(P>0.05),提示乙醇溶剂对MASR生物膜内活菌影响不明显。见图2。
2.2 新加达原散对MRSA菌生物膜形成的影响 利用Bioflux Montage图像处理软件进行图像自动分析,空白组、无水乙醇对照组均形成了较致密的菌斑生物膜并随时间变化生物膜面积逐渐增加。250 mg/mL新加达原散(醇提物组)、125 mg/mL新加达原散(水提物组)、万古霉素组均有菌斑生物膜形成,给药后随着时间变化生物膜面积逐渐减少,其中125 mg/mL新加达原散(水提物组)细菌生物膜面积减少最为明显,万古霉素组生物膜面积变化较小。见图3,表2。
3 讨论
耐甲氧西林金黄色葡萄球菌生物膜被视为细菌耐药性的一种方式[11]。抗生素能够有效杀死生长和分裂的细菌[12]。抗生素可以通过杀死自由漂浮的细菌,但通常不能根除嵌入的细菌生物膜中的细菌。抗生素阶段治疗后停止使用,细菌仍然可以恢复成生长状态形成生物膜进而导致感染复发[13-14]。万古霉素被认为是治疗耐甲氧西林金黄色葡萄球菌感染的推荐用药,却具有明显的肾毒性,不宜长期使用了[15]。生物膜中的细菌处于休眠状态这类似于潜在的致病因素,与中医伏邪有异曲同工之妙。吾师认为伏邪治疗应从两方面入手:1)清解:伏邪发则为温病,故性属热邪,无论热邪潜伏,还是外邪入里化热,皆当“热者寒之”。2)透散:邪气内伏,宜调节气机升降,透散外达,给邪以出路,若单用苦寒直折,易冰伏邪气,加重病情。故创建本方,即根据中医“伏邪”理论,由“达原饮”“升降散”“小柴胡汤”的构成,主要研究新加达原散不同于常规
图3 给药前后4组MASR生物膜形成变化
的治疗细菌感染的清热解毒方法。本方讲求“清热凉血、透膜散结、调节气机升降出入”,以清透为治疗大法,其组方特点和配伍方法,具备中医理论和临床治疗特色,比西医治疗有很大的优势和临床价值。从我们的实验结果来看,只有一定高浓度(临床往往达不到)万古霉素对耐甲氧西林金黄色葡萄球菌生物膜的成熟期才有影响。新加达原散颗无论是水提取物还是乙醇提取物对成熟的耐甲氧西林金黄色葡萄球菌生物膜形成有明显的作用。体外实验有一定局限性:1)细菌体外实验生物膜可能不准确代表体内生物膜[16]。2)治疗方案中能够完全清除既定范围内的所有生物膜慢性细菌感染仍有待鉴定[17]。3)新加达原散在体外和体内是否一致仍有待讨论。4)本研究也只针对生物膜耐药,不涉及其他耐药方式。建议对生物膜成膜能力进行鉴定以及对新加达原散抑制MASR生物膜耐药机制进一步研究,对临床大数据的MASR临床菌株进行实验与试验研究来完善新加达原饮对MASR生物膜耐药的系统生物学研究。
参考文献
[1]Ana Rita Brochado,Anja Telzerow,Jacob Bobonis,et al.Species-Specific activity of antibacterial drug combinations[J].Nature,2018,559(7713):259-263.
[2]胡付品,郭燕,朱德妹,等.2017年CHINET中国细菌耐药性监测[J].中国感染与化疗杂志,2018,18(3):241-251.
[3]唐强,阮标.细菌生物膜与耳鼻咽喉感染性疾病[J].医学综述,2012,18(9):1289-1292.
[4]徐丽,李蓓.肺炎克雷伯菌生物膜形成机制的研究进展[J].中国病原生物学杂志,2016,11(11):1056-1059.
[5]温绍霞,孙竞.细菌生物膜形成及相关耐药性治疗研究进展[J].海南医学,2014,25(9):1331-1333.
[6]张春雷,李忠新,李瑜珍,等.五味消毒饮联合红霉素对MRSA生物膜作用的初步研究[J].热带医学杂志,2011,11(2):175-177.
[7]刘珏玲,杨伟峰,孙娅楠,等.痰热清注射液对耐甲氧西林金黄色葡萄球菌生物膜三维结构的影响[J].中国病原生物学杂志,2017,12(12):1152-1156.
[8]左雪.清散/清透方对细菌性肺炎患者体温的影响及清透方抗S.a生物膜初探[D].北京:北京中医药大学,2018.
[9]孙凤军,史惠卿,冯伟,等.亚抑菌浓度头孢他啶对大肠埃希菌生物膜形成的影响与其耐药性相关性研究[J].现代生物医学进展,2016,16(20):3839-3844.
[10]邢亚君,杨伟峰,孙娅楠,等.痰热清注射液与亚胺培南西司他丁联合对广泛耐药铜绿假单胞菌的抑菌作用[J].中国实验方剂学杂志,2019,25(11):60-66.

