热打击诱导骨骼肌细胞胀亡而非凋亡
豆春丽,袁芳芳,刘斌,李慧,苏磊,5*
1广州中医药大学研究生院,广州 510006;2中南大学湘雅三医院血液科,长沙 410013;3长沙市第一医院急诊科,长沙 410005;4南部战区总医院重症医学科 广州,510010;5全军热区创伤救治与组织修复重点实验室,广州 510010
重症中暑是以核心体温升高(>40 ℃)、水电解质紊乱及中枢神经系统功能障碍为特征的热性疾病,并伴有全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)和多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)[1-3]。据不完全统计,我国重症中暑病死率为10%~15%,合并MODS时则高达40%,即使存活者也有30%以上遗留神经、骨骼肌等系统的后遗症。本团队前期研究发现,脏器损伤数目及程度与重症中暑的预后密切相关,防治单一器官衰竭进展至MODS,在重症中暑的发生、发展及转归过程中可能起关键作用。既往研究表明,横纹肌溶解(rhabdomyolysis,RM)是重症中暑尤其劳力型重症中暑的常见合并症[4],横纹肌溶解综合征发生后其并发症发生率高达51%,病死率高达32%,但中暑引起RM的具体机制尚不清楚[5]。研究表明,RM因肌细胞损伤及ATP能量代谢障碍致使横纹肌细胞广泛死亡,细胞膜结构的完整性改变引起细胞内容物溢出,引发一系列危及生命的严重并发症。但目前针对重症中暑引起骨骼肌细胞损伤的相关研究较少。细胞胀亡是一种区别于凋亡的、caspase非依赖性的重要的促炎性细胞死亡方式,与急性冠脉综合征、心肌缺血-再灌注损伤及恶性肿瘤等多种疾病密切相关[6-8]。但细胞胀亡是否参与重症中暑RM的发生目前尚不清楚。本研究探讨热应激过程中骨骼肌细胞发生损伤的具体形式,以及重症中暑RM的发生机制,以期为临床救治提供靶点。
1 材料与方法
1.1 主要试剂及仪器 Porimin(G-2)抗体(sc-377295)购自美国Santa公司;CCK-8试剂盒、乳酸脱氢酶(LDH)毒性检测试剂盒、ECL发光液购自碧云天生物技术研究所;Annexin Ⅴ-FITC/PI试剂盒购自贝博公司;GAPDH抗体购自武汉爱博泰克生物科技有限公司;羊抗鼠IgG(H+L)-HRP、羊抗兔IgG(H+L)-HRP购自北京锐抗生物科技有限公司;caspase-3抗体购自美国Cell Signaling Technology公司。普通倒置显微镜(YSK-319)购自日本Olympus公司;多孔板离心机购自杭州瑞诚仪器有限公司;细胞培养箱购自美国Thermo Fisher公司;透射电子显微镜购自日本日立新公司;流式细胞仪购自美国BD公司。
1.2 方法
1.2.1 细胞培养及分组 人骨骼肌细胞株(HSKMC) 购自北纳生物。HSKMC细胞复苏后,1000 r/min离心5 min,弃上清,用高糖DMEM培养液(含10%胎牛血清、10万U/L青霉素、100 mg/L链霉素)重悬,转入6 cm细胞培养皿中,于37 ℃、5% CO2及饱和湿度条件下培养,根据细胞生长情况每2~3 d传代1次,每周传代2或3次。普通倒置显微镜下观察细胞长至对数生长期时进行后续试验,按照不同的处理方式分为对照组与热打击组。
1.2.2 CCK-8法检测细胞活力 取对数生长期细胞,按100 μl/孔(5×104个细胞)的密度接种于96孔板中,待贴壁稳定后,对照组细胞于37 ℃、5% CO2细胞培养箱中孵育;热打击组细胞于43 ℃、5% CO2细胞培养箱中孵育2 h建立热打击细胞损伤模型,然后置于37 ℃、5% CO2细胞培养箱中继续孵育0、6、12、24 h,分别设置5个复孔。复温后,每孔加入10 μl CCK-8溶液,并将培养板置于37 ℃孵箱内孵育2 h。按照CCK-8试剂盒说明书操作,应用酶标仪测定450 nm处各孔吸光度(OD)值,计算细胞活力。
1.2.3 LDH法检测细胞毒性 将适量细胞接种于96孔板中,待细胞长满至80%~90%时进行检测。各组细胞处理结束后,将细胞培养板用多孔板离心机400g离心5 min,吸除上清,加入150 μl LDH释放试剂,混匀,重新置于细胞培养箱中孵育1 h。然后将细胞培养板用多孔板离心机400g离心5 min。取各孔的上清液120 μl,转移到新96孔板相应孔中,分别向各孔中加入60 μl LDH检测工作液,混匀,室温下避光孵育30 min,用酶标仪测定490 nm处各孔OD值,计算细胞毒性。
1.2.4 透射电子显微镜观察细胞超微结构 热打击处理后,在各时间点收集细胞,用2.5%戊二醛固定液固定,4 ℃过夜,送南部战区总医院医学实验科,透射电子显微镜下观察细胞的超微结构。
1.2.5 Annexin Ⅴ-FITC/PI双染色法检测双阳性细胞率 按Annexin Ⅴ-FITC/PI试剂盒说明书步骤操作。热打击处理后,在不同时间点收集细胞,调整待测细胞浓度为1×106个/ml,预冷PBS润洗2次,用400 μl(1×) Annexin Ⅴ结合液重悬细胞,在细胞悬液中加入5 μl Annexin Ⅴ-FITC染色液,轻轻混匀并于4 ℃避光放置15 min,加入10 μl PI轻轻混匀并于4 ℃避光放置5 min,应用流式细胞仪检测(激发波长488 nm,发射波长530 nm)。
1.2.6 Western blotting检测细胞porimin、caspase-3蛋白的表达 取对数生长期细胞(热打击后不同复温时间点及对照组),加入细胞裂解液(RIPA:PMSF=100:1),提取总蛋白,采用BCA法定量总蛋白浓度,然后行SDS聚丙烯酰氨凝胶电泳,将蛋白转移至PVDF膜上,5% BSA室温封闭1 h,洗膜后加入porimin一抗(1:500)、caspase-3一抗(1:1000),4 ℃过夜,TBST洗3 次,5 m in/次,加入二抗(1:10 000)室温孵育1 h,TBST洗3次,5 min/次, 使用化学发光剂ECL显色、曝光。
1.3 统计学处理 采用SPSS 22.0软件进行统计分析。符合正态分布的计量资料以表示,若方差齐,两样本均数比较采用t检验;若方差不齐,两样本均数比较采用t'检验;多样本均数间比较采用单因素方差分析(one-way ANOVA),若方差齐,组间比较采用LSD-t检验;若方差不齐,组间比较采用秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 热打击对HSKMC细胞活力及毒性的影响 CCK-8法检测结果显示,与对照组相比,热打击组复温0h细胞活力即开始下降,且随着时间的延长细胞活力不断下降,呈时间依赖性(P<0.05)。LDH法检测结果显示,与对照组相比,热打击组复温0h细胞毒性即增强,且随着时间的延长细胞毒性不断增强,呈时间依赖性(P<0.05,图1)。
2.2 热打击后HSKMC细胞超微结构的变化情况 透射电子显微镜观察结果显示,对照组细胞表面具有丰富的微绒毛,线粒体、内质网等细胞器结构清晰,核大浓染,形态不规则,染色质浓密,核仁大而清晰。热打击组细胞在复温早期(0、6 h)表现为细胞肿胀、体积变大,胞质空泡化(有别于凋亡早期的细胞皱缩、胞质浓缩及出芽改变),线粒体明显肿胀,脱颗粒,双嵴消失,核周间隙增宽,细胞核凝聚、固缩,部分包膜连续性中断,符合胀亡早期表现;复温晚期(12、24 h)表现为核仁溶解消失,细胞核碎裂、染色质边集,胞质结构崩解呈颗粒状,符合胀亡晚期表现,即胀亡样坏死(图2)。
2.3 热打击对HSKMC细胞双阳性细胞率的影响 Annexin Ⅴ-FITC/PI双染色法检测结果显示,与对照组相比,热打击组双阳性细胞率呈进行性增高趋势(P<0.05,图3)。
2.4 热打击对HSKMC细胞中porimin、caspase-3蛋白表达的影响 Western blotting检测结果显示,随着复温时间的延长,porimin蛋白表达呈增强趋势,至复温12 h时,表达最强(P<0.05)。与对照组相比,caspase-3蛋白表达无明显剪切活化(P>0.05,图4)。
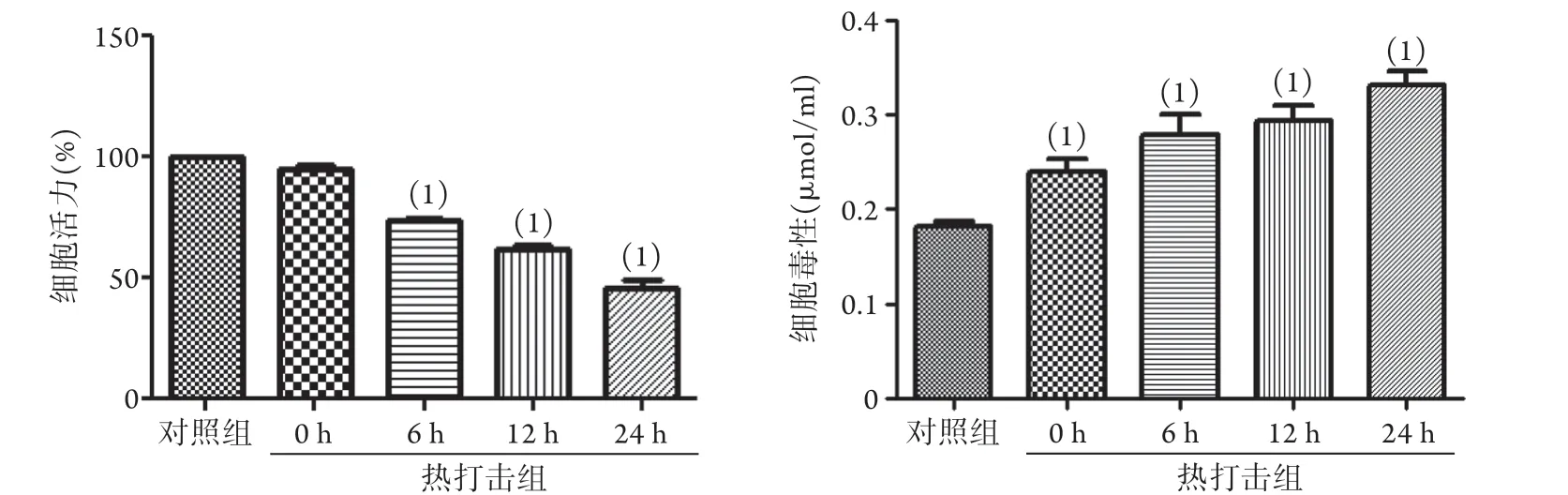
图1 热打击后不同复温时间点HSKMC细胞活力及毒性的变化情况(n=3)Fig.1 Changes in HSKMCs viability and toxicity at different rewarming time points after heat stroke(n=3)
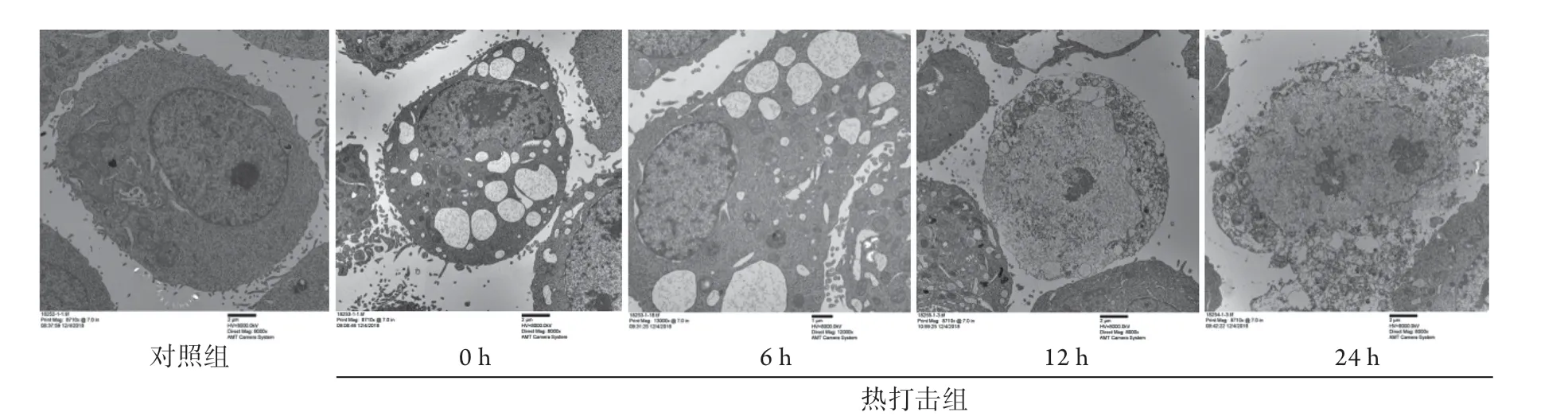
图2 热打击后HSKMC细胞超微结构的变化情况(×8000)Fig.2 Changes of ultrastructure of HSKMCs after heatstroke(×8000)
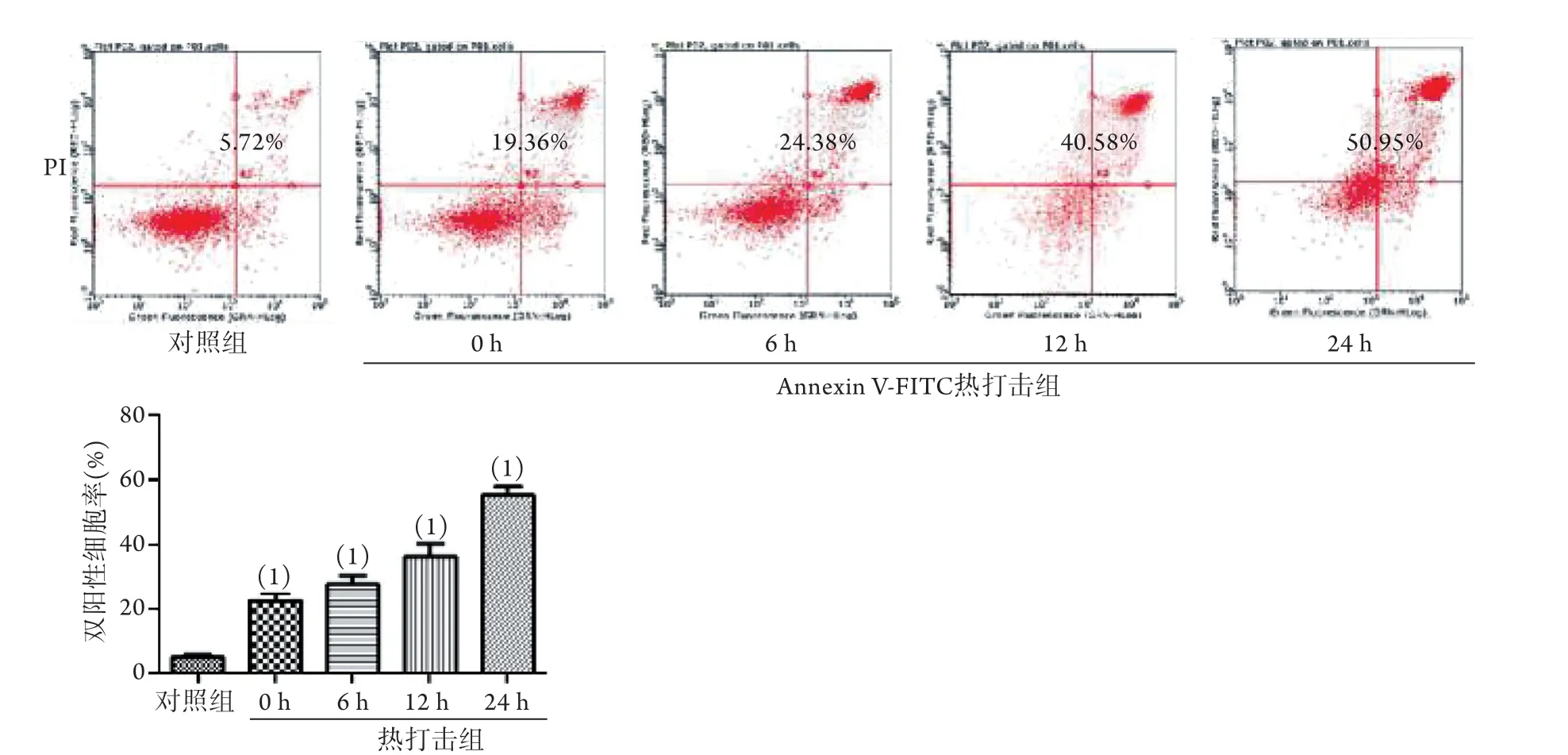
图3 热打击对不同复温时间点HSKMC细胞双阳性细胞率的影响Fig.3 The double positive cell rate in HSKMCs at different rewarming points after heat stroke
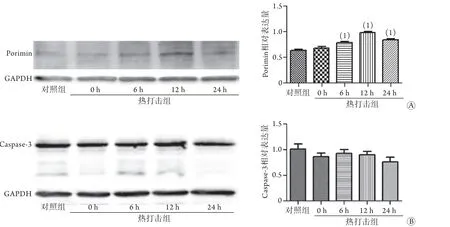
图4 热打击后不同复温时间点HSKMC细胞中porimin (A)、caspase-3蛋白(B)的表达Fig.4 Expression of porimin (A) and caspase-3 protein (B) in HSKMCs at different rewarming time points after heat stroke
3 讨 论
重症中暑是一种高发病率和高致死率的疾病[9], 且合并MODS时病死率高达40%,RM是重症中暑常见的并发症[3]。重症中暑骨骼肌损伤时,骨骼肌细胞的死亡方式尚未见报道。细胞胀亡是一种非典型的程序性细胞死亡方式,与线粒体功能障碍及胞内ATP迅速减少有关,是近年来的研究热点[6-7,10]。因此,本研究探讨热应激过程中骨骼肌细胞发生损伤的具体形式,建立HSKMC细胞重症中暑模型并检测细胞活力及毒性,结果发现,热打击可导致HSKMC细胞损伤。
细胞超微结构的变化是判断细胞死亡方式的一项重要标准,也是判断胀亡的有效方法。本研究采用透射电子显微镜观察细胞的超微结构,结果显示,对照组细胞表面具有丰富的微绒毛,线粒体、内质网等细胞器结构清晰,核大浓染,形态不规则,染色质浓密,核仁大而清晰,热打击组细胞在复温早期(0、6 h)表现为细胞肿胀、体积变大,胞质空泡化(有别于凋亡早期的细胞皱缩、胞质浓缩及出芽改变),线粒体明显肿胀,脱颗粒,双嵴消失,核周间隙增宽,细胞核凝聚、固缩,部分包膜连续性中断,符合胀亡早期表现;复温晚期(12、24 h)表现为核仁溶解消失,细胞核碎裂、染色质边集,胞质结构崩解呈颗粒状,符合胀亡晚期表现(即胀亡样坏死)。上述特征与细胞胀亡的形态学特征一致[11]。此外,通过流式细胞仪检测PI与Annexin Ⅴ-FITC的结合情况,也可判断细胞是否发生胀亡[12]。胀亡细胞可以与Annexin-Ⅴ、PI结合,呈现红色和绿色荧光[Annexin-Ⅴ(+)、PI(+)],即“双阳性细胞”。本研究发现,热打击可导致HSKMC细胞出现双阳性细胞,且呈时间依赖性。Caspase-3可启动细胞凋亡[13],本研究发现,与对照组比较,热打击后HSKMC细胞中caspase-3蛋白无明显变化,表明热打击后骨骼肌细胞并未发生凋亡。Moinfar等[14]成功克隆并初步证实porimin特异性地表达于将要发生胀亡的细胞表面。Porimin是介导细胞胀亡的特异性蛋白,本研究发现,与对照组相比,热打击导致HSKMC细胞中porimin蛋白的表达增强,并呈时间依赖性。
综上所述,本研究结果表明,热打击诱导HSKMC细胞发生了一种有别于细胞凋亡的caspase非依赖性细胞死亡方式——胀亡。

