生物强化修复合成辣椒素对序批式反应器的影响
徐文倩,叶姜瑜
(重庆大学环境与生态学院,重庆400044)
合成辣椒素又名壬酸香草基胺,具有强烈的抗菌活性〔1〕、抗氧化特性〔2〕,属于辣椒素类物质的一种,广泛存在于天然辣椒果实及辣椒加工产品中。我国是世界上最大的辣椒生产国和消费国,全国鲜椒及干椒产量在2016年已超过1 800万t〔3〕,但生产和加工技术不够成熟,尤其在制造辣椒酱料、泡椒、麻辣牛油火锅底料、辣味食品等加工过程中会产生大量辛辣废水。然而,目前鲜有关于辣椒素或辣椒素类物质对污水处理效果影响的研究。少有的涉及辛辣废水的研究主要着眼于处理工艺的探讨〔4〕,其主要关注的是辛辣废水中的油脂和盐,仅将合成辣椒素视为常规有机污染物。类似的情况也发生在大蒜加工废水的处理中。已有多项研究表明大蒜加工废水因为富含具有强烈杀菌作用的大蒜素,可抑制活性污泥中微生物的生长,使用生化法处理大蒜加工废水常难以达标〔5〕。考虑到合成辣椒素也具有强烈的杀菌特性,进行合成辣椒素冲击下污水生化处理系统稳定性研究是有必要的。针对合成辣椒素在废水处理领域的研究空白,本研究从生化反应器处理污染物效率和活性污泥的微生物群落两方面探讨了合成辣椒素对序批式反应器(SBR)的冲击,并采用间歇性投加降解合成辣椒素的复合菌剂进行生物强化,修复了合成辣椒素对SBR的负面影响,以期为含合成辣椒素废水的生化处理提供参考。
1 材料与方法
1.1 实验材料
合成辣椒素(药用级,纯度99%以上),购自邹祥生物科技(中国)有限公司。本实验采用人工模拟废水,成分包括:葡萄糖36 g/L,蛋白胨4 g/L,NH4Cl 14 g/L,淀粉8.57 g/L,KH2PO41.6 g/L,16.7 mL/L微量元素溶液。微量元素溶液的组成(g/L):Fe2(SO4)35,CaCl28,Na2MoO42.6,ZnSO41.03,MgSO423.6,CoCl20.47,MnSO41.08。所有化学品均为分析级,购自中国国药控股有限公司。启动SBR反应器的活性污泥来自于重庆某污水处理厂氧化沟的浓缩活性污泥。
本实验所使用的复合菌剂FJ由3株降解合成辣椒素的功能菌组成,均筛选自100 mg/L合成辣椒素驯化1周后的活性污泥,具体为Serratia marcescens subsp.marcescens Cap B(GenBank登记号MN508465),Serratia marcescens JK(GenBank登记号MN788631),和Lactobacillus plantarum subsp.plantarum Cap Z(GenBank登记号MN508467)。其中Cap Z属于植物乳杆菌属,植物乳杆菌可生物降解辣椒素及辣椒素类物质,被广泛应用于发酵辣椒及制作辣椒酱〔6〕。Cap B与JK同属沙雷氏菌属,目前尚未有沙雷氏菌属能降解辣椒素或辣椒素类物质的报道。此外,这3株菌均具有生物安全性,不用担心对环境的二次污染。将Cap B与JK分别接种在LB培养基中,于转速150 r/min,30℃摇床中培养9 h,Cap Z于MRS培养基中37℃静置培养10 h后得到3种细菌的种子液。再将所得种子液于5 000 r/min离心8 min后,弃去上清液,并用0.85%的无菌生理盐水反复清洗3次以除去菌体中残留的培养液,最后用无菌生理盐水调节菌悬液的OD600在1.0左右。将3种菌悬液等体积混合后,按体积分数5%的比例向加菌组FJ中投加,每隔15 d投加1次。
1.2 SBR反应器的运行
本实验搭建了3组SBR反应器,分别标记为Con组(对照组)、Cap组(合成辣椒素组)、FJ组(生物强化组)。3组反应器之间有两个不同之处:Cap组和FJ组每日分别在进水中添加100 mg/L合成辣椒素-甲醇溶液,而Con组只添加等量的甲醇溶液;FJ组每15 d添加5%的复合菌剂FJ。各反应器的有效容积为400 mL,进出水量为有效容积的一半,MLSS控制在4.0 g/L,溶解氧维持在1.5~3 mg/L,温度为(27±0.5)℃。SBR反应器一天进行4个循环,每个循环6 h,其中进水0.3 h,曝气4 h,静置沉淀1.5 h,排水0.1 h。
1.3 样品采集与测定
每2 d及试验第5天使用无菌离心管采集进出水样50 mL,经0.45μm聚醚砜(PES)膜过滤后取滤液测定NH4+、TN、TP、COD,测定方法均参考文献〔7〕。在试验第5天、第20天、第40天分别于第一个循环的同一曝气阶段用无菌离心管收集各组的泥水混合样,一式三份,并于5 000 r/min离心8 min后弃去上清液以得到活性污泥样品。将活性污泥样品储存在-80℃,用干冰运输至上海美吉生物医药科技有限公司,在Illumina MiSeq PE300平台进行高通量测序。该研究原始测序数据储存在NCBI SRA数据库,登记号为SRR10153486~SRR10153494。样品DNA的提取及PCR扩增参考文献〔8〕的方法,使用引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')扩增样品的16S rRNA基因的V3-V4高变区。
1.4 数据分析
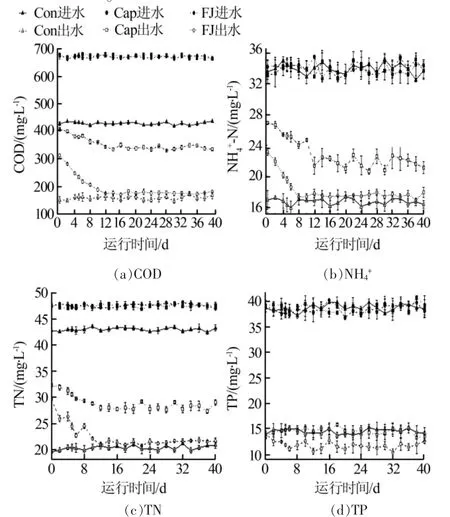
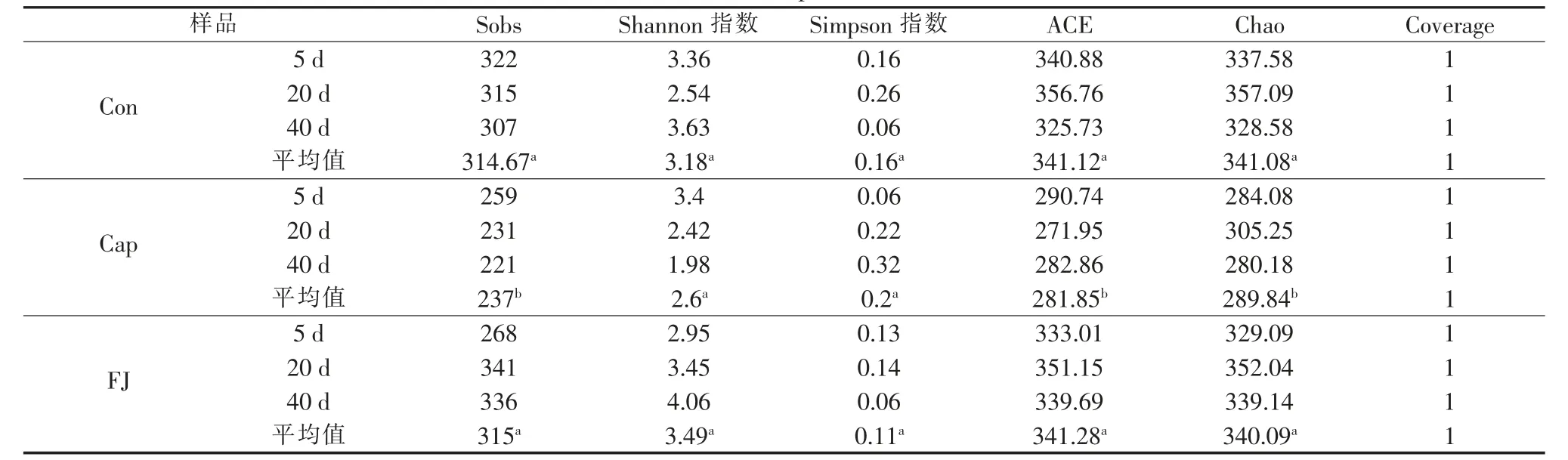
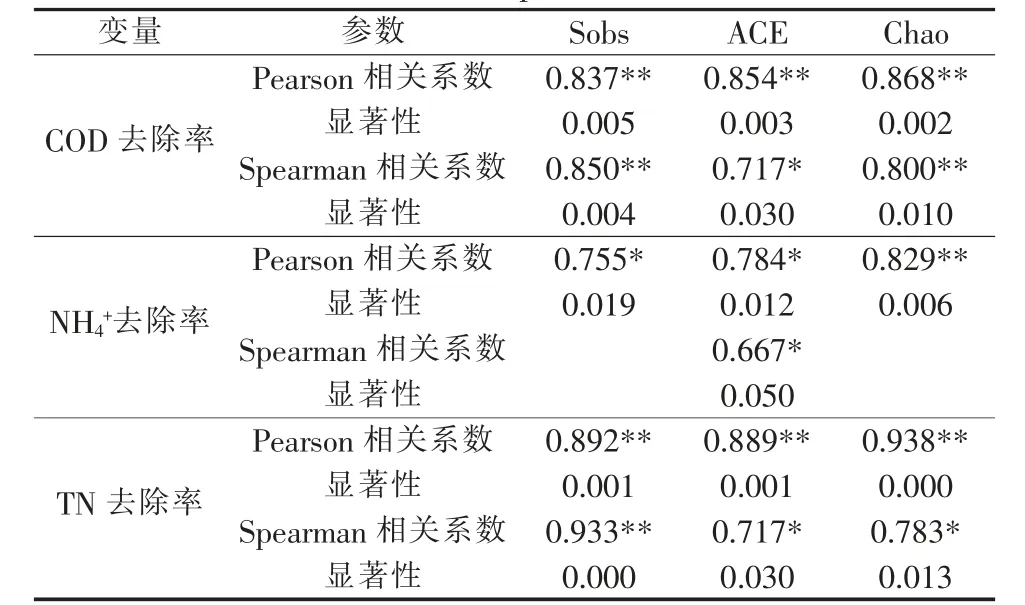
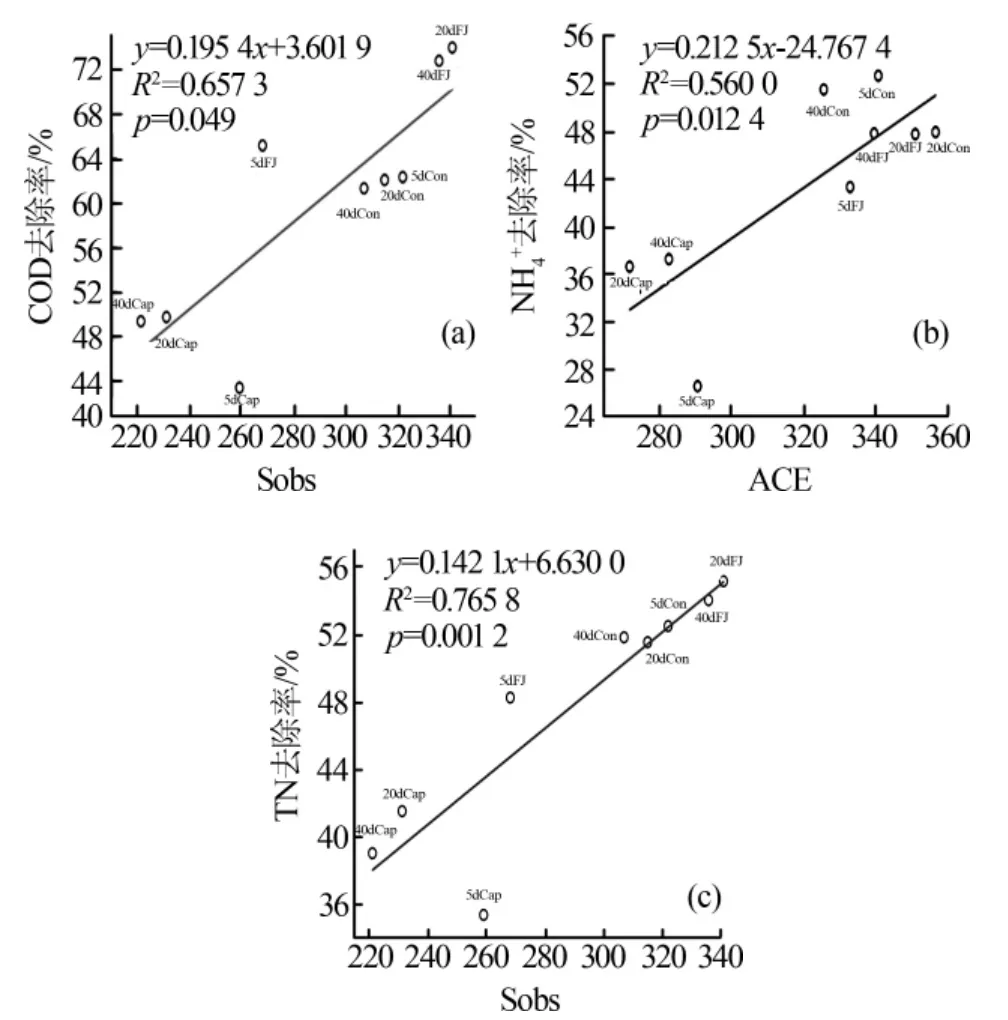
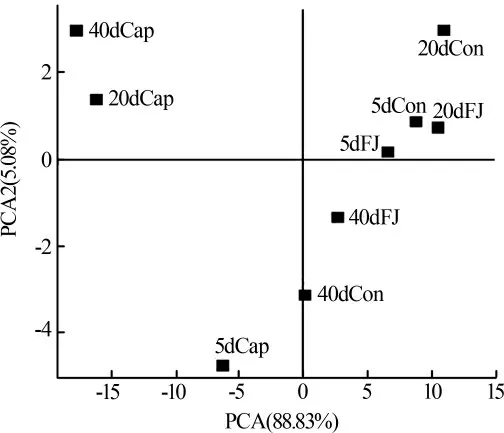
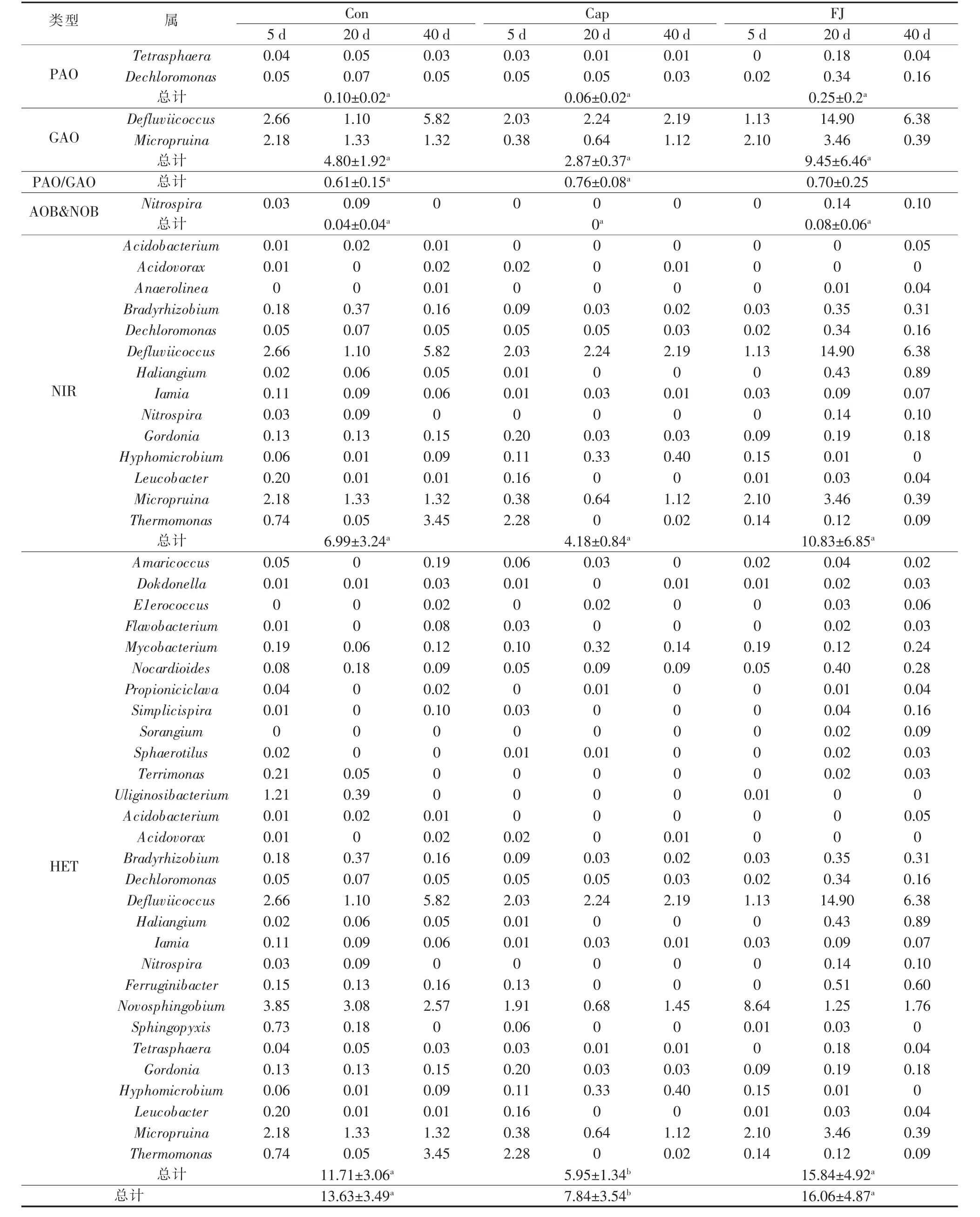
为排除测序深度不同带来的误差,将所有样本的高通量测序结果按最小的序列数量抽平后,再采用最小序列数对其他样品进行随机取样,形成新的子样品,通过I-Sanger云平台进行多样性分析、样本比较分析、物种组成分析、物种差异分析以及功能预测分析等。使用IBM SPSS Statistics 25与Origin 2018进行显著性分析,相关性分析与线性回归分析等。其中显著性分析结果含义:0.01 3组反应器对污染物COD、NH4+、TN、TP的去除效果见图1。 图1 不同反应器污染物处理效果 运行12 d后,Cap组和FJ组SBR性能稳定。试验期间,Cap组的COD、TN、NH4+的平均去除率均显著低于其他两组(P<0.05),但TP的平均去除率受影响较小(P>0.05)。复合菌剂FJ的投加对进水水质没有影响,而合成辣椒素的引入会增加进水COD和TN。所以,FJ组COD和TN的去除率高于Con组的原因可能是进水COD和TN较高。与Cap组相比,FJ组显著提高了SBR系统对于合成辣椒素废水的处理能力。 2.2.1 群落多样性 所有样品按最小序列数35259抽平后进行进一步的分析。活性污泥微生物群落的Alpha多样性指数见表1。 表1 不同样本的Alpha多样性指数表 用ANOVA方法对组间显著性差异进行检验。结果表明群落丰富度(Sobs、ACE、Chao)在Con、Cap、FJ组间差异显著,而群落多样性(Shannon指数、Simpson指数)差异不显著。总之,Cap组的群落丰富度和多样性指数最低,而FJ组的多样性指数最高。所有样本的覆盖度均大于0.99,说明测序深度足以覆盖大部分微生物,甚至包括部分珍稀物种。 为揭示群落Alpha多样性与污染物去除率之间的相关性,使用SPSS 23.0.2进行了基于Pearson和Spearman相关性的线性回归分析,显著相关(P<0.05)的结果见表2。 表2 污染物去除率与Alpha多样性的相关性分析 Sobs、ACE和Chao指数均反应群落丰富度,因此仅选择了与每个变量最显著相关的多样性指数进行线性回归分析,结果见图2。结果表明,COD、NH4+、TN的去除率与群落丰富度呈显著正相关(R2>0.5,P<0.05),微生物群落的丰富度可能对SBR反应器的性能起重要作用。 图2 污染物去除率与群落丰富度的线性回归图 Cap组在100 mg/L的合成辣椒素的作用下,SBR系统中活性污泥的微生物群落丰富度显著降低,群落多样性略低,某些重要的利于降解污染物的功能属可能减少甚至消亡。但是Cap组的一些物种的减少并没有使群落丧失对污染物的去除功能,而是表现为群落整体对污染物去除能力的下降。有研究指出微生物群落功能冗余性的存在保证了整体的群落功能不会轻易丧失,但群落功能的强弱可能会随着环境及反应器运行条件而有所波动〔9〕。加入复合菌剂FJ后,活性污泥的群落丰富度得到逐步恢复,进而逐渐提高了COD、NH4+、TN的污染物去除率。复合菌剂FJ由降解合成辣椒素的功能菌株构成,其修复的关键可能在于通过缓解合成辣椒素的作用,恢复了系统内活性污泥的种群丰富度。 2.2.2 群落组成 该研究中,FJ组与Con组的活性污泥的微生物群落组成相似,而与Cap组差异较大。进一步地,基于MIDAS活性污泥的微生物数据库〔11〕,将样品中活性污泥的功能属分为不同的类型,见表3。尽管只有HET(好氧异养细菌)的累计相对丰度和在3组中有显著差异(P<0.05),但Cap组其他的功能属PAO(磷酸盐积累菌)、GAO(糖原积累菌)、AOB(氨氧化菌)、NOB(亚硝酸盐氧化菌)、NIR(亚硝酸盐还原菌)的减少,可能也是Cap组污染物去除率有限的原因。此外,在FJ组与Cap组中,PAO/GAO的相对丰度比均随实验时间逐渐增加,合成辣椒素的添加可能更利于PAO的增殖,而不是GAO。 Cap组的功能菌群相对丰度是最低的,并且缺少一些其他两组均存在的重要功能菌属如Acidobacterium、Anaerolinea、Flavobacterium、Ferruginibacter、Propioniciclava、Simplicispira、Sorangium、Sphaerotilus、Sphingopyxis、Leucobacter、Terrimonas、Uliginosibacterium、Haliangium,还有Nitrospira。Cap组去污能力的降低一方面可能是因为某些重要的功能菌群的消亡,即表现为种群丰富度的减少(图3),另一方面是因为剩下的功能菌群种群数量上的减少。有研究表明长期的外界扰动可干扰微生物群落原有的稳定性,并提高群落转移到替代稳定状态的可能性〔10〕。亦有研究发现,一旦微生物群落进入替代稳定状态,群落将难以恢复到以前的组成或功能〔12〕。替代稳定状态的存在有助于解释长期受合成辣椒素扰动下,Cap组群落组成与其他两组差异较大的现象。后续研究可利用宏基因组学检测中微生物群落时空动态变化,更深入揭示在长期合成辣椒素扰动下,活性污泥微生物群落的替代稳定状态及微生物之间的相互作用。 复合菌剂FJ的使用恢复了功能菌群的种类及数量,从而提高了合成辣椒素冲击下反应器的污染物去除效果。鉴于高通量取样时间是每次添加复合菌剂FJ后的第5天及第10天,此时复合菌剂FJ中的菌株在属水平上的累计相对丰度和均小于0.1%。这说明复合菌剂FJ可能并不是通过持续地大量定殖于反应器中的方式来起作用的。有研究表明,当微生物菌剂定殖失败时,生物强化仍然是有效的,因为外来菌剂的使用可改变微环境,从而引发功能菌群的大量增殖〔13〕。在合成辣椒素的长期扰动下,复合菌剂FJ的投加可能在短时间内就与合成辣椒素进行了降解反应,逐步改善了污染物降解功能菌的生存机会及条件,从微生物群落组成的角度恢复了群落原有的稳定状态。 2.2.3 功能预测 按参考文献〔14〕所述,使用PICRUSt及KEGG数据库对样品进行功能预测,根据结果用STAMP筛选3组中显著不同的代谢途径及KO,结果发现在KEGG Level 3上3组中存在着显著不同(P<0.05)的代谢途径,其相对丰度总和达64.31%~66.75%。针对这些显著不同的代谢途径,进行了主成分分析(PCA),结果见图3。 图3 KEGG Level 3上显著不同的功能代谢主成分分析图 图3结果显示,合成辣椒素的添加可显著改变活性污泥的功能特性,而复合菌剂FJ的使用能恢复这些功能特性(图3),即表现为FJ组与Con组高度相似的代谢模式。具体而言,在合成辣椒素的作用下增强的代谢途径包含应对环境压力的代谢途径,比如基因信息处理相关的代谢中涉及DNA复制、修复、翻译的代谢等,这说明微生物的自我保护机制〔15〕被激活。而在合成辣椒素的作用下受到显著抑制的代谢途径包含多个涉及有机污染物降解的代谢及能量代谢,比如碳水化合物(Carbohydrate metabolism)、氨基酸代谢(Amino acid metabolism)、淀粉和蔗糖代谢(Starch and sucrose metabolism)、氨基糖和核苷酸糖代谢(Amino sugar and nucleotide sugar metabolism)、原核生物中的固碳途径(Carbon fixation pathways in prokaryotes)、柠檬酸循环(Citrate cycle)等,从而导致Cap组的活性污泥功能酶活较低且污染物去除率的降低。此外,与脱氮性能有关的KO中,Cap组中与反硝化有关KO的相对丰度(包括K00370,K00371和K00374),还有与亚硝酸盐减少有关K00366的相对丰度均显著(P<0.05)低于其他两组。这是Cap组反硝化和同化的亚硝酸盐还原功能被削弱的证据。预测的微生物功能的结果从功能酶活及群落功能代谢的角度在一定程度上解释了不同组之间反应器性能差异的原因。Cap组在功能代谢上与其他两组的显著不同支持上文Cap组的微生物群落进入了一个新的替代稳定状态的猜想。复合菌剂FJ可能通过降解合成辣椒素为功能菌属提供了适宜的微环境,恢复了群落组成及多样性,进而改善了群落功能。值得注意的是,虽然PICRUST的KEGG预测准确率在活性污泥的微生物群落中达80%〔14〕,但仍存在误差。后续的研究应进一步引入对活性污泥功能基因以及相关功能酶活性的检验加以验证。 表3 不同组功能菌群的相对丰度及分类表% 研究发现在100 mg/L合成辣椒素的冲击下,活性污泥微生物的群落丰富度显著减少,以及群落组成明显改变,相应地群落功能从利于污染物降解的代谢模式显著改变为应对环境压力的代谢模式,最终造成了SBR反应器的污染物处理效率显著降低。FJ组和Con组相似的群落组成、功能代谢以及污染物去除率表明复合菌剂FJ的使用有助于维持微生物群落原有的稳定状态,这可能是复合菌剂FJ通过降解合成辣椒素和改善微环境,逐步恢复了对合成辣椒素扰动敏感的功能菌群的种类与含量,进而恢复了群落的功能来实现的。总的来说,该研究为合成辣椒素对污水生化反应器的冲击首次提供了量化的参考,并提出了一个有效的利用复合菌剂进行生物强化修复的方法。2 结果与讨论
2.1 SBR的运行性能
2.2 微生物群落分析
3 结论

