Sm3+掺杂TiO2锂离子电池负极材料的制备及其性能
殷立雄, 白培杰, 霍京浩, 韩 浪, 李书航
(陕西科技大学 材料科学与工程学院 陕西省无机材料绿色制备与功能化重点实验室, 陕西 西安 710021)
0 引言
随着人类社会不断进步和经济的飞速发展,煤、石油、天然气等不可再生能源日渐枯竭,随之而来的生态环境问题也日益加剧,对人类的生存和发展造成了威胁[1,2].因此,开发清洁能源、发展可持续储能技术已变得日趋重要.锂离子电池(Lithium ion batteries,LIBs)由于具有高能量密度、自放电小、无记忆效应、长循环稳定性和相对安全性等优点被广泛应用于便携式电子设备、混合动力汽车等领域[3].
LIBs负极替代材料多种多样,最具代表性的有硅基负极材料、金属氧化物、金属或金属复合物以及过渡金属氮化物等[4].其中,过渡金属氧化物TiO2由于其安全性、低成本、环保性和高稳定性等特点被认为是具有较高研究价值的替代材料之一[5].锐钛矿型TiO2具有边缘高度畸变的TiO6八面体构成的锯齿状链堆积结构,因而成为一种重要的嵌锂主体材料,其主要储锂机理如式(1)所示[6]:
TiO2+xLi++xe-→LixTiO2(0≤x≤1)
(1)
理论上,1 mol TiO2可以嵌入1 mol Li+,理论比容量为336 mAh/g,接近商业化石墨负极材料的理论比容量372 mAh/g[7].然而,TiO2是一种典型的半导体材料,其较低的电导率(~1.9×10-12S/m)以及Li+扩散系数(10-15~10-9m2/s)极大地限制了TiO2电极材料的发展[8-10].
元素掺杂可以改善TiO2的导电性,是解决上述问题的有效方法之一.在TiO2基体中,掺杂各种不同的元素多有报道.2015年,Reddy等[11]将Fe、Zr、V、Mn元素掺入TiO2晶格中,最终发现Zr在TiO2的取代中获得了最佳的性能,60次循环结束后在1.0~2.6 V的电压范围内表现出约160 mAh/g的最佳可逆容量.而采用相同工艺掺杂Sn、Ni/Nb得到了SnO2-TiO2和NiO-Nb2O5-TiO2的复合电极,表现出与TiO2相当的电化学性能,但在长循环中容量衰减较慢.Mechthild等[12]将不同浓度的Sn掺杂到锐钛矿TiO2中,在3~0.05 V的电压范围内Sn掺杂样品的性能优于未掺杂的TiO2.Ti0.85Sn0.15O2在500次充放电循环后保持了240 mAh/g的相对较高的比容量.2020年,Cai等[13]采用溶胶-凝胶煅烧方法制备了N掺杂TiO2锂离子电池负极材料,不仅提供了较短的导电路径和强的电子接触界面,而且还具有大的比表面积,阻碍了纳米颗粒的聚集,使其具有优异的储锂性能.Abhilash等[6]采用溶胶-凝胶法制备了SmxTi1-xO2纳米颗粒,作为LIBs负极材料显示了良好的循环稳定性,Sm0.1Ti0.9O2具有较低的电荷转移电阻,使锂离子移动变得更容易.
本文采用溶剂热法制备Sm3+掺杂TiO2(TiO2∶Sm3+)纳米晶,研究Sm3+对TiO2的组成、形貌及电化学性能的影响.研究发现Sm3+掺杂可提高材料的比表面积,且使TiO2结构变得稳定,在Li+嵌入和脱出过程中减小体积膨胀,提高材料的电化学性能.
1 实验部分
1.1 实验材料
实验中采用的原材料有:六水合硝酸钐(Sm(NO3)3·6H2O,分析纯)、钛酸四正丁酯(C16H36O4Ti,分析纯)、无水乙醇(分析纯)、乙酰丙酮(分析纯).
1.2 TiO2∶Sm3+纳米晶的制备
首先,将15 mL乙酰丙酮加入到55 mL无水乙醇中,在搅拌状态下缓慢滴加2.55 g钛酸四正丁酯,使其完全溶解,得到溶液A;随后,加入一定量的Sm(NO3)3·6H2O至溶液A中,其中Sm/Ti的摩尔比为0.75%,搅拌使其完全溶解,得到溶液B;最后,将溶液B移至100 mL的对位聚苯酚水热内衬中,用不锈钢水热釜密封后在恒温烘箱中200 ℃的温度下反应24 h,待反应结束,将反应釜底部的白色沉淀用无水乙醇反复离心洗涤数次得到产物,并将产物在60 ℃、12 h条件下真空干燥,得到TiO2∶Sm3+.为了对比,同时采用上述方法制备了纯相TiO2.
1.3 材料表征
采用日本Rigaku公司生产的X射线衍射仪(XRD,D/max2200P),采用Cu靶Kα射线(λ=0.154 06 nm),扫描角度范围为20 °~70 °,管电压40 kV,管电流40 mA,扫描速率5 °/min,对样品的晶相组成和物相定性测定.采用场发射扫描电子显微镜(SEM,S-4800)观察样品的微观形貌.通过能量色散光谱(EDS)测试各元素在材料内部的含量及分布情况.采用透射电子显微镜(TEM,Tecnai G2 f20)观察晶体形貌以及进行晶格间距分析.利用美国麦克仪器公司生产的ASAP2460比表面积分析仪(BET)测试氮气等温吸附-脱附曲线,来确定材料的比表面积.
1.4 电化学性能测试
1.4.1 LIBs组装
将所制备的材料作为LIBs负极的活性物质,按活性物质∶乙炔黑∶聚偏氟乙烯(PVDF)为7∶2∶1的质量比进行称量,将上述材料置于洁净的玛瑙研钵中,滴加适量的N-甲基吡咯烷酮(NMP),研磨10~15 min,使混合物成为均匀的浆料状,随后将调好的浆料均匀地涂布在铜箔上,铜箔置于干燥箱中干燥过夜,去除负极材料中的溶剂和水分.使用切片机将干燥后的极片切成直径为16 mm的圆形电极,用分析天平称量该电极片和相同大小的空白铜箔片的质量,并记录相应的数据.其中,每个小电极片上活性物质的质量是该电极片和空白铜箔片质量之差的70%.将上述记录好标号和质量的电极片转移到充满氩气的手套箱中备用.
在真空手套箱(水、氧气含量<0.5 ppm)中以负极壳-弹片-垫片-锂片-隔膜的顺序组装CR-2032型纽扣式LIBs,将制备好的LIBs放置24 h后进行电化学性能测试.
1.4.2 循环伏安(CV)测试
循环伏安曲线可以用来研究电极材料在充放电过程中发生的氧化还原反应和可逆程度,进而可以对充放电程度进行评估.本论文采用上海辰华仪器公司的型号为CHI604的电化学工作站对LIBs进行CV测试,测试电压范围为0.01~3 V,扫速为0.1 mV/S.
1.4.3 倍率性能测试
倍率性能是将不同电流密度下电池的充放电比容量进行对比,以此判断材料能否承受较大的电流密度变化.本文采用深圳市新威新能源技术有限公司的型号为BST-5V/50 mA的多通道电池测试仪对LIBs倍率性能进行测试.在电流密度为0.1 A/g、0.2 A/g、0.5 A/g、1.0 A/g、2.0 A/g和0.1 A/g下对电池进行充放电测试.在充放电循环期间,记录每个电流密度下的充电与放电比容量值,以此判断材料的倍率性能.电压测试范围为0.01~3.0 V,测试温度为室温.
1.4.4 恒流充放电性能测试
充放电性能测试是直观了解电极材料电化学性能好坏的基本测试手段,可以得到所测电极样品的充放电容量及循环稳定性等.纽扣电池的恒流充放电特性同样是在深圳新威BST-5V/50 mA多通道电池测试仪上测试的.电流密度为1 A/g,测试内容包括电压与充放电比容量关系,循环性能及相对应的库伦效率.电压测试范围为0.01~3.0 V,循环周期为100次.
1.4.5 电化学阻抗谱(EIS)测试
EIS即通过测量阻抗随正弦波频率的变化,进而分析电化学反应过程中所产生的各类型的阻抗值,例如欧姆阻抗、电解液阻抗、SEI膜阻抗、电荷转移阻抗等.采用上海辰华CHI604电化学分析仪进行测试,频率范围为0.01~105Hz.
2 结果与讨论
2.1 XRD分析
图1为TiO2和TiO2∶Sm3+纳米晶的XRD图谱.如图1所示,TiO2在25.32 °、37.90 °、48.14 °、53.94 °、55.02 °和62.66 °位置分别观察到明显的衍射峰,所有的衍射峰都与纯锐钛矿相标准卡片(PDF.21-1272)相对应,分别代表(101)、(004)、(200)、(105)、(211)、(204)晶面,峰形尖锐且无其他杂峰,说明本方法成功合成了结晶性良好的锐钛矿相TiO2材料.与纯TiO2相比,TiO2∶Sm3+的XRD图谱并无明显变化,表明Sm3+的掺杂对TiO2晶型结构没有明显影响.
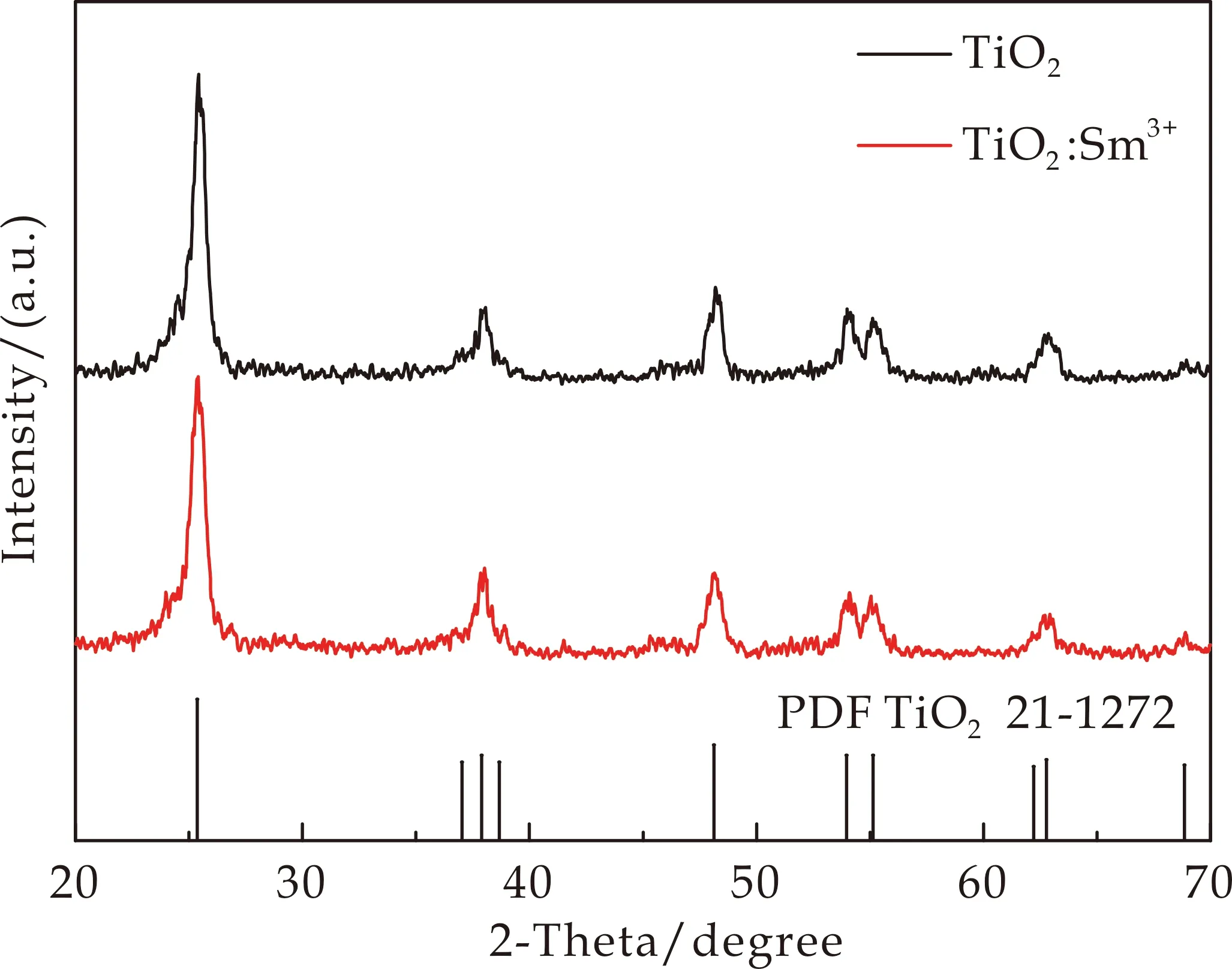
图1 TiO2和TiO2∶Sm3+的XRD图谱
2.2 SEM和TEM分析
图2是本实验制备的TiO2和TiO2∶Sm3+的SEM图.由图2(a)、(b)可以看出,TiO2样品的粒径为10 nm左右,TiO2∶Sm3+样品粒径略小于纯TiO2,约为8 nm.对比分析发现,掺杂前后样品形貌并未发生变化,但Sm3+的引入使TiO2∶Sm3+纳米晶的整体微观形貌趋于完整均一.图3为TiO2∶Sm3+纳米晶的EDS图,从图3中可以看出Ti、O和Sm元素在样品中均匀分布.
为了进一步分析TiO2和TiO2:Sm3+的组成和形貌,采用TEM对其进行表征.如图4(a)所示,TiO2形貌为圆形纳米颗粒,粒径约为10 nm;图4(b)是TiO2纳米晶的HRTEM图,从图中可以看出TiO2样品的晶格条纹间距是0.352 nm,对应于锐钛矿相TiO2(101)晶面的晶面间距;图4(c)显示了TiO2∶Sm3+样品的形貌也是圆形的纳米颗粒,但粒径相较于TiO2样品更小,约为8 nm,这与SEM结果一致;图4(d)显示TiO2∶Sm3+样品的晶格间距出现了0.352 nm和0.363 nm两种,相对于TiO2的(101)晶面间距,0.363 nm明显大于原始间距值,原因是Sm3+的半径较大,进入部分TiO2的晶格中,导致晶格间距变大,这证明了Sm3+成功被掺杂到TiO2的晶格内部[14].
2.3 BET分析
图5为掺杂前后两样品的N2等温吸附-脱附曲线.从图5可以看出,这是一种H4型滞后回线的IV型等温线,TiO2和TiO2∶Sm3+的比表面积分别为77.668 9 m2/g和101.681 8 m2/g.相比之下,掺杂后的TiO2∶Sm3+具有较大的比表面积.

(a)TiO2

(b)TiO2∶Sm3+图2 掺杂前后样品的SEM图


(a)SEM图 (b)Ti (c)O (d)Sm图3 TiO2∶Sm3+样品的元素分布图


(a)、(c)TiO2 (b)、(d)TiO2∶Sm3+图4 掺杂前后样品的TEM和HRTEM图

图5 TiO2和TiO2∶Sm3+的N2等温吸附-脱附曲线
2.4 电化学性能测试
如图6所示为TiO2和TiO2∶Sm3+样品在1 A/g电流密度下100次的循环性能图.从图6可以明显地看出,TiO2∶Sm3+样品的可逆容量高于TiO2样品,100次循环后容量保持在92.8 mAh/g,高于TiO2样品的72.3 mAh/g.且从第二圈充放电后TiO2∶Sm3+样品的库伦效率保持在85%以上.这是由于相对于Ti4+离子,低价的Sm3+稳定了TiO2材料的结构,在Li+嵌入和脱出过程中没有较大的体积膨胀,表现出良好的循环稳定性[6]
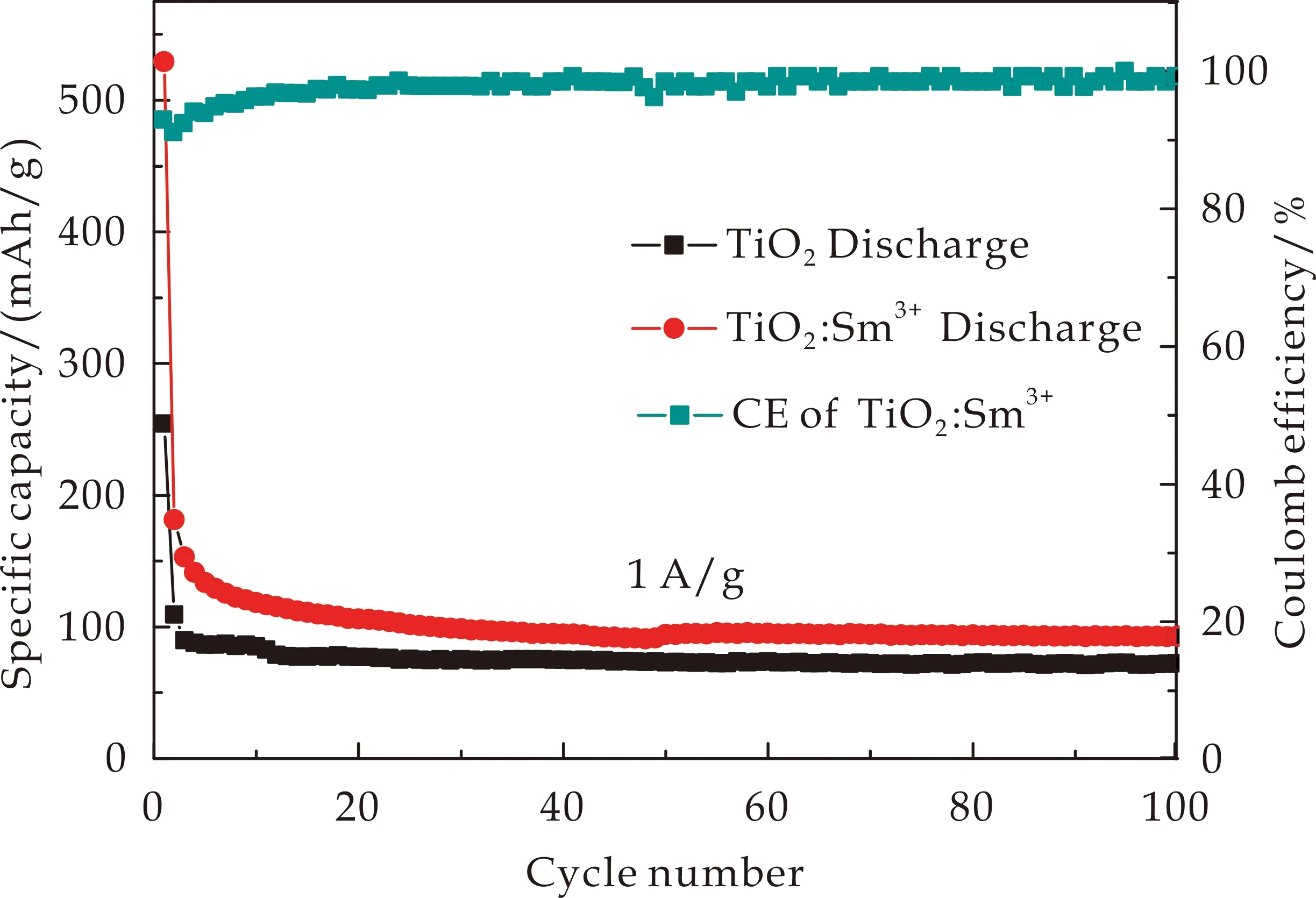
图6 TiO2和TiO2∶Sm3+样品的循环性能图
倍率性能是LIBs实际应用要考虑的另一个重要因素,因此将这两个样品在不同的电流密度下进行倍率性能测试.如图7所示,在0.2 A/g,0.5 A/g,1 A/g,2 A/g的电流密度下,TiO2∶Sm3+样品的可逆容量分别为175.7 mAh/g,125.8 mAh/g,100.1 mAh/g,90.2 mAh/g,恢复到0.1 A/g时放电比容量为198.8 mAh/g,而纯TiO2在上述电流密度下的可逆容量分别为160.7 mAh/g,118.2 mAh/g,90.5 mAh/g,66.5 mAh/g和181.7 mAh/g.在不同电流密度下TiO2∶Sm3+样品可逆容量均高于纯TiO2,主要原因是TiO2∶Sm3+样品具有较大的比表面积,在电极界面上促进电子和离子的转移,有利于电化学反应的进行[13].

图7 TiO2和TiO2∶Sm3+样品的倍率性能图

为了进一步研究Sm3+掺杂对TiO2电极材料的动力学影响,对LIBs进行了EIS测试.如图9所示,TiO2和TiO2∶Sm3+的EIS曲线均由高频区的半圆和低频区的斜线组成的,半圆弧的直径代表电荷转移电阻(Rct)的大小,半圆直径越大则Rct越大.插图是所组装的LIBs等效电路模型,Rs为电解液阻抗,反应了电解液和电极间的导电性能.如表1所示,TiO2∶Sm3+的Rct和Rs均小于TiO2样品,表明TiO2∶Sm3+导电性提高,具有更快的电荷传输特性.
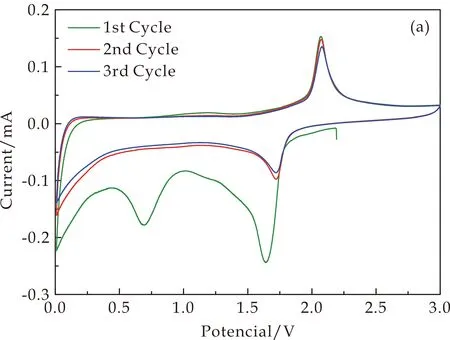
(a)TiO2
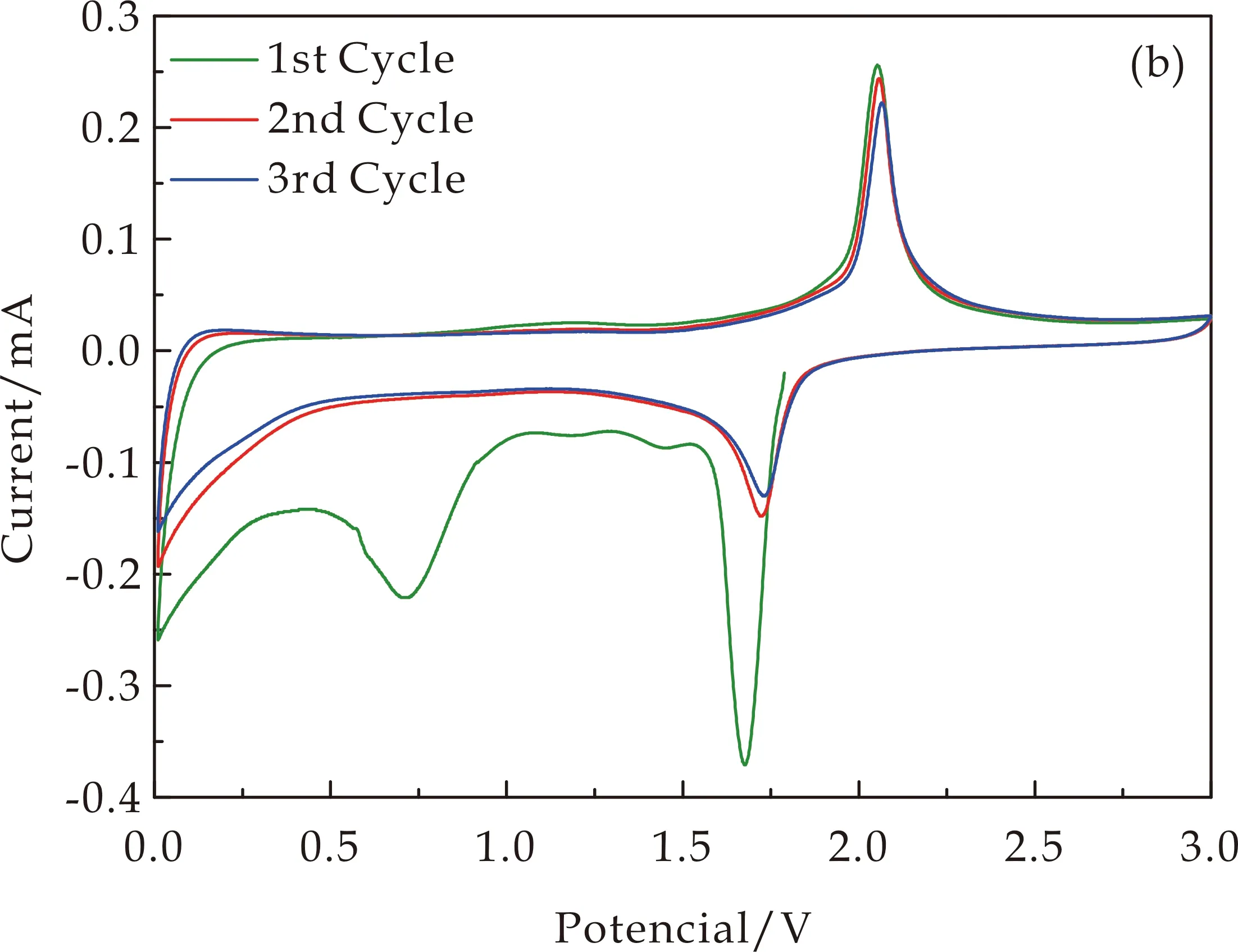
(b)TiO2∶Sm3+
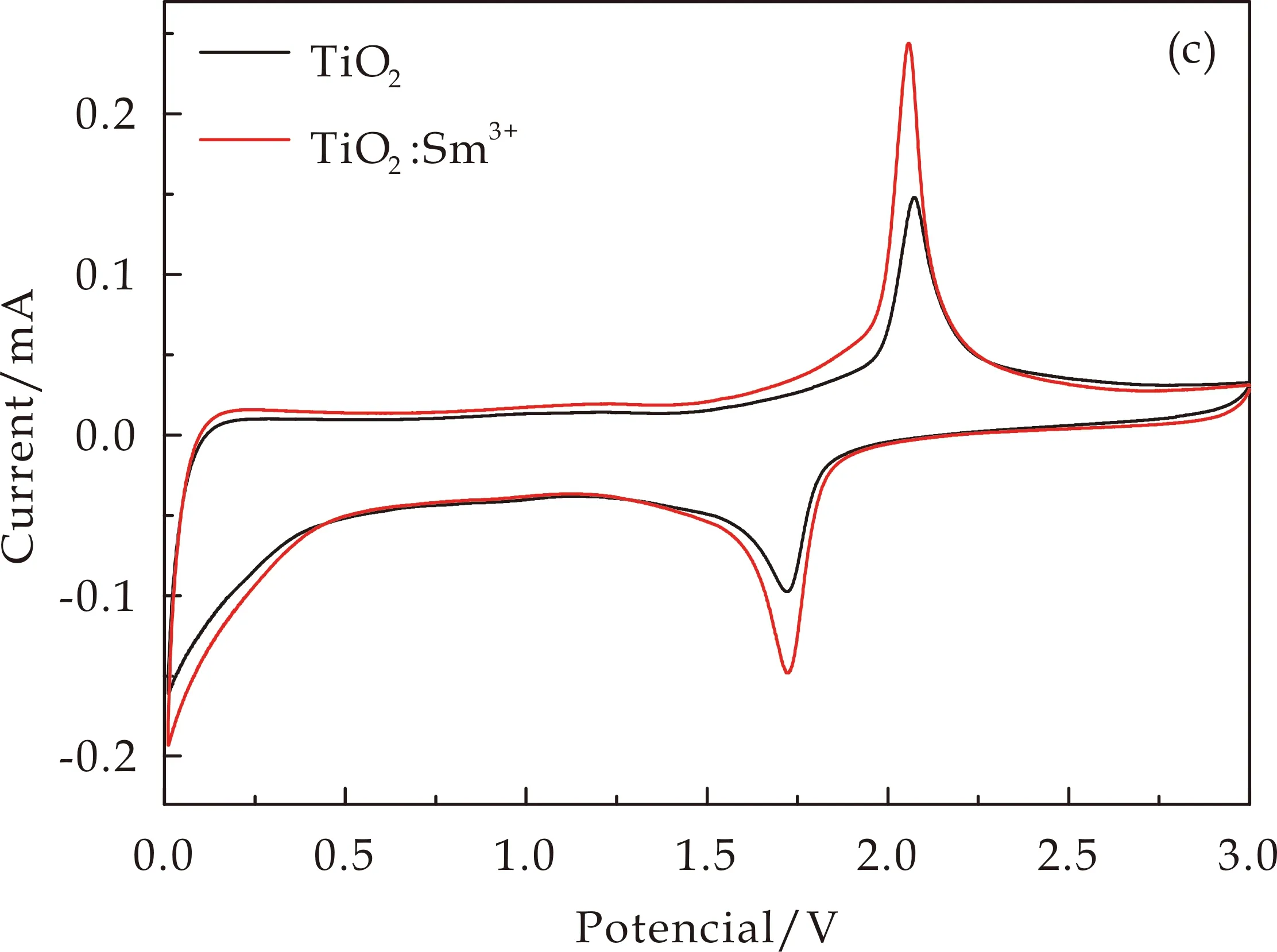
(c)TiO2和TiO2∶Sm3+样品第二圈CV曲线图8 掺杂前后样品的CV曲线
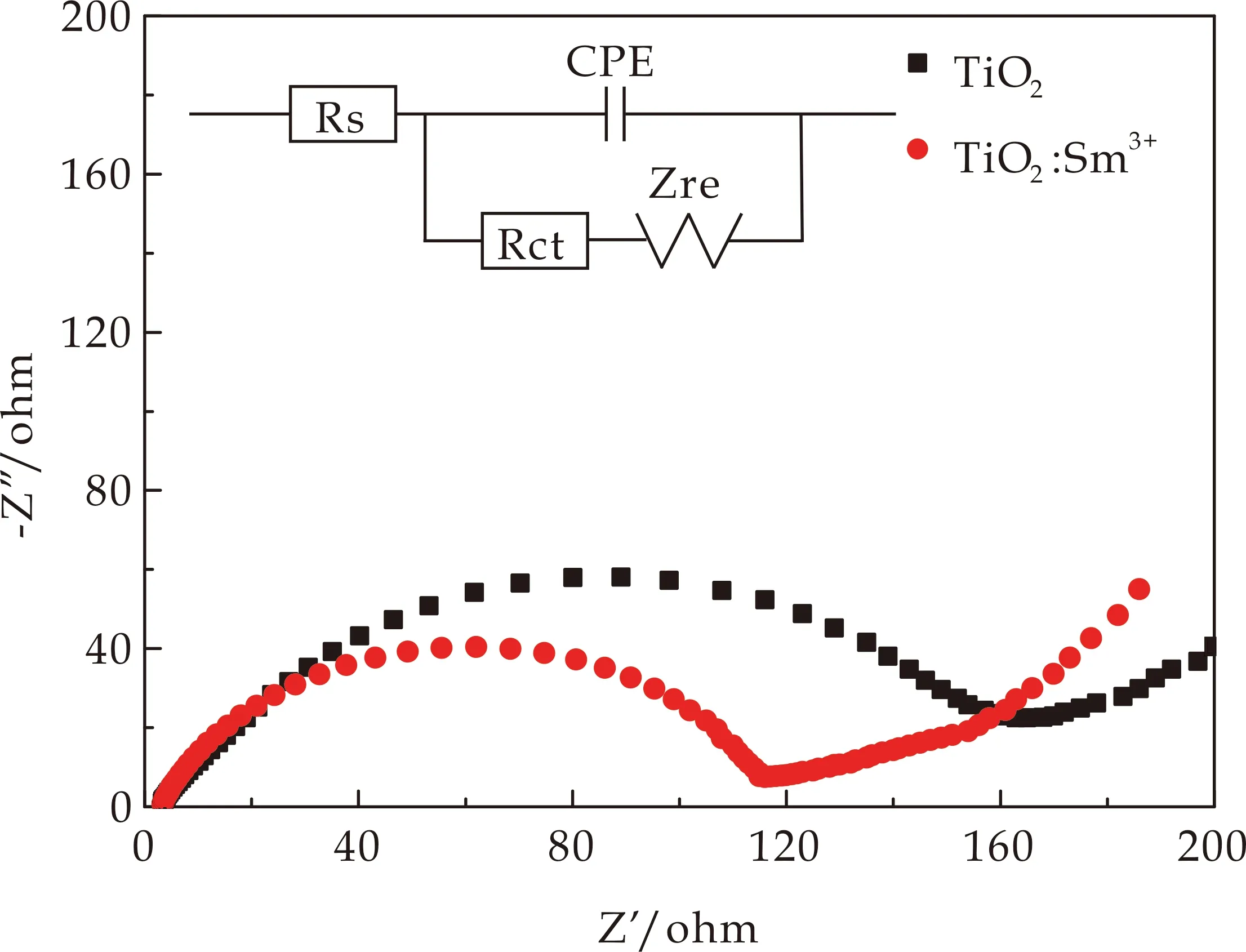
图9 TiO2和TiO2∶Sm3+样品的EIS图谱及等效电路(插图)

表1 TiO2和TiO2∶Sm3+材料的扩散系数
此外,锂离子扩散系数可用来评估锂离子在电极材料中扩散的快慢,由公式(2)得出.
D=R2T2/2A2n4F4C2σ2
(2)
Zre=Rct+Rs+σω-1/2
(3)
式(2)中:R是气体常数(8.314 Jmol-1K-1);T是绝对温度(298 K);A是电极片的表面面积;n是每摩尔电极材料转移的电荷数;F是法拉第常数(96 500 C/mol);C是锂离子的摩尔浓度;σ是Warburg因子,由公式(3)阻抗实部Zre和低频区角频率ω的线性关系计算得出.
根据公式(2)得到TiO2和TiO2∶Sm3+电极的锂离子扩散系数分别为1.4×10-19cm2·s-1和6×10-18cm2·s-1,说明TiO2∶Sm3+材料在电池充放电过程中具有更高的锂离子扩散动力.
3 结论
本文采用溶剂热法成功制备了粒径约为8 nm的TiO2∶Sm3+纳米晶.BET结果显示,掺杂后材料具有大的比表面积.通过电化学测试发现,与纯TiO2相比,TiO2∶Sm3+具有高的放电比容量(529.3 mAh/g),在1 A/g电流密度下循环100圈后容量稳定在92.8 mAh/g,第二圈充放电后库伦效率保持在85%以上,循环稳定性好;电化学阻抗减小,锂离子扩散速度加快.由此说明,Sm3+掺杂可以作为一种改性手段来改善TiO2结构稳定性和电导率低的问题,进而提高锂离子电池的电化学性能.

