高糖胁迫下鲁氏接合酵母细胞膜生理应答机制研究
王虎玄, 代春吉, 孙宏民
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
0 引言
中国是全球苹果种植面积和产量第一大国,也是世界最大的浓缩苹果汁生产加工和出口国.然而,由于各种不安全因子引起的质量安全问题导致中国浓缩苹果汁在国际贸易竞争中面临严峻的挑战.为了消除浓缩苹果汁中各种不安全因子导致的国际贸易受挫,破解因质量安全不达标引起的大规模退货、索赔等难题,进一步促进中国苹果加工产业的健康发展,对中国浓缩苹果汁产业面临的高渗酵母、脂环酸芽孢杆菌、食源性致病菌、农药、展青霉素、富马酸、重金属等质量安全问题进行深入研究并提出切实可行的控制措施,具有重要的意义[1].其中,高渗酵母作为浓缩苹果汁产业中关键质量安全因子,已成为确保果蔬质量安全的必检指标之一,引起相关生产企业和科研工作者的关注[2,3].
由于浓缩果汁中高浓度糖类物质等能够显著增强酵母细胞的高温耐受性,浓缩苹果汁生产企业采用的高温巴氏杀菌技术并不能彻底控制高渗酵母的污染[4,5].此外,浓缩苹果汁采用无菌袋包装,包装袋内存在一定的氧气,贮存和运输温度为常温,而常温及有氧条件都有利于高渗酵母的繁殖和生长[6].作者前期从因质量不达标而被美国大规模退货的陕西某大型果汁加工厂生产的浓缩苹果汁(70 °Brix;pH 3.5)中分离出大量高渗酵母,经鉴定为鲁氏接合酵母(Zygosaccharomycesrouxii),并证实其能够在浓缩苹果汁中生长[5,7].浓缩苹果汁主要基于高糖(70 °Brix)和酸(pH 3.5)的胁迫压力维持其微生物稳定性.作者前期研究发现浓缩苹果汁中高浓度糖是胁迫Z.rouxii生长的主要压力因子[8].为了能够在浓缩苹果汁生产中彻底控制鲁氏接合酵母污染,作者前期参与射频(Radio Frequency,RF)对该菌的杀灭作用研究,结果表明在最优工艺条件下该技术并不能彻底杀灭浓缩苹果汁中的鲁氏接合酵母[9].从根本来看,深入理解Z.rouxii耐受高糖胁迫的分子机制,并在此基础上针对关键耐糖因子设计功能干扰措施以消除菌株耐糖性,是彻底控制浓缩苹果汁生产中该菌污染的有效途径.
细胞膜作为酵母与外界环境接触的屏障,具有维持细胞内环境稳态,确保物质正常运输的功能.外界环境胁迫会改变细胞膜脂质组成,影响膜ATPase活性,引起膜通透性、完整性等生理特性发生变化,从而显著增强菌株耐压性[10],表明酵母细胞膜与酵母耐压性密切相关,那么高糖胁迫下Z.rouxii细胞膜会产生怎样的生理应答以提高菌株耐糖性,目前尚不清楚.
基于此,本研究在前期相关研究基础上,以无碳源YPD培养液为基础培养基,将来源于浓缩苹果汁的鲁氏接合酵母及其标准菌接种于糖浓度分别为2%、40%、70%(w/v)的YPD液体中.观察在不同糖浓度下培养的酵母菌落形态;使用扫描电镜观察酵母细胞的形态,测定细胞大小;测定不同糖浓度培养下菌液相对电导率变化、菌液核酸含量变化以及细胞膜ATPase活力变化;通过以上研究探究高糖胁迫下Z.rouxii细胞膜生理应答特性.研究结果对于建立浓缩苹果汁生产中鲁氏接合酵母污染控制措施具有重要的理论价值.
1 材料与方法
1.1 试验菌株与培养基试剂
1.1.1 试验菌株
鲁氏接合酵母(Zygosaccharomycesrouxii)分离菌株LB,分离于浓缩苹果汁;
鲁氏接合酵母标准菌株ATCC 2623,购买于美国模式培养物集存库(ATCC).
1.1.2 培养基及试剂
YPD培养基:10 g酵母浸粉,20 g蛋白胨,20 g葡萄糖,1 000 mL蒸馏水;如配制固体培养基,加入琼脂 20 g.
2%糖浓度培养基:10 g酵母浸粉,20 g蛋白胨,10 g葡萄糖,10 g果糖,1 000 mL蒸馏水;如配制固体培养基,加入琼脂 20 g.
40%糖浓度培养基:10 g酵母浸粉,20 g蛋白胨,200 g葡萄糖,200 g果糖,1 000 mL蒸馏水;如配制固体培养基,加入琼脂 20 g.
70%糖浓度培养基:10 g酵母浸粉,20 g蛋白胨,350 g葡萄糖,350 g果糖,1 000 mL蒸馏水;如配制固体培养基,加入琼脂 20 g.
生理盐水:氯化钠 9.0 g,少量蒸馏水溶解后补加蒸馏水至1 000 mL.
5%葡萄糖溶液:称取50 g葡萄糖,用蒸馏水定容至1 000 mL;
磷酸缓冲液(pH=7.4):甲液(0.2 M NaH2PO4·H2O):称取2.76 g磷酸二氢钠溶于蒸馏水,稀释定容至100 mL.乙液(0.2 M Na2HPO4·H2O):称取5.36 g磷酸氢二钠溶于蒸馏水,稀释定容至100 mL.取A液19.00 mL,B液81.00 mL混合,测定混合液pH.
磷酸缓冲液(pH=7.2):甲液(0.05 M Na2HPO4):称取7.099 g磷酸氢二钠溶于蒸馏水,稀释定容至1 000 mL.乙液(0.05 M KH2PO4):称取6.803 g磷酸二氢钾溶于蒸馏水,稀释定容至1 000 mL.取甲液70.50 mL,乙液29.50 mL混合,测定混合液pH.
ATPase试剂盒购买自南京建成生物工程研究所.
以上试剂均为国产分析纯.
1.2 主要仪器与设备
本研究所用主要仪器与设备如表1所示.

表1 主要仪器与设备
1.3 试验方法
1.3.1 试验菌株活化
将冻存于-30 ℃的鲁氏接合酵母LB和ATCC 2623常温解冻后接种到YPD液体培养基,28 ℃下摇床(120 rpm)培养48 h.重复上述步骤再次培养活化.各吸取1 mL菌液梯度稀释后,取合适浓度菌液200μL接种到YPD固体培养基上,并用涂布棒将菌液涂布均匀, 28 ℃培养48~60 h.定期观察菌株生长情况,菌落是否清晰,是否有杂菌污染等.挑取符合要求单菌落,接种于YPD斜面培养基,28 ℃培养48~60 h后于4 ℃条件下保存,备用.
1.3.2 高糖胁迫下菌落形态观察
将鲁氏接合酵母ATCC 2623和LB分别接种在2%、40%和70%糖浓度的固体培养基中,28 ℃培养72~96 h.观察不同糖浓度下菌株菌落形态,并进行拍照.
1.3.3 高糖胁迫下细胞表面形态观察及细胞大小测定
采用场发射环境扫描电子显微镜(SEM)观察高糖胁迫下鲁氏接合酵母细胞表面形态变化.试验菌株分别在2%、40% 和70%(w/v)糖浓度条件下培至稳定期,离心(5 000 × g,10 min) 收集菌株细胞,去离子水冲洗后重悬于2.5%戊二醛溶液中过夜固定.离心(5 000 × g,10 min) 收集细胞,重悬于磷酸缓冲液(pH 7.2)洗涤后收集细胞,重复洗涤三次.分别用浓度为30%、50%、70%、80%、90%、95%和100%(v/v)的乙醇溶液对菌株细胞进行梯度脱水处理,脱水时间30 min,为充分脱水需进行涡旋混匀.脱水后离心(6 000 × g,10 min) 收集细胞.采用CO2临界点干燥法处理菌株细胞后进行喷金,然后通过SEM来观察细胞形态并进行细胞大小的测定.在显微镜视野,从每个菌株细胞样本中任意选取15个不同的视野进行观察.在每个选定的视野中任意选取5~10个细胞进行测定.
利用扫描电镜中的测量工具对酵母细胞的长度(l)、宽度(w)数据进行测量.在测量时,根据酵母细胞的特点将酵母细胞的形状看成一个椭圆球体.并测得细胞的长轴(a=l/2)、短轴(b=w/2),依据公式(1)、(2)计算菌株细胞表面积(S)及体积(V):
S=4πb[sin45 °(a-b)+b]
(1)
V=4πab2/3
(2)
1.3.4 高糖胁迫下细胞膜通透性测定
参考Wen Rui Diao等[11]的方法进行高糖胁迫下菌株细胞膜通透性的测定.以40%(w/v)浓度糖胁迫为例说明细胞膜测定方法.试验菌株接种于YPD液体培养基,28 ℃过夜培养后离心收集细胞(5 000 × g,10 min).用40%(w/v)葡萄糖溶液清洗菌体,直至菌体相对电导率与40%(w/v)葡萄糖溶液的相对电导率相同,此菌称之为等渗菌.等渗菌进行沸水浴5 min,冷却至室温,测定其相对电导率,记为L0.同时测定40%葡萄糖溶液相对电导率,记为L1.将试验菌株分别接种于40%葡萄糖溶液中,隔1 h测定其相对电导率,记为L2.
相对电导率(%)=100×(L2-L1)/L0
(3)
依据上述方法,测定70%糖浓度胁迫下试验菌株的L0、L1和L2,计算其相对电导率.
1.3.5 高糖胁迫下细胞膜完整性测定
参考张璞瑜[12]的方法进行高糖胁迫下菌株细胞膜完整性测定.试验菌株接种于YPD液体培养基,28 ℃过夜培养后离心收集细胞(5 000 × g,10 min).细胞重悬于PBS缓冲溶液(pH 7.4)清洗3次后分别接种于2%、40%和70%糖浓度培养基中.以空白培养液为参比,每隔2 h取样进行预处理后用紫外可见分光光度计在260 nm处测定其吸光度值.
1.3.6 高糖胁迫下细胞膜ATPase活力测定
离心收集(5 000 × g,10 min)分别在2%、40% 和70%糖浓度条件下培养的试验菌株细胞.菌体置于研钵中,加入适量液氮后快速研磨至糊状.生理盐水(0.9%)定容糊状菌体至10 mL并充分混匀后4 ℃离心(9 000×g,10 min)收集上清液,此上清液即为粗酶液.之后按照ATP酶试剂盒说明书进行ATP酶活力测定.ATP酶可以将ATP水解生成ADP和无机磷,通过测定粗酶液中无机磷的含量,可以判断其细胞膜上ATP活力的高低.将每克菌液分解ATP产生1μmol无机磷的量作为1个ATP酶活力单位.计算公式如(4)所示:
ATPase活力=(测定OD值-对照OD值)/标准OD值×标准品浓度(1μmol / mL)×反应体系中样本稀释倍数×6/待测样本蛋白浓度
(4)
1.3.7 数据处理
上述试验均重复3次,试验数据以均值±标准差表示.采用SPSS软件对试验数据进行方差分析及多重比较检验(p<0.05, 邓肯氏检验).
2 结果与讨论
2.1 高糖胁迫下Z.rouxii菌落形态
高糖胁迫下试验菌株菌落形态如图1所示.可以看出:随着培养基糖浓度增加,试验菌株菌落形态发生了明显变化,主要表现为菌落大小和透明度的差异.在低浓度糖(2%,w/v)条件下,试验菌株菌落呈乳白色,不透明,大小适中;随着糖浓度增加(40%~70%,w/v),试验菌株菌落透明度增加,可以透射培养基颜色而呈微黄色,体积相对偏小.根据这一结果初步推测高糖胁迫下Z.rouxii细胞产生了生理应答,细胞代谢网络发生动态调整以抵御外界胁迫,维持正常生理代谢.Z.rouxii从自然环境到污染浓缩苹果汁等高糖食品的过程中,必须克服高糖胁迫压力才能导致食品腐败变质.
目前,已报道的Z.rouxii耐受高糖胁迫的分子机制主要包括:转运蛋白、相容性溶质、信号转导调控等[13].本试验发现随着糖胁迫强度的增加,Z.rouxii菌落透明度增加,推测其可能的原因是在高糖胁迫下细胞通过调节代谢途径促使胞内积累了大量的甘油、山梨醇、海藻多糖等相容性溶质以缓解胞外高渗透压,从而引起菌落透明度增加.Duškov等[14]的研究发现Z.rouxii的Stl、Ffz、Fsy基因编码能够介导主动吸收胞外甘油或果糖的转运蛋白,从而提高细胞的耐糖性.Z.rouxii的Gpd、Gpp、Dak、Gcy基因编码催化甘油合成的酶,Fps基因编码甘油转运通道蛋白,细胞对上述基因表达的调控可使胞内累积甘油来抵御高糖胁迫[15].Z.rouxii也可合成并累积海藻糖、阿拉伯醇、甘露醇等相容性溶质来增强细胞的耐受性[16].由此可见,胞内相容性溶质的积累在Z.rouxii抵御外界高糖胁迫中具有重要作用.


(a)2%糖+LB (b)40%糖+LB (c)70%糖+LB (d)2%糖+ATCC 2623 (e)40%糖+ATCC 2623 (f)70%糖+ATCC 2623图1 不同糖浓度胁迫下Z.rouxii菌落形态
2.2 高糖胁迫下Z.rouxii细胞形态及大小
高糖胁迫下试验菌株细胞形态如图2所示.可以看出:随着糖胁迫强度增加,细胞由椭圆趋向圆形,细胞表面出现一定褶皱,并且细胞趋于聚集.研究表明外界胁迫因素(高酸、高渗、高温、高醇等)会引起酵母一些生理特性的变化,从而在一定程度上影响酵母细胞的形状和聚集性.在外界不良环境胁迫下,微生物细胞代谢活性受到一定抑制,引起甘露糖合成酶活力下降,造成细胞壁中甘露糖含量减少,细胞壁不能正常发挥功能.但微生物细胞为了维持正常的生理活动,启动HOG和CWI信号传导途径合成大量葡聚糖来修复细胞壁,导致细胞壁层的增厚.细胞壁层的增厚引起细胞形态发生变化,由椭圆形逐渐趋于圆形.因此,当酵母菌处于不良外界环境中时,通过调控代谢网络合成大量葡聚糖使细胞壁增厚,从而阻止外界大分子自由进入细胞,是酵母菌进行自我保护的一种代谢调控能力的体现[17].在外界胁迫因素作用下,酵母菌胞壁蛋白的糖基化修饰受到抑制,导致大量蛋白暴露于细胞表面,弱化了细胞表面张力,最终引起酵母菌趋于聚集[18].
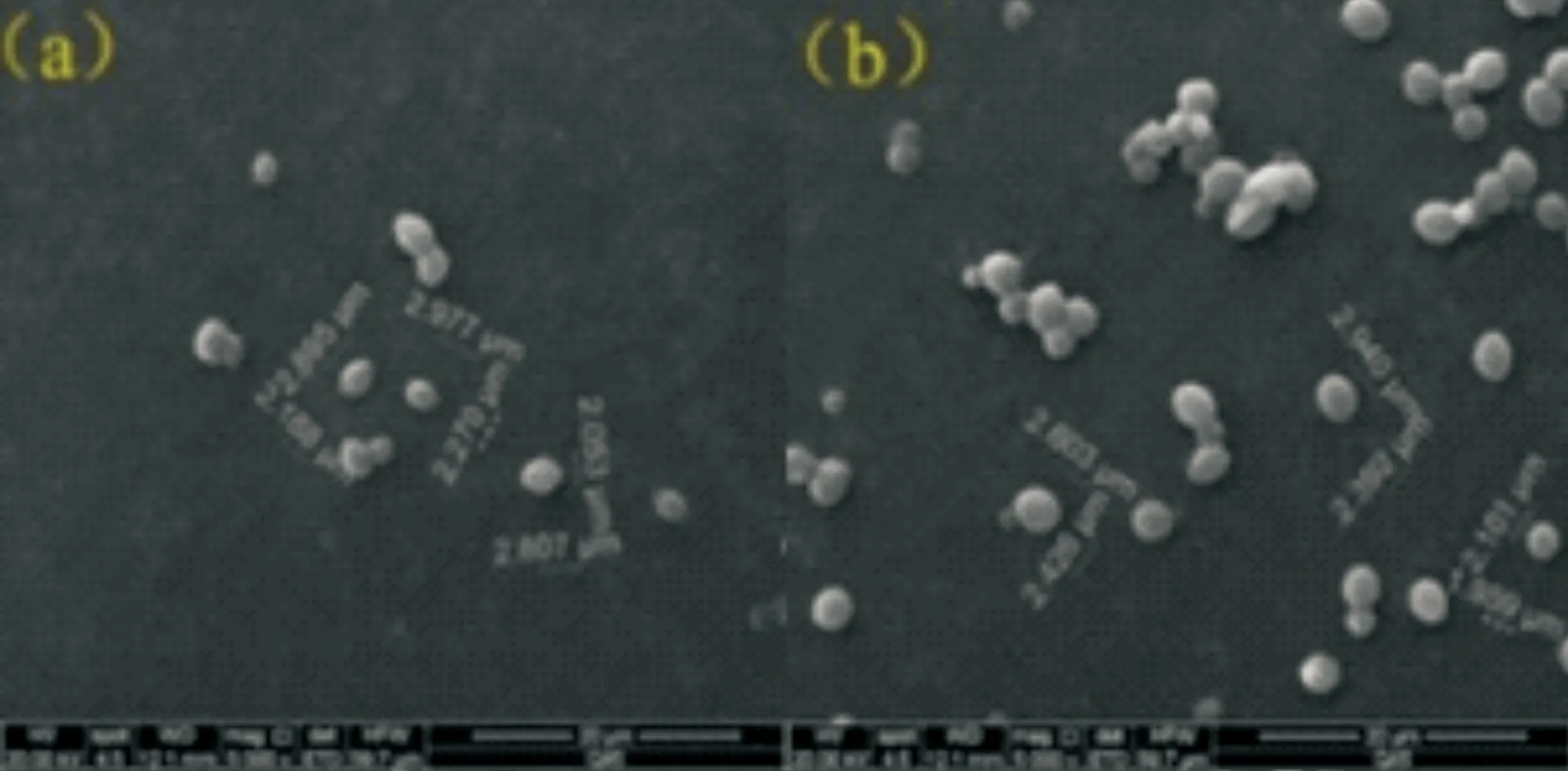


(a)2%糖+LB (b)40%糖+LB (c)70%糖+LB (d)2%糖+ATCC 2623 (e)40%糖+ATCC 2623 (f)70%糖+ATCC 2623图2 不同糖浓度胁迫下的Z.rouxii细胞形态(放大5 000倍)
对试验菌株的表面积和体积进行计算,结果如表2所示.由表2可以看出,随着糖浓度不断增大,细胞表面积和体积显著减小(p< 0.05),糖浓度为70%时,细胞表面积和体积最小.说明高糖胁迫对Z.rouxii细胞生长具有抑制作用.此外,细胞表面出现一定褶皱,一定程度上引起细胞内容物外流也对细胞表面积和体积变化产生一定影响.

表2 不同糖浓度胁迫下Z.rouxii细胞表面积与体积
2.3 高糖胁迫下Z.rouxii细胞膜通透性
从图3可以看出,将试验菌株分别接种于40%和70%(w/v)糖浓度培养基中,菌液的相对电导率随着胁迫时间会显著升高(p<0.05),之后趋于平稳.这可能是由于Z.rouxii细胞对高糖胁迫产生完全应答需要一定时间,在此其间酵母细胞尚不能适应高糖胁迫环境,导致细胞膜的屏障作用减弱,通透性增加,引发包括电解质在内的细胞内容物外泄,从而造成菌液相对电导率逐渐增大.随着高糖胁迫时间的延长,Z.rouxii细胞逐渐完成细胞应答过程,适应了高糖胁迫环境,通过调整细胞膜组成与结构恢复了膜通透性,胞内电解质停止外泄,因此菌液相对电导率趋于平稳.酵母细胞膜通透性与酵母抵抗环境胁迫的能力密切相关.通透性越大,抗逆能力越弱;通透性降低,细胞渗透屏障增强,可以确保细胞膜的结构和功能完整性,从而提高酵母细胞抵抗环境胁迫的能力.酵母细胞膜通透性与膜脂结构组成有关.在外界压力因子胁迫下,酵母细胞会通过脂肪酸异构化方式调节细胞膜中顺、反式脂肪酸比例,逐步恢复细胞膜通透性[10].麦角固醇对于恢复酵母细胞膜通透性也具有重要作用,其可在细胞膜上形成屏障,阻碍胞内外物质自由进出细胞[10].此外,70%糖浓度下菌液相对电导率显著高于40%糖浓度下的相对电导率(p<0.05),说明糖浓度越高,对细胞的胁迫作用越强,细胞在高糖浓度的胁迫作用下,导致电解质在短时间内大量外泄.

(a)40%(w/v)糖胁迫下LB菌液电导率
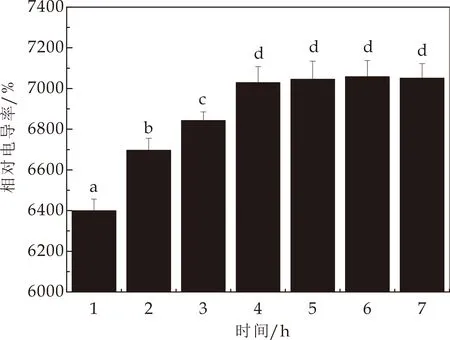
(b)70%(w/v)糖胁迫下LB菌液电导率

(c)40%(w/v)糖胁迫下ATCC2623菌液电导率

(d)70%(w/v)糖胁迫下ATCC2623菌液电导率图3 高浓度糖胁迫下Z.rouxii菌液电导率(不同上标小写字母表示具有显著差异(p<0.05邓肯氏检验))
2.4 高糖胁迫下Z.rouxii膜完整性
从图4可以看出,试验菌株在40%与70%糖胁迫下,菌液中核酸吸光度随着胁迫时间的延长显著增加,然后逐渐降低并趋于稳定(p<0.05).这可能是由于高浓度糖胁迫下,Z.rouxii菌体细胞膜受到一定损害,导致核酸等大分子从胞内流出,从而引发菌液中核酸吸光度增大.随着Z.rouxii细胞逐渐适应高糖环境,细胞膜组成和结构经过动态调节逐渐恢复完整性,胞内核酸等大分子停止外流,同时由于菌液酸碱度波动以及酵母细胞可能分泌少量胞外酶等原因导致菌液中部分核酸分子发生水解或降解,因此菌液中核酸吸光度逐渐降低并趋于稳定.
研究表明环境压力因子胁迫对微生物细胞膜完整性的影响主要表现在对疏水基相互作用的破坏.疏水基相互作用对于维持细胞膜稳态具有重要作用,环境压力因子作用于细胞膜后主要对细胞膜中由长链烃基组分依靠疏水基相互作用形成的疏水核心进行破坏,造成该疏水核心极性化,从而屏蔽该核心区域对极性物质进出细胞的渗透屏障,削弱细胞膜的完整性,引发细细胞内容物外泄[19].

(a)40%(w/v)糖胁迫下LB菌液核酸吸光度

(b)70%(w/v)糖胁迫下LB菌液核酸吸光度

(c)40%(w/v)糖胁迫下ATCC2623菌液核酸吸光度

(d)70%(w/v)糖胁迫下ATCC2623菌液核酸吸光度图4 高浓度糖胁迫下Z.rouxii菌液核酸吸光度(不同上标小写字母表示具有显著差异(p<0.05,邓肯氏检验))
2.5 高糖胁迫下Z.rouxii细胞膜ATPase活力
高糖胁迫对Z.rouxii细胞膜ATPase活性的影响如表3所示.从表3可以看出,在高糖胁迫下, 试验菌株细胞膜 H+-ATPase、 Na+、K+-ATPase和Ca2+、Mg2+-ATPase酶活力均显著升高(p<0.05).这可能是由于一定浓度的糖胁迫下,Z.rouxii细胞启动应答响应,在一定时间内通过增强膜ATPase活性来抵御高浓度糖的胁迫,是酵母细胞自身应激反应的一种体现.

表3 糖胁迫下Z.rouxii细胞膜ATPase活力
ATP酶对于微生物细胞的生理代谢非常重要,其在细胞膜和细胞器膜上存在广泛,参与多种生理代谢活动.H+-ATPase、Ca2+,Mg2+-ATP酶和Na+,K+-ATP酶是细胞膜上主要的ATP酶,主要通过调节细胞内外渗透压平衡和细胞膜结构与功能的完整性维持细胞正常的生理活性[20].微生物细胞受到环境压力因子胁迫时,细胞产生应答,胞膜上ATP 酶活性会产生变化.细胞膜H+-ATPase活性升高,可以弱化胁迫因子对微生物细胞跨膜质子流的影响,从而强化菌体抗逆性[21].细胞膜Na+,K+-ATPase 活性升高,通过逆浓度将胞外K+转运至胞内并将胞内Na+转运至胞外来调节细胞内外渗透压平衡[20].Ca2+,Mg2+-ATPase是微生物细胞维持胞内Ca2+平衡的一种膜转运蛋白,其活性升高可将由于受到外界压力胁迫而产生的高浓度胞内Ca2+转运出胞外,从而维持细胞的正常生理代谢[20].
3 结论
本研究结果表明,高糖胁迫下Z.rouxii细胞膜发生一系列生理应答以适应高糖环境,主要表现为:菌落透明度增加,菌体细胞一定程度萎缩,体积变小;细胞膜通透性先增大后减小最终趋于平稳;细胞膜完整性先降低后增加最终也趋于稳定;细胞膜H+-ATPase、Na+,K+-ATPase和Ca2+,Mg2+-ATPase活力升高,说明高糖胁迫会影响Z.rouxii膜ATPase活力,引起膜通透性、完整性等生理特性发生变化,从而导致细胞耐糖性发生变化.
本研究结果有助于深入理解Z.rouxii耐受高糖胁迫的细胞膜应答机制,为后续有针对性地建立功能干预措施抑制细胞膜生理应答进程从而降低Z.rouxii耐糖性,进而弱化其污染能力,实现有效控制浓缩苹果汁等高糖食品生产中Z.rouxii污染提供基础理论支持.

