生大黄粉治疗新生鼠坏死性小肠结肠炎实验研究
贾艳萍,谢秀春,贾毛毛,马丹阳,罗世杰,冯爱民*
(陕西中医药大学,陕西 咸阳 712046;2.陕西中医药大学附属医院,陕西 咸阳 712000)
坏死性小肠结肠炎(necrotizing enterocolitis,NEC)为新生儿期一种严重的胃肠道疾病,是导致新生儿肠穿孔及全身炎症反应综合征(systemin inflammatory response,SIRS)的主要原因之一[1],也是导致新生儿死亡的重要病因[2]。
随着早产儿存活率的不断提高,NEC 发病率明显增加,在低出生体质量儿中约为2.50%,在极低出生体质量儿中约为4.53%[3],病死率高达15%~30%[4],尚无特效防治手段。NEC 确切的病因及发病机制尚不明确,目前研究认为,NEC 的发生主要由于多种致病因素综合作用于发育尚不成熟的胃肠道,使肠黏膜局部缺血,肠道蠕动功能减弱,食物在肠腔内滞留,致胃肠功能紊乱,使致病菌繁殖,引起肠道炎症反应,激发炎症风暴。如肠壁缺血/缺氧及再灌注损伤[5-6]、早产[7-8]及低出生体质量[9]、感染及炎症反应[10-11]、喂养不当[12]等综合影响下导致NEC 的发生。在上述各致病因素的作用下,NEC 引起肠道功能障碍,造成肠道内中性粒细胞浸润、黏膜下水肿、出血,消化道绒毛结构破坏,甚至穿孔或坏死等病理改变,发生败血症、感染性休克等严重并发症[13]。因此NEC 的恰当治疗对提高生存率,改善预后至关重要。
现代药理研究证实,大黄具有保肝利胆[14]、抑制多种菌种[15]、泻下、活血、止血、调节血脂[16]、保护肠道黏膜屏障、降低肠道细菌移位率[17]等作用。本课题对生大黄粉治疗新生鼠NEC 的效果进行了研究,同时,通过对肠组织匀浆胃动素(MTL)和促胃液素(GAS)含量的测定,探讨其治疗机制,以期为临床应用生大黄粉治疗新生儿NEC 提供科学依据。
1 材料与方法
1.1 主要试剂和仪器 早产儿配方奶粉(特别能恩)由雀巢公司提供;汤臣倍健蛋白粉购自汤臣倍健股份有限公司;脂肪乳注射液(C14-C24)由华瑞制药有限公司提供;脂多糖(LPS)购自北京Solarbio 公司;CY-12C 型便携式数字测氧仪;大鼠GAS ELISA 检测试剂盒(批号:YX-O72000R)、大鼠MTL ELISA 检测试剂盒(批号:YX-132012R);医用纯氮气:纯度≥99.9%,由陕西中医药大学实验中心提供;医用纯氧气:由陕西中医药大学附属医院制氧站提供;生大黄粉购自陕西中医药大学附属医院制剂室,生大黄粉液配制方法:大、中、小剂量组分别取2.04、1.02、0.51 g 生大黄粉,分别直接加入15 mL 热水中,0.1 mL 生大黄粉液中含生大黄剂量分别为0.013 6 g,0.006 8 g,0.003 4 g。
1.2 动物与分组 SPF 级新生2 d 龄SD 大鼠72 只,生产许可证:SCXK(川)2015-030,购自成都达硕实验动物有限公司。将体质量5~12 g 新生大鼠采用随机数字表法分为6 组,每组12 只。A 组仅接受人工喂养;B 组接受人工喂养+缺氧复氧冷刺激+LPS+生理盐水;C 组接受人工喂养+缺氧复氧冷刺激+LPS+西咪替丁;D 组接受人工喂养+缺氧复氧冷刺激+LPS+大剂量生大黄;E 组接受人工喂养+缺氧复氧冷刺激+LPS+中剂量生大黄;F 组接受人工喂养+缺氧复氧冷刺激+LPS+小剂量生大黄。
1.3 方法
1.3.1 人工喂养 新生SD 大鼠在出生后48 h 置于保育箱内(温度28~30 ℃,湿度45%~65%),采用代乳品人工喂养,代乳品配制见表1,每100 mL 代乳品添加早产儿奶粉6.0 g,蛋白粉10.7 g,脂肪乳48.9 mL,总热量约7020 kJ,采用6 号灌胃针定时经口插管喂养,第1 天给予0.2 mL/6 h,随后每24 h 增加0.1 mL,48 h 后逐渐增至0.4 mL。

表1 人工喂养代乳品配方与鼠乳主要成分的比较
1.3.2 缺氧、复氧及冷刺激 CY-12C 型测氧仪调零后,将探头连接至缺氧箱出口处,入口处充入氮气,打开氮气罐流量表,控制氮气流量为15 L/min,当缺氧箱氧浓度为零时迅速将除A 组外余60 只新生鼠置入,90 s 后关闭氮气阀,打开缺氧箱,取出新生鼠,随后将其置入含100%氧气的复氧箱中,10 min 后将新生鼠置于4 ℃冰箱冷藏,持续10 min 后放回保育箱,每日2 次,连续3 d。
1.3.3 LPS 腹腔注射LPS 0.1 mL(10 mg/kg),每日1 次,连续3 d。
1.3.4 药物治疗 B 组灌胃生理盐水0.1 mL,C 组灌胃西咪替丁0.1 mL(相当于0.000 34 mg),D 组每次灌胃生大黄粉液0.1 mL(含生大黄13.6 mg),E 组每次灌胃生大黄粉液0.1 mL(含生大黄6.8 mg),F 组每次灌胃生大黄粉液0.1 mL(含生大黄3.4 mg),均间隔8 h 给药1 次,连续3 d。
1.3.5 组织病理评分标准 所有动物于第4 天空腹颈椎脱臼处死,取回盲部近端肠组织上下各1 cm 立即固定,脱水,石蜡包埋,切片及HE 染色,参照文献[18]评分标准进行双盲肠组织病理评分:0 分为肠绒毛及上皮完整,组织结构正常;1 分为轻度黏膜下和(或)固有层肿胀分离;2 分为中度黏膜下和(或)固有层肿胀分离,黏膜下和(或)肌肉层水肿;3 分为重度黏膜下和(或)固有层肿胀分离,黏膜下和(或)肌肉层水肿,局部绒毛脱落;4 分为肠绒毛消失和(或)伴肠坏死;组织评分≥2 分,确定为NEC。
1.3.6 肠组织GAS、MTL 含量检测 将剩余肠组织置于冰生理盐水中漂洗、滤纸拭干称重,冰浴下制作10%肠组织匀浆,4 ℃低温离心,3 500 r/min,离心15 min,取上清液分装于EP 管中,置于-80℃冰箱中待测,采用酶联免疫吸附法(ELISA)检测各组新生鼠MTL、GAS 含量。
1.4 统计学方法 实验数据采用SPSS 22.0 统计软件分析,治疗前后各组之间采用单因素方差分析(ANOVA),方差齐者用LSD 比较,方差不齐者用Tamhane´s 比较,等级资料用Kruskal-Wallis H 检验;以P<0.05 表示差异有统计学意义。
2 结果
2.1 一般情况及体质量变化
2.1.1 一般情况 B 组、C 组、D 组、E 组、F 组在造模后新生鼠均出现活动减少,倦怠,反应迟钝,喂养困难、吐奶及胃潴留,腹部胀满,进而可见大便颜色性状发生改变,均不同程度排黄绿便或黑色稀便。除A组外,余各组在缺氧过程中新生鼠均出现烦躁、抽搐、呼吸困难、紫绀、大小便失禁。复氧后新生鼠逐渐恢复自主活动,肤色转红,其中D 组、E 组、F 组复氧需几十秒至1 min 不等,B 组、C 组复氧约需3 min;冷刺激10 min 后,新生鼠出现全身皮肤冰冷,黏膜苍白,立即置于保育箱保暖,D 组、E 组、F 组肤色不足1 min 恢复,B 组、C 组约2~3 min 肤色恢复。A 组活动度可,纳乳及排便正常,无腹胀及腹泻。
2.1.2 各组实验前后NEC 动物体质量比较 各组新生鼠实验前体质量、实验后体质量,见表2。经单因素方差分析(ANOVA),实验前A 组、B 组、C 组、D组、E 组、F 组新生鼠体质量相似(P>0.05)。实验结束后,根据LSD 多重比较进一步推断,各组间体质量比较:A 组>E 组>D 组>F 组>C 组,B 组与C组体质量无差异。结果表明,生大黄(粉)及西咪替丁对NEC 大鼠体质量增长有改善作用,且前者优于后者,见表2。
表2 各组实验前后NEC 动物体质量及其差值比较(,n =12) g

表2 各组实验前后NEC 动物体质量及其差值比较(,n =12) g
注:与其他各组比较,# P <0.05
2.2 新生鼠肠组织HE 染色病理学改变 用HE 染色法记录新生鼠肠组织回盲部形态变化,光镜下可观察到D 组、E 组、F 组肠绒毛生长旺盛,结构相对整齐,部分轻度水肿,黏膜下层和固有层轻度分离,分离程度较B 组、C 组明显减轻(图1-D、图1-E、图1-F);B 组、C 组新生鼠肠组织损伤严重,黏膜下层和固有层肿胀分离明显,肠绒毛水肿,黏膜下层及固有层可见嗜酸性粒细胞、中性粒细胞浸润(图1-B、图1-C);A 组肠组织结构完整清晰,黏膜层、黏膜下层及固有层未见明显分离,且无炎症细胞浸润(图1-A)。
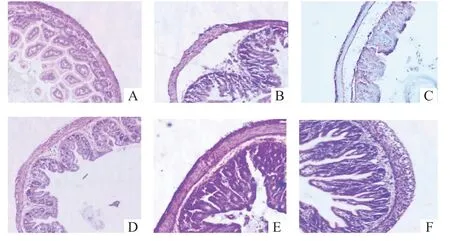
图1 NEC 模型治疗后各组新生鼠肠组织(HE,×100)
2.3 不同干预方式对NEC 动物模型病理评分的比较 新生鼠肠组织病理评分结果,见表3。由于肠组织病理评分为等级资料,不符合正态分布,采用Kruskal-Wallis H 检验后,P<0.05,故各组间病理评分存在显著差异;D 组、E 组、F 组之间比较结果显示,差异无统计学意义(P>0.05)。
表3 不同干预方式对NEC 动物模型病理评分的比较(,n =12)

表3 不同干预方式对NEC 动物模型病理评分的比较(,n =12)
注:与B 组比较,# P <0.05
2.4 各组肠组织匀浆中MTL、GAS 含量比较 各组新生鼠肠组织MTL、GAS 含量见表4,各组间MTL含量比较:A 组>D 组>C 组>B 组,A 组>E组>C 组>B 组,A 组>F 组>C 组>B 组,D 组、E 组及F 组之间MTL 含量相似,差异无统计学意义,说明缺氧等肠损伤后,肠组织内MTL 表达降低,经生大黄粉治疗后,可使肠组织中MTL 升高;各组间GAS 含量比较:B 组>C 组>D 组>A 组,B 组>C组>E 组>A 组,B 组>C 组>F 组>A 组,D 组、E 组及F 组之间GAS 含量相似,差异无统计学意义,说明缺氧等肠损伤后,肠组织内GAS 表达升高,经生大黄粉治疗后,可使肠组织中GAS 表达降低。
表4 各组肠组织匀浆中MTL、GAS 含量比较(,n =12) pg/mL
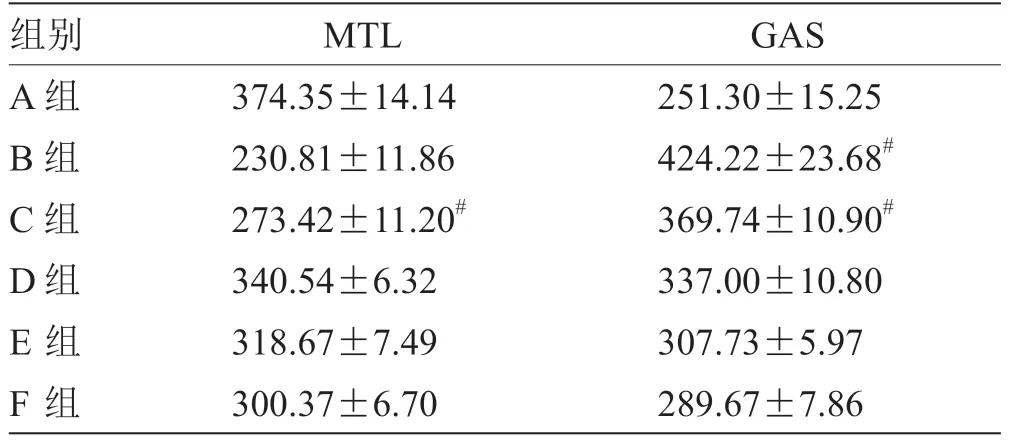
表4 各组肠组织匀浆中MTL、GAS 含量比较(,n =12) pg/mL
注:与B 组比较,# P <0.05
3 讨论
中医学中并没有特定的“坏死性小肠结肠炎”病名,根据患者表现出的“腹胀、便秘、呕吐”等症状,当属中医“痞满”“便秘”“呕吐”“呃逆”等范畴,其病位在脾、胃、大肠、小肠等。坏死性小肠结肠炎的病因尚不明确,多认为与初生儿、胎怯儿先天禀赋不足,脏腑娇嫩,形气未充有关。坏死性小肠结肠炎的根本病机是气机逆乱、脾胃功能失调。NEC 的内科治疗以禁食、胃肠减压、胃肠外营养、有效抗菌药物抗感染、液体复苏、辅助通气等对症支持治疗为主[19-20],外科主要通过手术治疗。在西医治疗的基础上,生大黄粉对NEC 有非常显著的防治作用[21],其作用机制与抑制NF-κB P65 蛋白表达相关,大黄上清液可抑制Caco-2 炎症细胞Toll 样受体的表达,减轻炎症反应。
生大黄性味苦寒,入脾、胃、肝、大肠、心包经;能下瘀血、通血闭;推陈致新,破癥瘕积聚,除留饮宿食;攻积导滞,宣通气机;调畅脾胃气机,具有泻下作用;生大黄调畅脾胃气机的作用与坏死性小肠结肠炎气机逆乱,脾胃功能失调相契合。诸多研究证实,生大黄对胃肠道调节作用明显。研究表明,大黄具有减轻氧自由基损害,抑制肠道炎症反应[22],促进平滑肌收缩,保护消化道黏膜,增加胃动力,促进止血等作用[23]。
MTL 和GAS 是对胃肠功能有重要调节作用的激素。MTL 作用于消化系平滑肌上的胃动素受体,导致平滑肌收缩加强,加速胃排空和缩短食物在小肠内的停留时间,起着“清道夫”的作用[24-25]。GAS 是由胃窦及十二指肠和空肠上段黏膜中G 细胞分泌的一种胃肠激素,其主要生理作用是刺激胃肠道的分泌,使胃酸、胃蛋白酶分泌增加,促进胃粘膜血流量增加、胃平滑肌收缩[26-27]。它能促进胃的运动,也能增强幽门括约肌的收缩,其总效应是延缓胃排空。本实验结果显示,与生理盐水组比较,生大黄治疗组MTL 升高、GAS 降低,差异均有统计学意义(P<0.05);与西咪替丁组比较,生大黄治疗组中MTL 表达高于西咪替丁组,GAS 表达低于西咪替丁组,差异均有统计学意义(P<0.05);生大黄各剂量组之间比较,MTL、GAS表达相似,差异均无统计学意义(P>0.05)。HE染色结果显示,生大黄治疗组肠绒毛结构相对整齐,部分轻度水肿,黏膜下层和固有层轻度分离,生理盐水组、西咪替丁组肠组织损伤严重,黏膜下层和固有层肿胀分离明显,肠绒毛水肿,黏膜下层及固有层可见嗜酸性粒细胞、中性粒细胞浸润;生大黄治疗组其病理评分均值低于生理盐水组及西咪替丁组,且相同实验因素下其发病率明显减低。
综上所述,生大黄粉能够降低新生鼠NEC 模型肠损伤程度,且效果优于西咪替丁,提示生大黄粉有可能成为防治NEC 的一种有效药物。本实验结果提示不同剂量生大黄对肠损伤病理切片改善无明显差异,且生大黄作为单味中药,目前对其吸收代谢、作用机制、药物效果的研究还不全面,特别是在治疗NEC 方面仅处于探索阶段,还需要大量研究奠定基础。

