免疫检查点抑制剂相关心肌炎监测与管理中国专家共识(2020版)*
中国抗癌协会整合肿瘤心脏病学分会 中华医学会心血管病学分会肿瘤心脏病学学组
中国医师协会心血管内科医师分会肿瘤心脏病学专业委员会 中国临床肿瘤学会肿瘤心脏病学专家委员会
免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)是近年来肿瘤治疗的重要进展,其主要机制是通过抗体抑制免疫检查点(immune checkpoint,IC)的活性,恢复并提高效应T 淋巴细胞特异性识别和杀伤肿瘤细胞的能力,从而增强全身抗肿瘤免疫应答系统的反应。ICIs 适应证已从最初的黑色素瘤扩展到非小细胞肺癌、小细胞肺癌、肾细胞癌、尿路上皮癌、霍奇金淋巴瘤、非霍奇金淋巴瘤、食管癌、胃癌、结直肠癌、肝癌、宫颈癌、头颈部鳞状细胞癌、默克尔细胞癌、皮肤鳞状细胞癌和三阴性乳腺癌等诸多恶性肿瘤,更多的适应证仍在继续探索之中。
ICIs为患者带来显著生存获益的同时,对各器官的免疫毒性成为临床中不可回避的新问题,特别是ICIs相关心肌炎在所有器官免疫毒性中致死性最高,成为导致患者短期内死亡的重要原因,病例报告数量的快速增长提示其真实发生率很可能被低估[1-8]。ICIs 相关心肌炎的识别和处理已成为临床医师的共同挑战。
因此,中国抗癌协会整合肿瘤心脏病学分会、中华医学会心血管病学分会肿瘤心脏病学学组、中国医师协会心血管内科医师分会肿瘤心脏病学专业委员会和中国临床肿瘤学会肿瘤心脏病学专家委员会共同组织相关领域的专家制定本共识,为ICIs相关心肌炎的主动监测和管理提供指导意见和建议。
1 ICIs的分类和代表药物
1.1 细胞毒性T淋巴细胞相关抗原4抑制剂
细胞毒性T 淋巴细胞相关抗原-4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)是一种主要表达在被活化的T 淋巴细胞或自然杀伤(natural killer,NK)细胞上的跨膜受体,当与抗原呈递细胞表面的B7-1(CD80)/B7-2(CD86)结合后会减弱T 淋巴细胞活化,导致T淋巴细胞免疫应答能力下降,阻断CTLA-4 可以再次激活T 淋巴细胞的免疫应答能力[9]。CTLA-4 抑制剂有伊匹木单抗(ipilimumab)和曲美木单抗(tremelimumab)。
1.2 程序性细胞死亡蛋白1及配体PD-L1抑制剂
程序性细胞死亡蛋白-1(programmed cell death protein-1,PD-1)是一种单体糖蛋白,表达于T淋巴细胞、NK细胞、B细胞、树突细胞、单核细胞和肿瘤细胞上。目前已证实PD-1在T淋巴细胞进入肿瘤微环境后,活化过程后期下调T 淋巴细胞免疫应答能力,其相应配体有PD-L1 和PD-L2,PD-1 只有与PD-L1 结合才能对T淋巴细胞产生抑制作用[10]。PD-1/PD-L1抑制剂均可以阻止PD-1 与PD-L1 结合,使T 淋巴细胞恢复活性。目前批准上市的PD-1 抑制剂有帕博利珠单抗(pembrolizumab)、纳武利尤单抗(nivolumab)、西米普利单抗(cemiplimab)、特瑞普利单抗(toripalimab)、信迪利单抗(sintilimab)、替雷利珠单抗(tislelizumab)和卡瑞利珠单抗(camrelizumab);PDL1抑制剂有度伐利尤单抗(durvalumab)、阿替利珠单抗(atezolizumab)和阿维鲁单抗(avelumab)。
2 ICIs相关心肌炎的流行病学
从接受ICIs 治疗到出现心肌炎的时间间隔差异很大,2017年一项研究显示发病中位时间为65天,而2018年发表的另一项研究显示发病中位时间为用药后34 天,81%的心肌炎出现在用药后3 个月内,发病时间相对早于其他器官免疫不良反应[6,11]。另一项研究统计了2017年以前101 个接受ICIs 治疗后出现严重心肌炎的病例,发病中位时间为27天,76%的严重心肌炎发生于用药后6 周内[1]。甚至部分患者仅接受1~2 次ICIs 治疗就出现严重心肌炎[1,12]。值得注意的是,并非所有的ICIs相关心肌炎都出现在注射ICIs 后早期或中期(<90 天),在晚期(~454 天)也有可能发生心肌炎,发病较晚的心肌炎患者中出现心力衰竭的比例更高,但心血管相关死亡率和总死亡率与发生时间较早的心肌炎患者并无差别[11,13]。
有研究报道严重心肌炎发生率为0.09%,其中纳武利尤单抗治疗时严重心肌炎发生率为0.06%,伊匹木单抗联合纳武利尤单抗治疗时严重心肌炎发生率为0.27%[3]。而美国马萨诸塞州总医院的研究数据中,ICIs相关心肌炎的发生率为1.14%,其中高达46%的患者出现主要不良心脏事件(心血管死亡、心脏骤停、心源性休克和血流动力学不稳定的完全性传导阻滞)。单独使用抗PD-1、抗PD-L1或抗CTLA-4治疗时心肌炎发生率分别为0.5%、2.4%或3.3%,而抗PD-1 联合抗CTLA-4或抗PD-L1联合抗CTLA-4治疗时心肌炎发生率分别为2.4%或1%[6]。接受包括多个国产ICIs在内的单中心和多中心回顾性分析显示,中国ICIs相关心肌炎发生率分别为1.06%和1.05%[14-15]。
除两种ICIs 联合治疗较单药治疗可能增加心肌炎发生率外,有研究提示既往有糖尿病、心力衰竭、急性冠脉综合征(acute coronary syndromes,ACS)病史或年龄>80岁可能增加心肌炎的发生风险[6,16]。
与接受抗PD-1 单药治疗相比,接受抗PD-1 联合抗CTLA-4治疗的患者心肌炎症状更严重[1,17]。一旦发生严重心肌炎,平均病死率为46%,其中抗PD-1联合抗CTLA-4相关心肌炎患者病死率高达67%;而抗PD-1单药相关心肌炎患者病死率为36%[1]。
3 ICIs相关心肌炎的病理特点和发生机制
心内膜心肌活检(endomyocardial biopsy,EMB)和尸检发现ICIs 相关心肌炎患者的心肌组织中有大量CD3+T淋巴细胞浸润,其中含有丰富的CD8+和CD4+T淋巴细胞。部分患者存在CD68+巨噬细胞浸润、嗜酸粒细胞浸润,罕见CD56+细胞浸润,未见抗体沉积,心肌可存在一定程度的纤维化,传导系统也可受累[3,6,12,18-23]。
ICIs相关心肌炎的确切机制仍不清楚,有研究发现这类患者心肌和肿瘤组织中有共同的高频T 淋巴细胞受体序列,推测应用ICIs后被激活的T淋巴细胞不仅可以靶向识别肿瘤,也可能识别骨骼肌和心肌共有抗原,从而诱发自身免疫性淋巴细胞性心肌炎[3,21,24]。
4 ICIs相关心肌炎的临床特点
ICIs相关心肌炎的外在临床表型可能为以下一种或多种心血管疾病并存,如心力衰竭、各种心律失常(心房颤动、房室传导阻滞、束支传导阻滞、室性心动过速等)、心肌-心包炎、心肌病和心脏性猝死等[4,11,25-28]。
4.1 临床表现
临床上可呈无症状、轻微症状、明显症状或暴发性心肌炎表现[29]。初起症状多为非特异性,易被忽视,如乏力、心悸和气短等,进一步发展可能出现端坐呼吸、下肢浮肿,甚至猝死等临床表现。典型心肌炎临床综合征包括心悸、胸痛、急性或慢性心力衰竭,以及心包炎、心包积液等一系列表现。此外,心肌炎可能以惰性方式出现,并伴有轻度心功能不全。上述表现既可能是ICIs诱发的心肌炎所致,又可能和患者的一般状态、营养水平相关,也可能为原发心血管疾病、肿瘤进展及其并发症、其他抗癌药物相关心血管并发症所致,如症状可以完全归因于另一种非心肌炎疾病则不能诊断心肌炎临床综合征[29-31]。
4.2 心电图
约90%的ICIs相关心肌炎患者出现心电图异常,可以表现为各种类型的心律失常(窦性心动过速、心房颤动、频发早搏、室上性心动过速、窦性停搏、房室传导阻滞、室内传导延迟或束支传导阻滞、室性心动过速或心室颤动、心脏停搏等),可以出现QT 间期延长、ST 段抬高或T 波倒置、R 波幅度减低、异常Q 波、低电压,但相对特异性表现为房室传导阻滞[6]。
4.3 心脏生物标志物
约90%的ICIs 相关心肌炎患者出现肌钙蛋白(cTn)水平升高,伴临床症状患者通常明显升高,约70%的心肌炎患者出现利钠肽(BNP 或NT-proBNP)水平升高[4,6,11,32-34]。其他如肌红蛋白(Mb)、肌酸激酶(CK)及其同工酶(CK-MB)、天门冬氨酸氨基转移酶以及乳酸脱氢酶等均可升高,如同时合并肌炎则Mb和CK 显著升高。心肌炎患者的Mb、CK 和CK-MB、cTn持续升高时间明显超过心肌梗死患者,危重患者上述检验结果恢复时间甚至可达数周,这在无法进行冠脉影像学检查的情况下有助于鉴别诊断。
4.4 超声心动图
仅有不到50%的ICIs 相关心肌炎患者出现左室射血分数(LVEF)下降,其中部分患者表现为严重左室收缩功能异常(LVEF<35%),可能有节段室壁运动异常、弥漫性左室收缩功能减退、心腔扩大或室壁增厚等改变[6]。此外,无论LVEF是否正常,ICIs相关心肌炎患者中整体长轴应变均明显下降[35]。
4.5 心脏核磁共振成像
研究显示,ICIs相关心肌炎患者出现心肌晚期钆增强的比例不足50%,低于传统病因所致的心肌炎,约40%的患者LVEF>50%,其他表现还有T2 加权的短时间反转恢复序列信号升高[22]。心脏核磁共振成像(cardiovascular magnetic resonance,CMR)是无创诊断传统病因所致心肌炎的金标准,在ICIs相关心肌炎诊断中的敏感性可能下降[11,22]。
4.6 可能伴随其他器官免疫不良反应
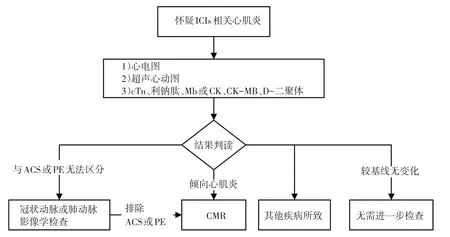
图1 疑似ICIs相关心肌炎的检查和诊断流程
部分患者可能同时出现包括心肌炎在内的多器官免疫不良反应,如免疫性肝炎、免疫性肺炎、免疫性肌炎或重症肌无力等,其中心肌炎合并重症肌无力或肌炎最为常见,甚至有时以肌炎、重症肌无力等为首发表现,随后才出现心肌炎表现[7,12,36-38]。
5 ICIs相关心肌炎的诊断、分级分型和鉴别诊断
5.1 何时要怀疑心肌炎及所需进一步检查
接受ICIs治疗后患者出现以下一种或多种情况时需警惕心肌炎可能:1)无法用其他原因解释的新发症状,如胸痛、呼吸困难、心悸、下肢浮肿和不明原因心源性休克等;2)与基线比较,心脏损伤生物标志物明显异常,如Mb、CK及CK-MB、乳酸脱氢酶、天门冬氨酸氨基转移酶、cTn、利钠肽升高等;3)心电图出现新发的各种类型传导阻滞、ST-T改变、QRS波群增宽或心动过速等;4)超声心动图新出现节段运动异常、左室壁增厚或心室扩张或LVEF下降等;5)胸部影像(X线或CT)新出现的心影增大;6)免疫性肌炎或重症肌无力。
当怀疑发生ICIs 相关心肌炎时,需暂缓ICIs 治疗,直至排除心肌炎诊断。除详细询问症状和体格检查外推荐完成心电图、超声心动图、Mb或CK、CKMB、cTn、利钠肽和D-二聚体筛查项目,有助于初步诊断和鉴别诊断(图1)。如上述筛查项目结果较基线未发生变化,则不推荐进一步进行CMR 或冠脉影像学检查。如上述筛查项目结果异常,需请心血管内科医师会诊,对异常结果分析解读。疑似心肌炎时,需要进一步完善多项实验室检查(血常规、血沉、C反应蛋白),有能力的医院可尽快完成CMR,必要时完成EMB,不推荐常规进行病毒学检测[7,39]。
如果临床怀疑同时存在肌炎或检测到Mb(或CK)和肌钙蛋白T(cTnT)同时升高,推荐复查肌钙蛋白I(cTnI),因有研究发现仅有骨骼肌疾病而无心肌病变时,cTnT也可升高[40]。
5.2 ICIs相关心肌炎的诊断
由于ICIs相关心肌炎的症状、体征、心电图、实验室检验、影像检查均缺乏特异性,因此诊断较为困难,基于能够获得的临床资料可将其分为“明确的心肌炎”、“可能性较大的心肌炎”、“有可能的心肌炎”以及“亚临床心肌损伤”(表1)[29]。
在实际临床工作中,符合“明确的心肌炎”诊断标准的病例可能有限,更多的是“可能性较大的心肌炎”和“有可能的心肌炎”。
5.3 ICIs相关心肌炎的分级和临床分型
5.3.1 ICIs相关心肌炎的分级 结合ICIs相关心肌炎的临床症状和辅助检查结果,可将ICIs相关心肌炎分为4级(表2)。
5.3.2 ICIs 相关心肌炎的临床分型 根据病情严重程度建议将ICIs 相关心肌炎分为:1)亚临床心肌损伤;2)轻症型心肌炎,临床情况介于亚临床损伤与重症型心肌炎之间,cTn 与利钠肽轻度升高;3)重症型心肌炎,如二度房室传导阻滞、束支传导阻滞、节段性室壁运动异常、LVEF<50%或心功能分级Ⅱ~Ⅲ级,cTn与利钠肽明显升高;4)危重型心肌炎,如血液动力学不稳定、心功能Ⅳ级、心电图多个导联QRS波增宽、完全性房室传导阻滞或室性心动过速或心室颤动、多器官功能衰竭等,cTn与利钠肽显著升高。

表1 ICIs相关心肌炎的诊断分层

表2 ICIs相关心肌炎的分级标准
5.4 ICIs相关心肌炎的鉴别诊断
ICIs 相关心肌炎的确诊直接关系到肿瘤患者能否继续接受ICIs治疗,其诊断的正确性很可能影响肿瘤患者预后。而ICIs 相关心肌炎常常缺乏特异的临床表现、实验室和影像学诊断标准,因此需要排除已知心血管疾病或非心血管疾病可解释的上述症状或检验检查异常。主要鉴别诊断如下:
1)ACS:部分ICIs 相关心肌炎的临床表现、心电图和心脏损伤标志物变化等方面与ACS(包括不稳定型心绞痛、非ST段抬高型心肌梗死和ST段抬高型心肌梗死)相似,如无法区分,需请心血管内科医师会诊。心电图符合ST段抬高型心肌梗死时需要呼叫胸痛中心进行急诊冠脉造影明确诊断。
2)肺栓塞(pulmonary embolism,PE):肿瘤患者是PE高危人群,其症状、心电图表现和心脏生物标志物异常与ICIs相关心肌炎也存在诸多相似之处。D-二聚体阴性有助于排除PE,如D-二聚体阳性,则根据PE可能性评分,遵循PE诊断流程图,结合血气分析、超声心动图、静脉超声、必要时肺动脉CTA检查进行鉴别诊断[41]。
3)其他原因所致的心功能不全或心力衰竭:遗传性心肌病、先天性心脏病、既往心血管疾病进展、存在其他导致心力衰竭的药物或毒素(如铂剂、蒽环类药物、酒精等),此时通常利钠肽明显升高,而cTn无升高或轻度升高,结合家族史、个人史、疾病史和CMR有助于鉴别。
4)其他原因所致的心律失常:其他抗癌药物、离子紊乱、自身心血管疾病进展、邻近肿瘤压迫等可引起室上性早搏、室性早搏、心房颤动等心律失常,此时通常cTn无升高,部分心律失常患者可能伴有利钠肽轻度升高。
5)其他疾病所致的cTn和利钠肽轻度升高:肾功能衰竭、原有心血管疾病、败血症等。
6)其他原因所致的心肌炎:病毒、细菌、真菌、螺旋体、立克次体、原虫、蠕虫等感染性心肌炎,或结缔组织病、巨细胞心肌炎或结节病等非感染性心肌炎。鉴于患者接受ICIs治疗这一明确的致心肌炎因素,除非患者有确切的病毒感染史或临床信息提示其他原因所致心肌炎可能,否则无需常规鉴别其他原因所致的心肌炎。
对按照ICIs相关心肌炎进行治疗无改善的患者,需要重新评估病情,再次进行相关鉴别诊断,依据医疗机构能力考虑实施EMB。
6 ICIs相关心肌炎的预防和治疗
6.1 ICIs相关心肌炎的预防
预防性应用糖皮质激素可能导致潜在的ICIs 抗肿瘤疗效下降,除非患者存在特殊适应证(如曾有输液反应或同时化疗),不推荐常规使用激素预防ICIs相关免疫不良反应[7]。
6.2 一般治疗措施
立即停用ICIs,请心血管内科医师会诊,必要时请重症医学科医师会诊。注意观察是否同时发生其他器官的免疫毒性,必要时组建多学科诊疗团队。
除亚临床心肌损伤外,患者均需卧床休息。对有心律失常和血流动力学不稳定的患者进行心电、血压、血氧监护,临时起搏指征可适当放宽,存在心力衰竭的患者按照心力衰竭指南进行处理。
对“明确的心肌炎”和经鉴别诊断后的“可能性较大的心肌炎”、“有可能的心肌炎”、“亚临床心肌损伤”患者,推荐按照以下方案进行管理(图2)。
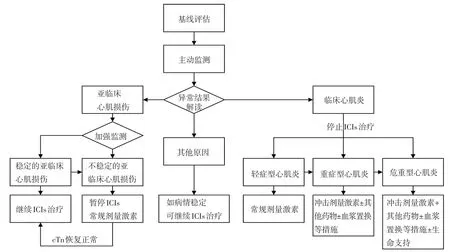
图2 ICIs相关心肌炎管理流程图
6.3 糖皮质激素
糖皮质激素应作为ICIs 相关心肌炎治疗的首选及核心方案,早期、足量的糖皮质激素有助于改善心肌炎预后,现有资料未显示激素治疗ICIs相关免疫不良反应会导致ICIs抗肿瘤疗效减弱[7,26,42-43]。
对稳定的亚临床心肌损伤(cTn保持相对稳定),糖皮质激素治疗的获益与风险尚不明确,推荐继续监测,部分患者可能并不发展为临床心肌炎[44]。
对不稳定的亚临床心肌损伤(cTn进行性升高),推荐口服泼尼松1~2 mg/kg/d,5~7 天后开始减量,首次减量25%~40%,以后每周减量一次,减量过程不宜短于4周,直至心脏损伤生物标志物恢复到基线水平后停用。
对轻症型心肌炎推荐静脉注射甲基强的松龙1~2 mg/kg/d,或视情况口服等效泼尼松5~7天(甲基强的松龙4 mg=泼尼松5 mg),病情改善后开始减量,每1~2周减量1次,减量过程不宜短于4~6周,直至心脏损伤生物标志物恢复到基线水平后停用[5-6,26]。
对重症型和危重型心肌炎患者推荐静脉注射甲基强的松龙(1 g/d)冲击治疗3~5 天,病情改善后甲基强的松龙改为1~2 mg/kg/d(视情况缓慢过渡到口服等效泼尼松),待传导阻滞及心功能恢复后开始减量,每1~2 周减量1 次,减量过程可能持续6~8 周,甚至更长,直至心脏损伤生物标志物恢复到基线水平后停用[7,26]。
在激素减量过程中,如心肌炎再次加重,可视情况选择上调激素剂量或联合吗替麦考酚酯(mycophenolate mofetil,MMF)、他克莫司、英夫利昔单抗等其中1种药物[45-46]。此后激素减量过程中缩小相邻两次激素剂量梯度,延长相邻两次减量时间间隔。
糖皮质激素治疗期间需监测血糖水平,并采取适当措施预防深静脉血栓、骨质疏松、继发细菌、真菌、肺孢子虫肺炎等机会性感染;如需预防消化性溃疡,可使用H2受体拮抗剂和胃黏膜保护剂,除非患者存在急性胃黏膜病变、消化性溃疡等治疗性适应证,否则慎用质子泵抑制剂,因后者可能缩短患者生存期[7,47]。
6.4 其他治疗方案的选择
除糖皮质激素外,其他可供选择的免疫调节治疗药物分为化学药物、生物制剂和免疫球蛋白等三类,非药物治疗手段有血浆置换和淋巴细胞清除以及生命支持治疗。
6.4.1 化学药物 1)MMF需要与糖皮质激素联合应用,常用剂量每次0.5~1.0 g,每12小时1次[7,26,43,46,48-50]。2)他克莫司需要与糖皮质激素联合应用,使用时需要监测血药浓度,如其他药物无法获得或者疗效不佳时,可在有经验的医生指导下应用[7,26,43,51]。
6.4.2 生物制剂 1)抗胸腺细胞球蛋白(antithymocyte globulin,ATG)获得多个指南或共识推荐作为ICIs相关严重心肌炎的附加治疗方案[7,26,50]。ATG的理想剂量及疗程并不确定,治疗过程中应尽量监测T淋巴细胞亚群计数,使用时需注意遵循个体化的原则,加强对不良反应的监测并预防机会性感染[45,52-53]。2)英夫利昔单抗是ICIs 相关心肌炎的二线用药推荐[7,26,50]。首次剂量5 mg/kg 静脉滴注,在2~6 周后可能需要第2 次重复应用。如果患者同时存在免疫性肝炎,则禁用英夫利昔单抗;如存在中重度心力衰竭(心功能Ⅲ~Ⅳ级且LVEF≤35%),英夫利昔单抗剂量不宜超过5 mg/kg[7,26,45,49]。最新研究提示英夫利昔单抗可能影响患者生存期[54]。3)阿仑单抗和阿巴西普均有个案报道成功救治糖皮质激素无效的严重心肌炎患者,后者由于其潜在促肿瘤生长的风险,因此建议仅在联合其他药物无效的重症型或危重型心肌炎中才能考虑应用[48,50,55]。
6.4.3 免疫球蛋白 静脉注射免疫球蛋白(intravenous immunoglobulin,IVIG)总量为2 g/kg,前2天20~40 g/d,此后改为10~20 g/d连续应用5~7天后停用[7,56-57]。
6.4.4 血浆置换和淋巴细胞清除 血浆置换和淋巴细胞清除术通过清除血浆中细胞因子、免疫复合物和激活的淋巴细胞抑制体液免疫和细胞免疫。主要用于治疗ICIs所致的重症肌无力、格林巴利综合征、肌炎、脑炎、横贯性脊髓炎等神经系统免疫不良反应[7]。临床实践中也用于ICIs相关心肌炎的治疗[45,48,58-60]。
6.4.5 生命支持治疗 在条件许可的情况下,危重型心肌炎建议转诊至拥有呼吸、循环辅助支持(如呼吸机、主动脉内球囊反搏、体外膜肺氧合等设备)的心血管专科或重症监护室。
生命支持治疗包括循环支持、呼吸支持和肾脏替代等三个方面,是危重心肌炎患者救治的关键环节,通过生命支持治疗可以使心脏得到休息,为其他治疗措施发挥作用争取时间,国内外已有基于主动脉内球囊反搏和(或)体外膜肺氧合成功救治ICIs 相关心肌炎的经验交流和文献报道[45,57-58,61]。
6.5 联合治疗方案推荐
除糖皮质激素外,尚无证据表明联合哪一类药物的疗效更优,因此选择联合药物时主要依据当地医疗机构的药物可及性和医生用药经验及判断。如果选择激素联合化学药物,不推荐同时服用MMF 和他克莫司;如果选择激素联合2 种生物制剂治疗,组合方式可以考虑ATG(或阿仑单抗或阿巴西普)联合英夫利昔单抗。
轻症型心肌炎患者接受糖皮质激素常规剂量治疗3~5 天后如病情无改善,推荐适当增加糖皮质激素剂量或增加一类其他药物(MMF或IVIG)[26]。
轻症型心肌炎患者接受糖皮质激素常规剂量治疗后如病情恶化为重症型或危重型,推荐将激素调整为冲击剂量。
重症型心肌炎患者接受糖皮质激素冲击剂量治疗24小时后如病情无改善,推荐增加1~2类其他药物联合或序贯应用(1 种化学药物或1 种生物制剂+IVIG),ATG或阿仑单抗可能优于其他生物制剂。
危重型心肌炎患者接受糖皮质激素冲击治疗24 h后如病情无改善,推荐增加1~2类甚至3类其他治疗药物(1种化学药物+1~2种生物制剂+IVIG),也可以考虑起始即选择糖皮质激素冲击剂量联合上述药物治疗。
危重型心肌炎如医疗机构条件许可且患者预期寿命较长,可以考虑联合血浆置换和淋巴细胞清除以及生命支持治疗等措施。
7 ICIs相关心肌炎的PMS
7.1 基线评估和患者教育
推荐对患者进行全面体格检查,并系统回顾疾病史、个人史和家族史。既往有心血管疾病(如高血压、冠心病、心肌梗死、心功能不全或心力衰竭、瓣膜性心脏病、心肌炎、静脉血栓栓塞症等)和糖尿病的肿瘤患者,并无证据显示不能接受ICIs治疗[34]。存在心血管疾病史或基线检查异常者需要请心血管内科医师协助评估和规范管理。
以下情况应视为暂时性禁忌证:4 周内的ACS、急性失代偿性心力衰竭或慢性心力衰竭心功能Ⅳ级、急性PE等。上述疾病需要经规范管理,病情稳定后再开始启动ICIs治疗,并密切观察病情变化。
存在自身免疫性疾病的肿瘤患者,接受CTLA-4抑制剂治疗后自身免疫状况恶化的发生率比接受PD-1/PD-L1抑制剂治疗更高。建议启动ICIs治疗之前,对自身免疫性疾病优化免疫抑制方案,目标是维持泼尼松剂量<10 mg/d(或等效激素),ICIs 治疗过程中可能需要采取更严密的监测策略[7,62]。
鉴于ICIs相关心肌炎的高致死风险,推荐对拟接受ICIs治疗的患者进行药物不良反应教育,以早期自我识别包括心肌炎在内的免疫相关不良反应症状和体征,不适就诊时应主动、及时告知ICIs治疗史。
7.2 PMS策略
推荐对接受ICIs治疗的患者采取PMS策略,使用电话、门诊或互联网诊疗平台等多种手段对患者进行定期随访,定期监测内容包括症状体征、心电图和心脏生物标志物等,超声心动图无需定期监测(图3)。
推荐所有患者在接受ICIs 治疗前完成以下项目作为基线对照:1)病史和体格检查;2)心电图、超声心动图(Simpson法测定LVEF);3)cTn、利钠肽、Mb或CK、CK-MB、D-二聚体;4)考虑测定自身免疫抗体。
推荐接受首剂ICIs注射7天后随访症状和体征,复查心电图和cTn,可以考虑联合检测利钠肽、Mb或CK。
推荐接受ICIs双周方案的患者在第2~9个治疗周期内(接受ICIs 三周方案的患者在第2~6 个治疗周期内),每次给药前均需要详细询问患者症状并行体格检查,复查心电图和cTn,可以考虑联合检测利钠肽、Mb或CK。此后每个治疗周期前均需要询问患者症状并行体格检查,复查心电图,仅在有指征时复查cTn、利钠肽、Mb或CK。

图3 ICIs相关心肌炎主动监测方案
监测中发现cTn升高(利钠肽、Mb或CK异常)或心电图有任何新出现的改变,均需暂缓ICIs 治疗,咨询心血管内科医师,必要时进一步检查明确原因。
对确定为ICIs 相关的亚临床心肌损伤,推荐将cTn 和心电图监测频率增加,至少每周1 次,连续数周,如cTn水平恢复到基线或保持相对稳定且无新出现的心电图或影像学异常,可将监测频率降低到每个治疗周期前1次。
推荐在激素减量期间每周随访1次,内容包括症状体征、心电图和心脏生物标志物,部分患者可能在减量过程中出现免疫不良事件急剧恶化[56,63]。
推荐在激素停用后的3 个月内,至少每2~3周随访1 次,内容包括症状体征、心电图和心脏生物标志物。
8 关于重启ICIs治疗的建议
8.1 亚临床心肌损伤患者重启ICIs治疗的建议
1)cTn 恢复到基线水平后,可以重启ICIs 治疗;2)接受1种ICIs治疗的患者,如再次出现稳定的亚临床心肌损伤,可以在严密观察下继续ICIs 治疗;3)接受1种ICIs治疗的患者,继续原ICIs治疗后如再次出现持续进展的亚临床心肌损伤,再次治愈后考虑更换其他ICIs;4)原方案为PD-1 或PD-L1 抑制剂联合CTLA-4抑制剂治疗者,由肿瘤科医师及患者共同讨论决定,参考上述重启策略,或考虑改为抗PD-1 或抗PD-L1单药治疗。
8.2 明确诊断的心肌炎治愈后重启ICIs治疗的建议
任何程度的ICIs 相关心肌炎在未彻底治愈前均不推荐重启ICIs治疗,治愈后重启ICIs治疗的安全性未知,G2 级以上心肌炎通常不建议重启ICIs 治疗[7,26]。鉴于已有文献报道心肌炎治愈后重启ICIs治疗,在随访时间内未出现心肌炎复发[11,64-65]。如患者无其他替代治疗方案,确需重启ICIs 治疗,应由心血管内科医师和肿瘤科医师及患者共同讨论后决定。此外,原方案为PD-1 或PD-L1 抑制剂联合CTLA-4抑制剂治疗者可以考虑改为抗PD-1 或抗PD-L1 单药治疗[50]。
8.3 重启ICIs治疗后的注意事项
所有重启ICIs治疗的患者均需更密切观察症状变化及增加心脏生物标志物监测频率,个别患者可能在重启ICIs治疗时出现免疫不良事件急剧恶化[63]。再次出现ICIs相关心肌炎则必须永久停用ICIs[7]。
9 非ICIs相关心肌炎的心血管不良反应
由于肿瘤患者可能存在自身心血管疾病或在ICIs治疗前接受过其他抗肿瘤治疗,所以ICIs治疗后出现的心血管并发症并非一定为ICIs相关心肌炎,临床上需加以甄别。具体存在以下可能:1)ICIs相关心肌炎的外在临床表型;2)ICIs相关的非心肌炎心血管毒性反应;3)既往或目前联合其他抗肿瘤方案所致的心血管并发症;4)与肿瘤转移、浸润、压迫等相关的心血管并发症;5)原有心血管疾病的进展(与抗癌方案无关的)。
ICIs相关的免疫性心包炎、心包积液和心包填塞亦有文献报道,不易与肿瘤转移、进展或感染等其他原因鉴别,心包活检有助于诊断。确诊病例需暂缓使用ICIs,糖皮质激素治疗有效,秋水仙碱和非甾体抗炎药作为附加治疗可能是有益的,预后相对较好,病情控制后可以考虑重启ICIs治疗[27,66-67]。有研究提示ICIs也可能加速动脉粥样硬化进展,增加心血管事件(心肌梗死、冠状动脉血运重建和缺血性卒中)发病风险[68]。
静脉血栓栓塞、高血压、非心肌炎相关的心律失常、应激性心肌病等与ICIs免疫毒性的相关性并不能完全确立。接受ICIs 治疗后出现的非免疫性心血管不良反应,不建议应用激素等免疫调节治疗,可以按照传统心血管疾病治疗方案进行管理,如临床状态稳定,可以继续ICIs治疗。
10 结语
心肌炎是ICIs相关的高致死性免疫不良反应,因症状不典型,确诊时通常为严重阶段,采用PMS策略可以及时发现亚临床心肌损伤或轻症型心肌炎,有望减少严重心肌炎的发生。早期、足量的糖皮质激素有助于改善患者预后,危重患者常需联合多种药物和非药物治疗措施,重启ICIs治疗需遵循个体化的原则,平衡患者肿瘤治疗的风险和获益,避免出现治疗肿瘤却加速患者死亡现象。
专家共识委员会
顾问(按姓氏拼音排序):
韩雅玲 张运
发起人/组长:
张志仁
副组长(按姓氏拼音排序):
李悦 刘斌 刘基巍 夏云龙
起草专家:
邵群 张宇辉
核心专家(按姓氏拼音排序):
卜 军 上海交通大学医学院附属仁济医院
蔡 莉 哈尔滨医科大学附属肿瘤医院
曹 丰 中国人民解放军总医院
陈佳艺 上海交通大学医学院附属瑞金医院
程蕾蕾 复旦大学附属中山医院
李 悦 哈尔滨医科大学附属第一医院
李志高 哈尔滨医科大学附属肿瘤医院
刘 斌 吉林大学第二医院
刘基巍 大连医科大学附属第一医院
刘 彤 天津医科大学第二医院
刘 莹 大连医科大学附属第一医院
马 飞 中国医学科学院肿瘤医院
邵 群 哈尔滨医科大学附属肿瘤医院
王 军 河北医科大学第四医院
夏云龙 大连医科大学附属第一医院
谢晓冬 中国人民解放军北部战区总医院
于世英 华中科技大学同济医学院附属同济医院
张爱启 哈尔滨医科大学附属第二医院
张宇辉 中国医学科学院阜外医院
张志仁 哈尔滨医科大学附属肿瘤医院
郑桐森 哈尔滨医科大学附属肿瘤医院
特邀指导专家(按姓氏拼音排序):
巴 一 天津医科大学肿瘤医院
李 洋 哈尔滨医科大学附属第二医院
廖中凯 中国医学科学院阜外医院
马 军 哈尔滨血液病肿瘤研究所
秦叔逵 中国人民解放军东部战区总医院秦淮医疗区
任秀宝 天津医科大学肿瘤医院
石远凯 中国医学科学院肿瘤医院
汪道文 华中科技大学同济医学院附属同济医院
王长利 天津医科大学肿瘤医院
王晓稼 中国科学院大学附属肿瘤医院
张 力 中国医学科学院北京协和医院
张 庆 四川大学华西医院
张 瑶 哈尔滨医科大学附属第二医院
周彩存 上海市肺科医院
专家组成员(按姓氏拼音排序):
巴 一 天津医科大学肿瘤医院
白 明 兰州大学第一医院
卜 军 上海交通大学医学院附属仁济医院
蔡菁菁 中南大学湘雅三医院
蔡 莉 哈尔滨医科大学附属肿瘤医院
曹 丰 中国人民解放军总医院
曹军宁 复旦大学附属肿瘤医院
曹 璐 上海交通大学医学院附属瑞金医院
陈佳艺 上海交通大学医学院附属瑞金医院
陈 静 华中科技大学同济医学院附属协和医院
陈小兵 河南省肿瘤医院
陈占红 中国科学院大学附属肿瘤医院
程蕾蕾 复旦大学附属中山医院
程 文 哈尔滨医科大学附属肿瘤医院
付真彦 新疆医科大学第一附属医院
葛 红 河南省肿瘤医院
公永太 哈尔滨医科大学附属第一医院
关晓军 哈尔滨血液病肿瘤研究所
韩雅玲 中国人民解放军北部战区总医院
何金汗 四川大学华西医院
胡金柱 南昌大学第二附属医院
胡 威 遵义医科大学第二附属医院
黄 辉 中山大学附属第八医院
黄明光 山西省肿瘤医院
黄峥嵘 厦门大学附属第一医院
姜永生 华中科技大学同济医学院附属同济医院
蒋 彬 苏州大学附属第一医院
蒋建刚 华中科技大学同济医学院附属同济医院
景红梅 北京大学第三医院
李安华 中山大学肿瘤防治中心
李殿富 江苏省人民医院
李晓玲 辽宁省肿瘤医院
李旭平 中南大学湘雅二医院
李 洋 哈尔滨医科大学附属第二医院
李 悦 哈尔滨医科大学附属第一医院
李志高 哈尔滨医科大学附属肿瘤医院
廖中凯 中国医学科学院阜外医院
刘 斌 吉林大学第二医院
刘海霞 重庆大学附属肿瘤医院
刘 红 天津医科大学肿瘤医院
刘基巍 大连医科大学附属第一医院
刘 健 福建省肿瘤医院
刘 通 哈尔滨医科大学附属肿瘤医院
刘 彤 天津医科大学第二医院
刘 彦 The University of Texas Dell Medical School,USA
刘 莹 大连医科大学附属第一医院
刘兆喆 中国人民解放军北部战区总医院
刘志忠 南京医科大学附属南京医院
刘子玲 吉林大学第一医院
卢学春 中国人民解放军总医院第二医学中心
马 飞 中国医学科学院肿瘤医院
马 恒 空军军医大学基础医学院
马 军 哈尔滨血液病肿瘤研究所
毛爱红 甘肃省肿瘤医院
庞 慧 哈尔滨医科大学附属肿瘤医院
千年松 中国人民解放军总医院
秦叔逵 中国人民解放军东部战区总医院秦淮医疗区
邱春光 郑州大学第一附属医院
任秀宝 天津医科大学肿瘤医院
邵 群 哈尔滨医科大学附属肿瘤医院
沈甫明 同济大学附属第十人民医院
石远凯 中国医学科学院肿瘤医院
宋国红 北京大学肿瘤医院
孙冬冬 空军军医大学第一附属医院
汪 成 上海交通大学医学院附属第九人民医院黄浦分院
汪道文 华中科技大学同济医学院附属同济医院
王长利 天津医科大学肿瘤医院
王 锋 中国人民解放军东部战区总医院秦淮医疗区
王 军 河北医科大学第四医院
王立新 河北省沧州中西医结合医院
王 涟 南京大学医学院附属鼓楼医院
王群山 上海交通大学医学院附属新华医院
王 殊 北京大学人民医院
王晓稼 中国科学院大学附属肿瘤医院
王 颖 重庆大学附属肿瘤医院
王 政 黑龙江省医院
王智慧 吉林大学第二医院
吴 钢 武汉大学人民医院
伍伟锋 广西医科大学第一附属医院
夏云龙 大连医科大学附属第一医院
谢晓冬 中国人民解放军北部战区总医院
徐 明 北京大学第三医院
徐向英 中山大学附属第三医院
闫承慧 中国人民解放军北部战区总医院
杨金亮 四川大学华西医院
杨 谨 西安交通大学第一附属医院
杨润祥 云南省肿瘤医院
杨 爽 哈尔滨医科大学附属第二医院
姚和瑞 中山大学孙逸仙纪念医院
于建渤 牡丹江医学院附属红旗医院
于世英 华中科技大学同济医学院附属同济医院
余 华 中国科技大学附属第一医院
袁中玉 中山大学肿瘤防治中心
曾春雨 陆军军医大学大坪医院
张爱启 哈尔滨医科大学附属第二医院
张国强 哈尔滨医科大学附属肿瘤医院
张海涛 中国医学科学院阜外医院
张红梅 空军军医大学第一附属医院
张红霞 哈尔滨医科大学附属肿瘤医院
张会来 天津医科大学肿瘤医院
张冀东 河北医科大学第二医院
张 力 中国医学科学院北京协和医院
张 梅 山东大学齐鲁医院
张 庆 四川大学华西医院
张 然 中国人民解放军总医院
张 瑶 哈尔滨医科大学附属第二医院
张英梅 复旦大学附属中山医院
张宇辉 中国医学科学院阜外医院
张 运 山东大学齐鲁医院
张志仁 哈尔滨医科大学附属肿瘤医院
郑桐森 哈尔滨医科大学附属肿瘤医院
钟久昌 首都医科大学附属北京朝阳医院
周彩存 上海市肺科医院
周 宁 华中科技大学同济医学院附属同济医院
朱天刚 北京大学人民医院
秘书组:
李慧妍 哈尔滨医科大学附属肿瘤医院
张美岭 哈尔滨医科大学附属肿瘤医院
孙宇飞 哈尔滨医科大学附属肿瘤医院

