P2RY6在非小细胞肺癌中的表达和临床意义分析*
周永生 熊延路 冯杨波 乔天运 赵晋波 雷杰 姜涛 韩勇②
肺癌死亡率居恶性肿瘤之首[1-4],其中大部分是非小细胞肺癌(non-small cell lung cancer,NSCLC)[5],主要分为肺腺癌和肺鳞癌。多数患者首次确诊已经处于晚期,失去手术治疗机会且5年生存率较低[6]。目前,已经发现许多关于肺腺癌的突变基因,相关靶向药物也取得了较好的临床疗效,如克唑替尼、奥希替尼等[7-11]。但肺癌患者总体的治愈率和生存率仍然较低[5-6,12]。同时,相对于肺腺癌,发现的肺鳞癌驱动基因较少,有待继续寻找和研究新的突变基因,为潜在的治疗靶点提供线索。
P2Y6受体是P2RY6基因的转录产物,属于P2受体家族中的G蛋白偶联受体,可以被细胞外核苷酸激活。P2Y6受体广泛表达于多种组织,并参与包括气道炎症反应在内的多种反应[13]。在肿瘤研究方面,因肿瘤微环境中存在大量细胞外ATP、腺苷、UDP 和其他核苷酸[14-15],P2Y受体家族在乳腺癌中的研究得到广泛关注[16]。在原发性肝癌中,P2X4和P2X7受体可能与癌症的发生发展存在相关性[17]。近年来,P2Y6受体在结直肠癌和胃癌中被发现具有相反的作用[18]。在结直肠癌中,P2Y6受体通过抑制细胞凋亡来诱导癌变,而P2Y6受体通过降低β-catenin转录活性抑制胃癌的生长[18-20]。肺癌相关研究也发现了P2受体家族的功能,如P2Y受体可能介导肿瘤微环境中ATP对肿瘤生长的激活作用,促进肿瘤细胞存活,并调节DNA损伤修复[21-23]。P2Y6受体参与了NSCLC 间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)抑制剂耐药性的形成[24]。但P2RY6基因与NSCLC的临床相关性以及与患者生存之间的关系尚缺乏充分的研究。本研究通过癌症基因组图谱计划(The Cancer Genome Atlas Program,TCGA)数据库和基因表达集(Gene Expression Omnibus,GEO)数据库以及通过病理标本的免疫组织化学法检测,探索NSCLC中P2RY6的表达量的临床相关性以及与患者生存之间的关系,为探索NSCLC的发病机制、寻找新的防治方法提供参考。
1 材料与方法
1.1 病例资料
从GEO数据库(https://www.ncbi.nlm.nih.gov/gds)中检索得到GSE18842、GSE10072、GSE19804、GSE32863、GSE33532、GSE40275、GSE74706、GSE102287、GSE 21933、GSE33479、GSE8569、GSE62113数据集,见表1。用于比较NSCLC 患者的癌组织与癌旁组织基因表达差异。
从TCGA 数据库(http://cancergenome.nih.gov)中获得包含288 例肺鳞癌样本、253 例肺腺癌样本的完整临床信息和生存期数据的数据集,以及匹配的58例肺腺癌和51例肺鳞癌癌旁组织的基因表达谱。

表1 GEO数据库NSCLC、肺腺癌和肺鳞癌数据集
肺鳞癌和肺腺癌组织来源于空军军医大学唐都医院,P2RY6 抗体购自美国Affinity Biosciences 公司(DF6956);辣根过氧化物酶标记的二抗购自美国Servicebio 公司(G23303)。本研究涉及的病理标本的使用均符合本机构伦理委员会的伦理标准。
1.2 方法
1.2.1 免疫组织化学 将石蜡包埋的肺鳞癌和肺腺癌组织切片在二甲苯和梯度乙醇中脱蜡,并在磷酸盐缓冲液中冲洗;预处理后,以3%过氧化氢处理25 min以抑制内源性过氧化物酶;使用牛血清白蛋白封闭;P2RY6 一抗孵育;磷酸盐缓冲液洗涤后用辣根过氧化物酶标记的二抗孵育;二氨基联苯胺和底物显色剂显色。
1.2.2 分组方法 根据P2RY6表达的中位数将患者分为P2RY6高表达组和低表达组。根据患者年龄的中位数,分为高年龄组和低年龄组;在肺鳞癌患者中,>68岁为高年龄组,≤68岁为低年龄组;在肺腺癌患者中,>66岁为高年龄组,≤66岁为低年龄组。根据国际抗癌联盟(UICC)第8版TNM肺癌分期系统进行分期。
1.3 统计学分析
采用SPSS 24.0 软件进行统计学分析。应用GraphPad Prism 8软件进行绘图。采用KS检验对P2RY6表达量进行正态性检验。采用符号秩检验或秩和检验分析癌组织与癌旁组织基因表达差异。采用χ2检验分析P2RY6的表达与临床特征的关系。采用Kaplan-Meier法、Log-rank检验和Cox比例风险回归模型对总生存期和无进展生存期分别进行单因素和多因素生存分析,并对分析结果进行假设检验。以P<0.05 为差异具有统计学意义。
2 结果
2.1 TCGA 数据库肺腺癌及肺鳞癌数据集中P2RY6的表达
采用正态分布Q-Q图及直方图对TCGA数据库肺腺癌及肺鳞癌数据集中P2RY6表达量的分布特征进行观察(图1),同时采用KS检验进行正态性检验,发现在肺鳞癌和肺腺癌患者的癌组织中P2RY6表达量呈偏态分布,不服从正态分布(P<0.000 1)。基于数据特征,采用符号秩检验分析TCGA数据库肺腺癌及肺鳞癌数据集中58例肺腺癌患者和51例肺鳞癌患者的癌组织与癌旁组织基因表达差异,发现在肺腺癌和肺鳞癌患者中,癌组织中P2RY6表达显著高于癌旁组织(P<0.001)。
2.2 GEO数据库中P2RY6在NSCLC中的表达
为进一步明确P2RY6 在NSCLC 中的表达情况,在GEO数据库的多个数据集中进行了验证。基因芯片的数据常呈偏态分布,且在样本量较大的TCGA数据库肺腺癌和肺鳞癌数据集中,P2RY6 表达量呈偏态分布,而GEO 数据库的数据集样本量相对较小。为避免统计学方法带来的误差,采用符号秩检验等非参数检验在GEO 数据库中的GSE40275、GSE 74706、GSE102287、GSE62113、GSE33532、GSE18842数据集中,对P2RY6 在NSCLC 患者中的表达差异进行验证,发现P2RY6 在癌组织中表达高于较癌旁组织(P<0.001)。在GSE74706、GSE19804、GSE10072、GSE32863、GSE33479、GSE21933、GSE8569 数 据 集中,采用符号秩检验或秩和检验对P2RY6 基因在肺腺癌和肺鳞癌中的表达差异进行验证,发现在两者中P2RY6 表达均高于癌旁组织。在GSE21933、GSE8569 数据集中,采用秩和检验对P2RY6 表达量在肺腺癌和肺鳞癌之间的表达差异进行验证,发现两者之间差异无统计学意义(图2)。
2.3 病理标本肺鳞癌和肺腺癌中P2RY6的表达
为了进一步验证结果,通过免疫组织化学方法对空军军医大学唐都医院实验室储存的肺鳞癌以及肺腺癌病理组织中P2RY6 的表达情况进行分析,结果显示肺鳞癌和肺腺癌的癌组织中P2RY6表达量均高于癌旁组织(图3)。
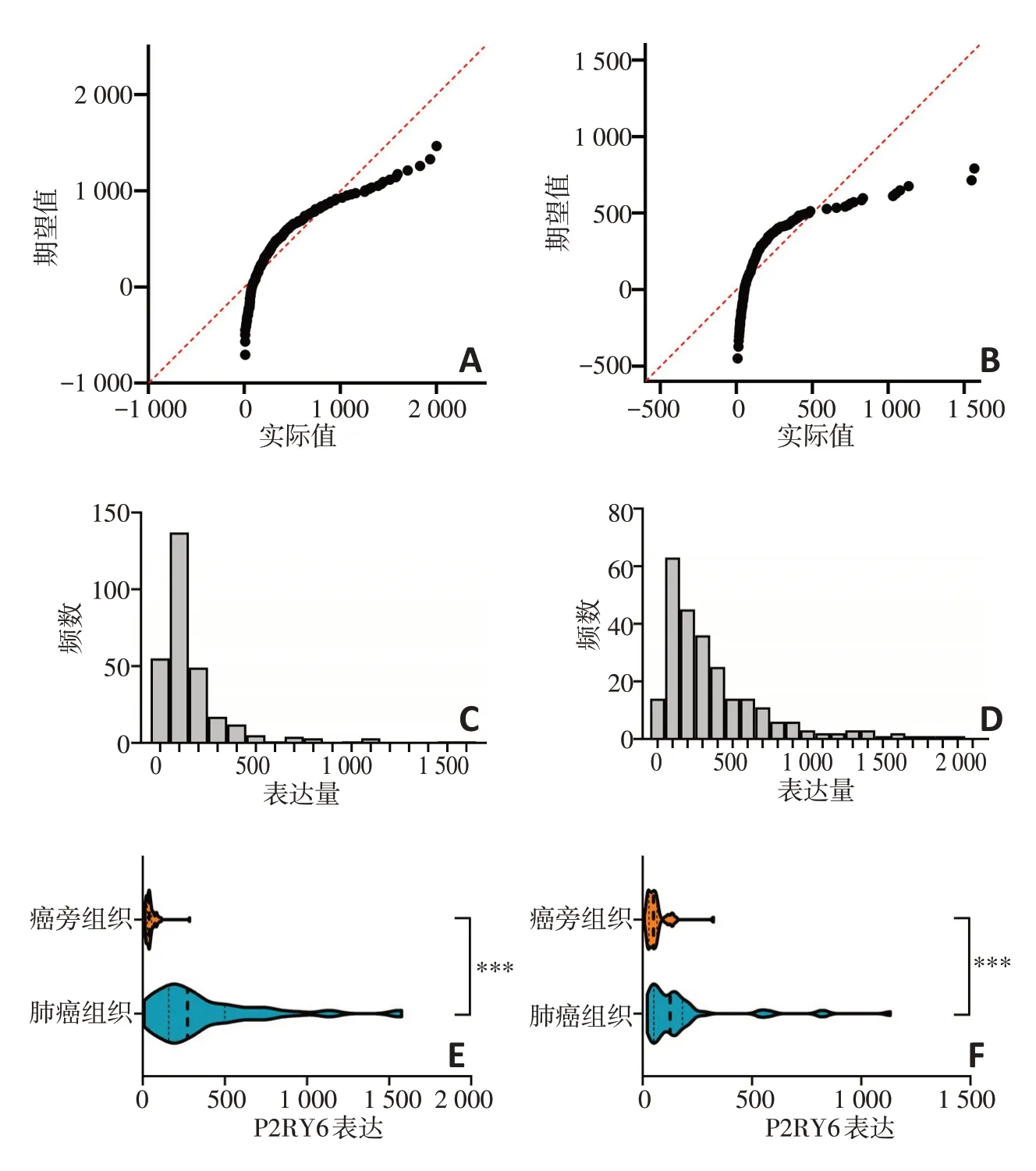
图1 ATCGA中P2RY6在肺鳞癌及肺腺癌中的表达
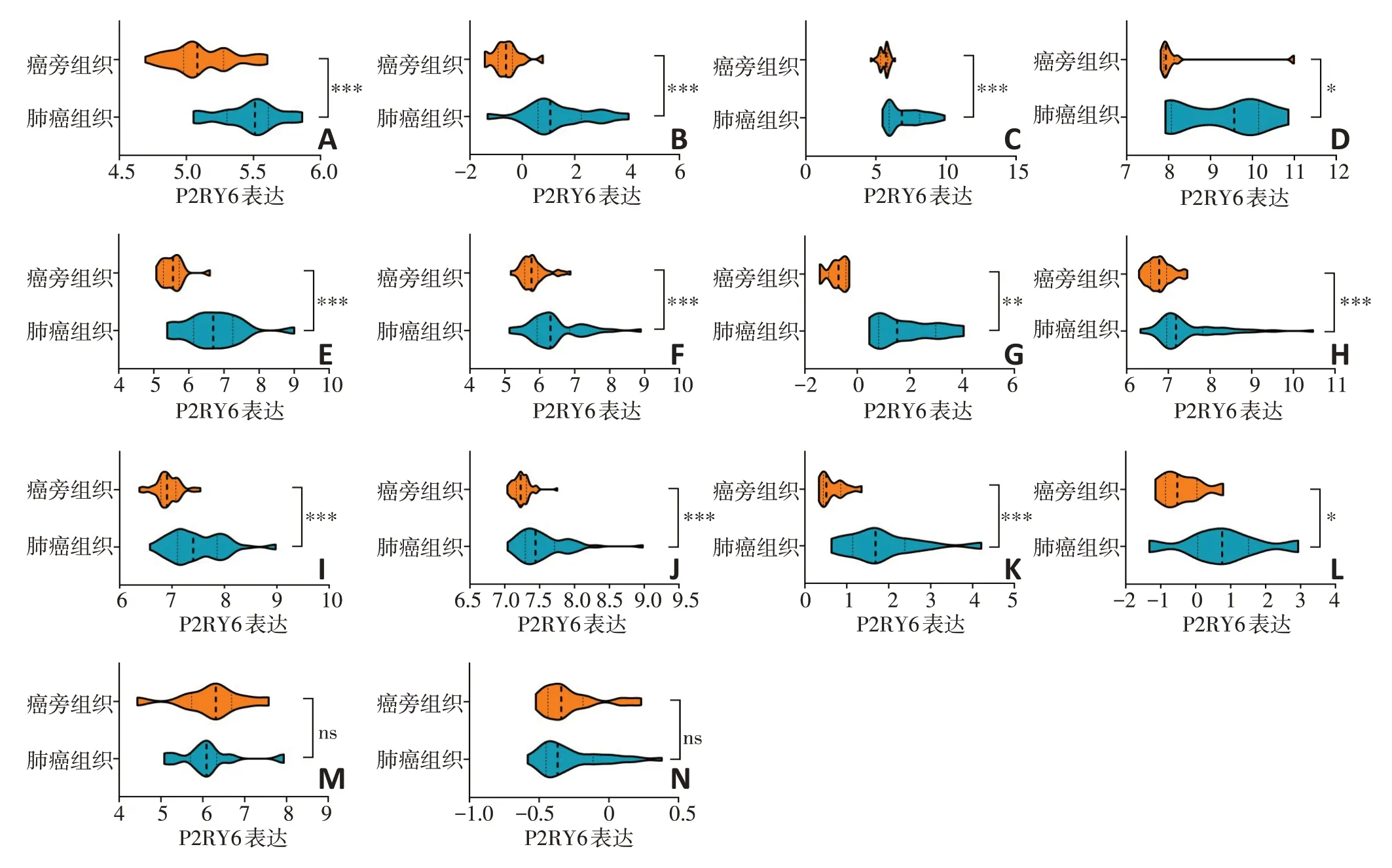
图2 GEO中P2RY6的表达谱
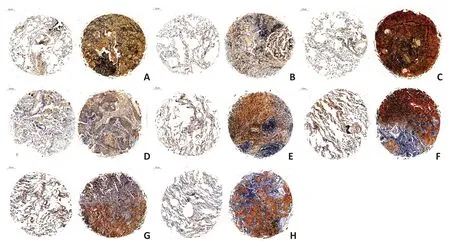
图3 病理标本中肺鳞癌和肺腺癌的癌组织与癌旁组织的免疫组织化学图
2.4 肺腺癌和肺鳞癌中P2RY6表达与临床特征的关系
在TCGA数据库肺腺癌以及肺鳞癌数据集中,采用χ2检验分析P2RY6的表达与肺鳞癌和肺腺癌患者的年龄、性别、TNM 分期、病理分期等临床特征的关系。结果显示肺腺癌患者P2RY6表达与性别显著相关(P=0.020),相较于肺腺癌男性患者,女性患者P2RY6 高表达,但肺腺癌患者P2RY6 表达与患者年龄、TNM 分期和病理分期无显著相关性。P2RY6 表达与肺鳞癌患者年龄、性别、TNM分期和病理分期均无显著相关性(P>0.05,表2,3)。

表2 P2RY6表达与肺鳞癌临床病理特征相关性 例
2.5 P2RY6表达与肺腺癌和肺鳞癌患者生存的关系
进一步分析P2RY6表达与肺鳞癌和肺腺癌患者生存的相关性。在TCGA 数据库肺腺癌以及肺鳞癌数据集中通过绘制Kaplan-Meier 生存曲线和采用Log-rank 进行检验,结果表明P2RY6 的表达与肺鳞癌患者的总生存期(P=0.010 1)和无进展生存期(P=0.014 8)显著相关,Kaplan-Meier 生存曲线趋势也提示P2RY6高表达的肺鳞癌患者生存期低于P2RY6低表达患者,而肺腺癌中P2RY6 表达对患者生存期无显著影响(图4)。
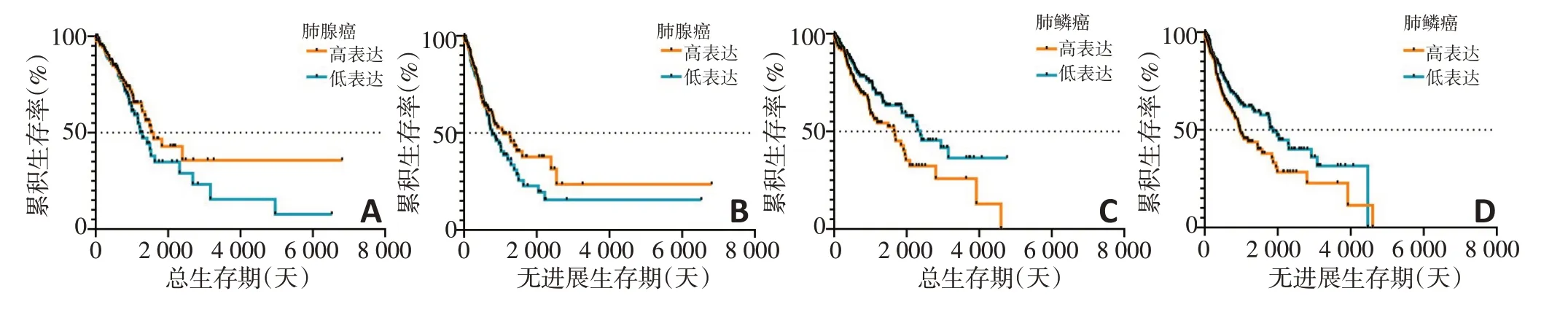
图4 TCGA肺腺癌与肺鳞癌数据中P2RY6表达和生存之间的关系
2.6 肺鳞癌患者生存影响因素
采用Cox比例风险回归模型进行单因素分析。结果表明,P2RY6表达影响肺鳞癌患者的总生存期和无进展生存期。P2RY6高表达是影响肺鳞癌患者总生存期和无进展生存期的危险因素。多因素分析显示,P2RY6表达是影响肺鳞癌患者总生存期和无进展生存期的独立危险因素,P2RY6高表达的肺鳞癌患者的总生存期(P=0.004;HR=1.765,95%CI:1.199~2.598)和无进展生存期(P=0.007;HR=1.765,95%CI:1.199~2.598)较低表达患者更短(表4,5)。
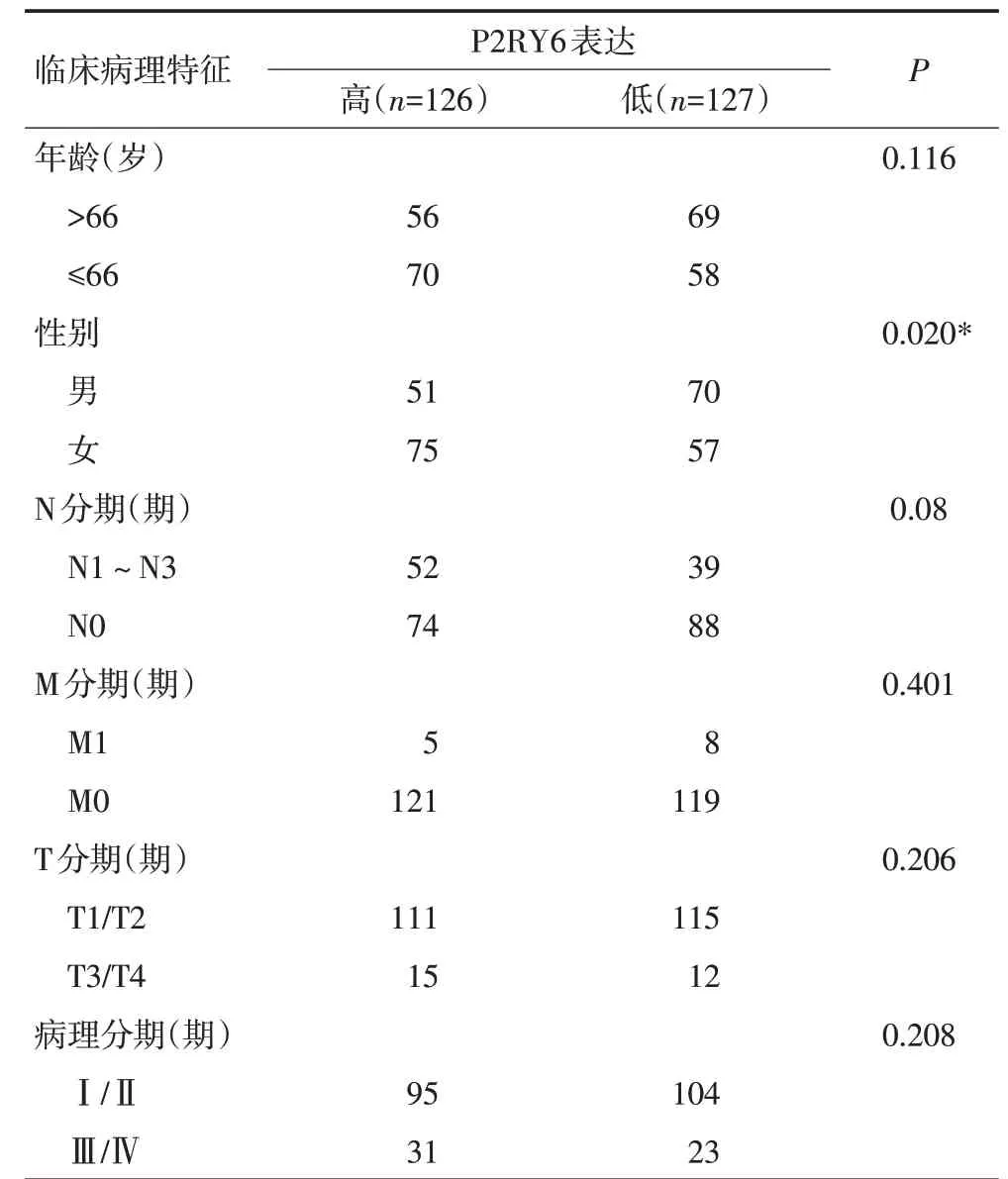
表3 P2RY6表达与肺腺癌临床病理特征相关性 例

表4 TCGA数据库肺鳞癌数据集中肺鳞癌患者总生存期影响因素的比例风险回归模型
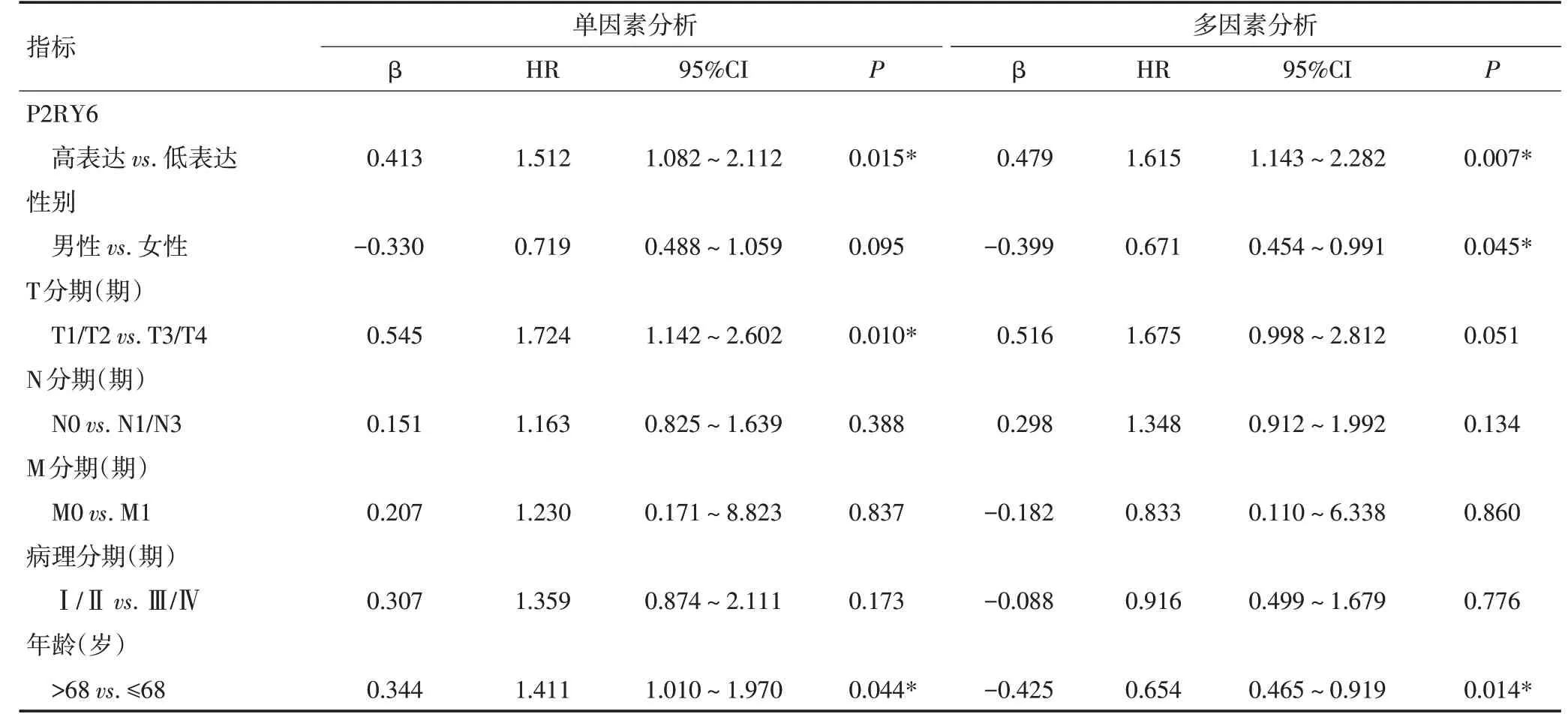
表5 TCGA数据库肺鳞癌数据集中肺鳞癌患者无进展生存期影响因素的比例风险回归模型
3 讨论
不同类型肺癌的驱动基因不同,肺腺癌多为EGFR、ALK 等,肺鳞癌常见的驱动基因为FGFR1等[25]。驱动基因的差异并不能完全作为肺癌的分类指标,不同类型肺癌很可能存在不同的驱动基因。不同类型肺癌之间的异质性以及同一类型肺癌中驱动基因的异质性,导致了并非所有的肺癌患者均能从靶向药物中获益,肺癌总治愈率仍然较低,因此研究不同类型肺癌的不同驱动基因可能会为未来的治疗提供线索。
P2Y6受体广泛表达于心脏、肺、脾脏、小肠、主动脉、胎盘以及部分大脑区域[26]。P2Y6受体激活参与了血管炎性反应,并通过增强巨噬细胞的促炎性反应,在动脉粥样硬化病变的发展中发挥不同作用[27-28]。小胶质细胞中P2Y6的激活增强了其对损伤神经元的吞噬作用,参与神经损伤修复的炎症反应过程[29]。在疼痛研究中,P2Y6 在脊髓节段通过星形胶质细胞参与神经性疼痛的维持,但该作用尚存在争议[30-31]。在胃肠道肿瘤中,P2Y6 表现出相反的作用,P2Y6 受体在结直肠癌中通过抑制细胞凋亡来诱导癌变,而P2Y6受体通过降低β-catenin转录活性抑制胃癌的生长[18]。近期有研究表明,在肺癌中,P2Y6受体在促进癌细胞存活和ALK抑制剂的耐药性中发挥重要的作用[23-24]。但目前聚焦于P2RY6 表达与NSCLC 患者临床特征和生存之间相关性的研究较少。靶向肿瘤致病基因的治疗在临床上取得了较好的疗效,然而相关研究主要集中在肺腺癌,如克唑替尼等。鳞癌中靶向药物相对较少,且肺癌患者的预后仍无显著改善。癌基因的激活和抑癌基因的失活是肿瘤发生发展的重要原因,然而肿瘤的异质性限制了相关基因的研究。近年来,基因芯片和二代测序等技术,使研究者可以高效地研究肿瘤基因表达谱,同时GEO、TCGA 数据库收录了大量的基因和临床信息,促进了肿瘤相关基因的研究,为发现更多的肿瘤相关基因以及潜在药物靶点提供了可能。
本研究发现,TCGA 数据库中,肺腺癌和肺鳞癌患者癌组织中P2RY6表达均高于癌旁组织。为排除个体差异导致的抽样误差,在GEO 数据库中进行了广泛的验证,在GEO数据库的多个数据集中,NSCLC患者癌组织中P2RY6表达均高于癌旁组织。进一步亚组分析,发现肺腺癌和肺鳞癌中癌组织P2RY6 的表达量高于癌旁组织,但P2RY6 表达在肺鳞癌与肺腺癌之间未发现显著性差异。通过肺腺癌和肺鳞癌的病理标本对数据库中得到的结果进行验证,发现在肺腺癌以及肺鳞癌的癌组织中,P2RY6 的表达量明显高于癌旁组织。上述研究均提示,P2RY6 可能在NSCLC 中扮演癌基因的角色,同时提示其可能与肺腺癌和肺鳞癌的临床特征以及生存预后相关。
本研究发现,在TCGA数据库中P2RY6表达量与肺腺癌和肺鳞癌临床特征以及患者生存存在相关性。单因素生存分析提示,在肺鳞癌中,相较于P2RY6 低表达患者,高表达患者总体生存期和无进展生存期更短。多因素生存分析提示,P2RY6 高表达是肺鳞癌患者的独立危险因素,进一步提示P2RY6 在肺鳞癌中可能是致病基因。在肺腺癌中,单因素生存分析未提示P2RY6 与患者的生存相关。但χ2检验提示,肺腺癌中,女性患者P2RY6表达高于男性患者,提示该基因在腺癌患者中可能存在性别差异。上述研究结果均提示,P2RY6 可能在肺鳞癌的发生发展中扮演重要角色,并影响患者的预后,为探索肺鳞癌病理机制提供一定参考。
传统研究中,根据癌症相关基因是否促进或抑制肿瘤发生,通常将其分为癌基因和抑癌基因,但这种二分类法并不能准确全面地概括某一癌症相关基因的全貌。在基因层面,经典的p53基因在早期曾被认为是癌基因[32],但后来发现其野生型发挥抑癌基因的作用。在蛋白质层面,同一基因编码的蛋白产物在不同状态下发挥不同作用。如转录因子KLF5,根据其乙酰化状态可以分别发挥促肿瘤或抗肿瘤的作用[33]。因此,同一基因功能的差异可能发生在DNA、RNA 以及蛋白质等各个层面[34]。正如在胃肠道肿瘤中,P2RY6 在胃癌与结直肠癌中具有不同的作用一样[18],P2RY6 在同一系统的不同肿瘤中发挥不同的作用,可能是由于其在肺鳞癌与肺腺癌中发挥作用的通路不同,但目前尚缺乏相关的研究。
本研究推测,P2RY6 很可能在肺鳞癌中通过抑制细胞凋亡、促进细胞增殖等方式促进肿瘤的发生发展,进而导致患者生存率降低。而在肺腺癌中,可能由于其他更为重要的信号通路存在,进而掩盖了P2RY6 在肺腺癌中的作用。除此之外,也可能由于P2RY6 在肺鳞癌中发挥作用的通路与肺腺癌不同,从而在肺腺癌中不发挥癌基因的作用。因此,尽管本研究发现P2RY6 在肺鳞癌和肺腺癌中均高表达,但是其仅在肺鳞癌中是患者预后的独立危险因素,但仍需进一步研究阐明其作用存在差异的原因。
本研究具有一定的局限性,首先需要进一步扩大样本量以应对肿瘤广泛的异质性,另外缺乏系统的体外细胞、体内动物研究和相应分子机制研究,本课题组将在今后的工作中进一步完善。
综上所述,P2RY6在NSCLC中普遍高表达,且在肺腺癌和肺鳞癌中均高表达,同时与肺鳞癌患者的生存密切相关,P2RY6 高表达的肺鳞癌患者具有更差的临床预后和更短的生存期。

