强骨饮调节破骨细胞外泌体影响成骨细胞分化的初步研究
唐彬彬 刘康 吴连国 史晓林
浙江中医药大学附属第二医院骨科,浙江 杭州 310005
骨质疏松症(osteoporosis,OP)是一种破骨细胞(osteoclast,OC)和成骨细胞(osteoblasts,OB)分化动态平衡失调的病理状态。研究报道,OC来源的外泌体可通过传递micro-RNA(以下称miRNA)至OB中抑制OB分化,进一步加重OP[1]。Wnt/β-catenin通路可促进骨髓间充质干细胞(BMSCs)向OB方向分化,负责OB的增殖和分化,也可抑制OC分化,在骨生长和骨密度维持中具有重要调控作用[2-3]。miRNA与wnt/β-catenin通路关系密切,可调控OB分化增殖。中药复方强骨饮治疗原发性I型骨质疏松症具有促进OB活性,增加骨量,抑制OC活性,减少骨吸收的多靶点特点[4-5]。基于以上研究,本研究拟初步研究强骨饮含药血清改善破骨细胞外泌体影响成骨细胞分化的内在机制。
1 材料和方法
1.1 实验动物
12周龄清洁级雌性SD大鼠10只(批号:SYXK鄂,2018-0101),体重在280~300 g。
1.2 主要试剂和仪器
1.2.1试剂:巨噬细胞集落刺激因子(M-CSF,PEPROTECH,315-02),核因子κ B受体活化因子配体(RANKL,R&D,462-TR-010),小鼠单核巨噬细胞白血病细胞(RAW 264.7,武汉普诺赛,CL-0190),小鼠骨髓间充质干细胞(BM-MSC,武汉普诺赛,CP-M131),成骨诱导液(赛业生物,MUCMX-90021),抗酒石酸酸性磷酸酶染色试剂盒(TRAP,碧云天,P0332),碱性磷酸酶测试盒(ALP,南京建成,A059-2),外泌体抗体CD9(Abcam,ab92726)、CD63(Abcam,ab217345)、CD81(Abcam,ab109201),β环状蛋白(β-catenin,Abcam,ab16051)。
1.2.2仪器:倒置拍照显微镜(Leica,IX51),垂直电泳槽(北京六一仪器厂,DYCZ-24DN),水平摇床(江苏海门其林贝尔仪器制造有限公司,TS-1),磁力搅拌器(江苏省金坛市中大仪器,T8-1)。
1.3 含药血清制备
将大鼠随机分为2组:对照血清组和含药血清组。一副药浓缩至22.2 mL(含生药量245 g,包含防风15 g、黄芪30 g、忍冬藤25 g、露蜂房20 g、杜仲15 g、肉桂10 g、川芎20 g、川续断30 g、骨碎补20 g、鸡血藤25 g、秦艽15 g、鹿角霜20 g),参考临床成人用量换算成大鼠后的10倍剂量,并按体表面积换算,大鼠所需药量为70 kg成人的6.3倍,即每千克大鼠每天灌胃剂量:245 g/70 kg×6.3×10=220.5 g/kg。大鼠灌胃剂量为20 mL/(kg·d),每天灌胃两次[每次灌胃量为10 mL/kg(含生药量110.25 g)],对照血清组采用生理盐水灌胃,连续灌胃3 d,最后一次给药后1~2 h采血(摘眼球取血,无菌操作)。分离血清,于56 ℃水浴灭活30 min,以0.22 μm滤器灭菌消毒,置于-20 ℃冰箱冻存备用。
1.4 构建OC和OB分化模型
构建OC模型采用M-CSF(20 ng/mL)、RANKL(50 ng/mL)处理RAW264.7细胞进行诱导;构建OB模型采用成骨诱导液处理的小鼠骨髓间充质干细胞(BM-MSC)进行诱导。
1.5 实验指标检测方法
1.5.1OC模型TRAP染色。设1组为单纯RAW264.7细胞,2组为OC模型加入对照血清,3组为OC模型加入含药血清。对照血清和含药血清另设2%、5%、10%、15%和20% 5种血清浓度,血清处理3 d。细胞诱导结束后,每孔(96孔板,每孔5 000个细胞)加入100 μL TRAP工作液,每组细胞37 ℃避光孵育10 min,弃掉染色液,显微镜拍照。
1.5.2OC来源外泌体提取。设1组为OC模型加入15%浓度对照血清;2组为OC模型加入15%浓度含药血清。两组以5×105/mL的细胞浓度接种于6孔培养板中,处理7 d后,去除上清液,更换新鲜培养基,24 h后收集两实验组外泌体,1组外泌体称为Exo-Con,2组外泌体称为Exo-Drug。
1.5.3外泌体表达及β-catenin蛋白检测。采用免疫印迹试验法(Western blot,WB)进行对CD9、CD63、CD81和β-catenin蛋白表达检测。检测β-catenin在总蛋白、细胞核中的含量,总蛋白以GAPDH为内参,细胞核以laminB为内参。细胞裂解后测定蛋白质浓度,并致于-80 ℃保存。将蛋白质转膜至PVDF膜。用含5%脱脂奶粉的TBST浸泡PVDF膜,室温摇床封闭2 h。封闭液稀释相应的一抗(GAPDH:1∶1000稀释,CD9∶1∶1000稀释,CD63∶1∶1000稀释,CD81∶1∶1000稀释,LaminB:1∶1500稀释,β-catenin:1∶1500稀释),PVDF膜浸泡于一抗孵育液中,4 ℃孵育过夜。封闭液稀释相应的HRP标记二抗(1∶5000),使PVDF膜浸泡于二抗孵育液中,37 ℃摇床孵育2 h。将ECL试剂中增强液与稳定的过氧化物酶溶液按1∶1比例混匀,滴加工作液于PVDF膜上,反应数分钟待荧光带明显后,用滤纸吸去多余的底物液,显影仪拍照。
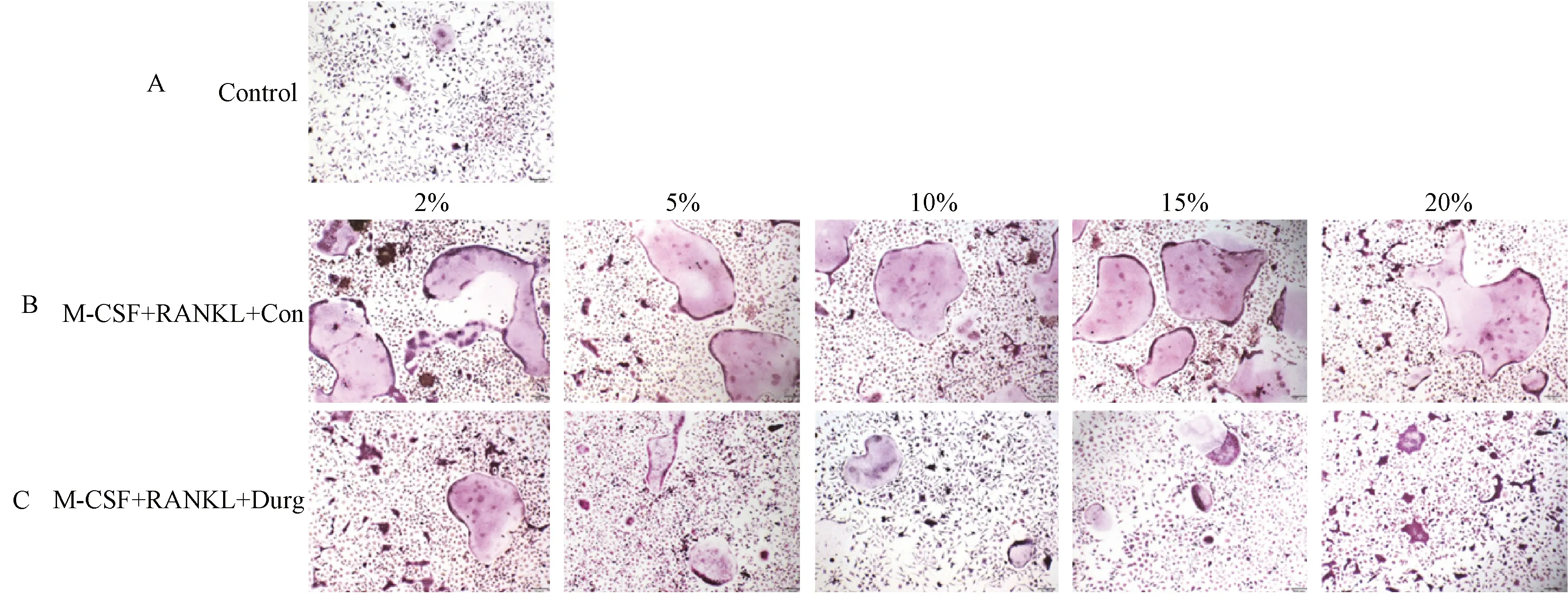
图1 RAW264.7细胞的TRAP染色 A:对照组,无任何处理;B:加入M-CSF和RANKL诱导破骨与不同浓度对照血清;C:加入M-CSF和RANKL诱导破骨与不同浓度含药血清(**P<0.01)。Fig.1 TRAP staining of RAW264.7 cells. A: Control group, without any treatment; B: Adding M-CSF and RANKL to induce osteoclast and control serum with different concentrations; C: Adding M-CSF and RANKL to induce osteoclast and different concentrations of drug containing serum (**P< 0.01).
1.5.4ALP检测。设1组为小鼠BM-MSC,2组为OB模型,3组为OB模型加入Exo-Con,4组为OB模型加入Exo-Drug。各组吸取培养液,离心取上清液备用;配制酚标准应用液。采用ALP试剂盒,空白管加入双蒸水30 μL,标准管0.1 mg/mL酚标准应用液30 μL,测定管加入各组待测样本30 μL,均加入缓冲液,基质液,充分混匀 37 ℃孵育15 min加入显色剂,520 nm波长测定各孔吸光度。定义1 mL液体在37 ℃与基质作用15 min产生1 mg酚为1个金氏单位。
1.5.5基因提取和基因表达检测。收集OB模型细胞,预冷PBS清洗3次,1 500 r/min离心3 min收集细胞,以1×105/mL的细胞浓度接种于6孔培养板中。使用总RNA提取试剂盒提取RNA;提取的RNA进行mRNA逆转录程序,逆转录产物cDNA作为PCR扩增模板。RT-PCR反应程序:预变性,95 ℃,10 min;变性,95 ℃,15 s;退火,60 ℃,30 s;延伸,72 ℃,30 s,40个循环。引物信息:成骨特异性转录因子(Runx2):
F-5’-GACTGTGGTTACCGTCATGGC-3’,R-5’-ACTTGGTTTTTCATAACAGCGGA-3’;
骨桥蛋白(OPN):F-5’-CTTTCACTCC AATCGTCCCTAC-3’,R-5’-GCTCTCTTTGGAATGC TCAAGT-3’;
骨钙素(OCN):F-5’-AGCAGGAGGGCAA TAAGGTAGT-3’,R-5’-ACCGTAGATGCGTTTGTA GGC-3’;
内参抗体(Gapdh):F-5’-GTATGACTCCA CTCACGGCAAA-3’,R-5’-GGTCTCGCTCCTGG AAGATG-3’。
1.5.6Wnt/β-catenin通路检测:设1组为RAW264.7细胞;2组为OC模型加入15%对照血清;3组为OC模型加入15%含药血清;4组为小鼠BM-MSC;5组为OB模型;6组为OB模型加入Exo-Con;7组为OB模型加入Exo-Drug。1~3组:M-CSF和RANKL处理4 d后,进行血清处理3 d;4~7组:诱导11 d时,加入外泌体,处理3 d。每组以1×105/mL的细胞浓度接种于6孔培养板中采用WB法检测β-catenin,方法于1.5.3中说明。
1.6 统计学分析
采用SPSS 22.0软件,计量数据用均值±标准差表达,采用t检验。计数资料采用Krusal-Wallis检验,P<0.05为差异有统计学意义。
2 结果
2.1 强骨饮含药血清对OC模型分化的影响
M-CSF和RANKL诱导处理增加OC模型的TRAP活性,促进破骨分化,而含药血清可以抑制TRAP活性,抑制破骨分化。15%和20%的含药浓度抑制破骨分化效果较佳(图1)。
2.2 外泌体蛋白检测
空白血清和含药血清处理后的OC模型外泌体均表达CD9、CD63、CD81蛋白,表明外泌体提取和分离效果较好(图2)。

图2 RAW264.7细胞外泌体的蛋白检测Fig.2 Protein detection of exosomes in RAW264.7 cells注:Exo-con为加入对照血清的OC外泌体;Exo-Drug为加入含药血清的OC外泌体;CD9、CD63、CD81为外泌体抗体。
2.3 外泌体对OB模型ALP活性的影响
OB模型促进ALP活性增加,加入外泌体Exo-Con和Exo-Drug均抑制ALP活性,但Exo-Drug对ALP抑制作用弱于Exo-Con。表明外泌体抑制OB分化,加入含药血清降低对OB分化的抑制作用(图3)。

图3 BM-MSC细胞上清液中ALP活性检测Fig.3 Detection of ALP activity in the supernatant of BM-MSC cells注:4组ALP表达两两比较差异均有统计学意义。
2.4 外泌体对OB模型成骨相关基因表达的影响
OB模型均能促进OCN、OPN、RUNX2基因转录,加入外泌体Exo-Con和Exo-Drug均抑制OCN、OPN、RUNX2基因转录,但Exo-Drug对OCN、OPN、RUNX2基因转录抑制作用弱于Exo-Con。表明外泌体抑制OB分化,破骨分化诱导RAW264.7细胞外泌体抑制BM-MSC的成骨分化,加入含药血清降低对OB分化的抑制作用(图4)。
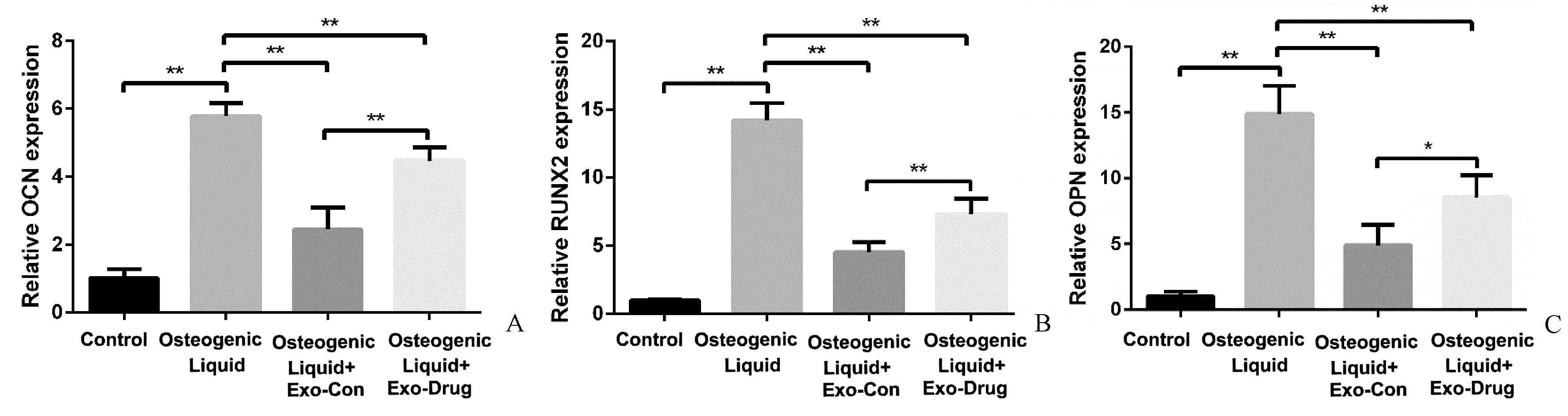
图4 BM-MSC细胞成骨分化相关基因检测 A:4组OCN表达检测,两两比较差异均有统计学意义;B:4组RUNX2表达检测,两两比较差异均有统计学意义;C:4组OPN表达检测,加入对照血清和含药血清OC外泌体表达无差异,其余比较差异均有统计学意义(**P<0.01)。Fig.4 Detection of osteogenic differentiation-related factors in BM-MSC cells. A: There were significant differences in the expression of OCN in 4 groups; B: Runx2 expression in 4 groups was statistically significant; C: There was no difference in the expression of OC exosomes in control serum and drug containing serum in group 4, and the other differences were statistically significant (**P<0.01).
2.5 强骨饮含药血清对wnt/β-catenin通路的影响
M-CSF和RANKL诱导处理的OC模型抑制wnt/β-catenin通路(总蛋白和细胞核中含量减少),而含药血清则激活β-catenin通路(总蛋白和细胞核中含量增加);OB模型激活wnt/β-catenin通路(总蛋白和细胞核中含量增加),外泌体Exo-Con和Exo-Drug均抑制β-catenin通路,但Exo-Drug对β-catenin通路抑制作用弱于Exo-Con(图5)。

图5 RAW264.7与BM-MSC细胞内β-catenin蛋白检测Fig.5 Detection of β-catenin in RAW264.7 and BM-MSC cells注:Total为细胞总蛋白内含量;nucleus为细胞核内含量;GAPDH与LaminB为内参蛋白。
3 讨论
强骨饮为浙江省名中医史晓林教授经验方,已运用临床10余年。在动物研究中证实,强骨饮可以有效增加骨量,促进钙质沉积的作用[4-5];临床运用中,强骨饮在防治原发性I型骨质疏松症、提高骨量、缓解疼痛等方面存在显著疗效。众所周知,抑制OC分化和促进OB分化是治疗OP的基本原则。临床上大多采用骨吸收抑制剂治疗原发性I型骨质疏松,而中医药防治OP具有多靶点的特点。本研究为探究中药复方强骨饮的双向调控机制,选择观察可联系OC和OB的外泌体和wnt/β-catenin通路进行研究。
外泌体是一种细胞分泌的囊泡,内含组织或者细胞特异性蛋白、脂质和核酸片段,具有一定的细胞间信使作用,能通过水平转移或细胞-受体相互作用来进行内容物的传递,调节其他细胞的功能,在疾病发生发展及诊断中起着重要作用[1,6]。2016年Nature Communication上报道,OC来源的外泌体可通过传递miR-214-3p至OB中抑制OB分化,OC miR-214-3p高表达的转基因小鼠骨形成受到抑制[1]。肌细胞源性外泌体可通过miR-27a-3p增强成骨分化能力[6]。骨髓间充质干细胞来源的外泌体可促进成骨分化抑制OP[7]。矿化的OB外泌体通过miRNA抑制骨髓间充质干细胞Axin1表达激活wnt/β-catenin通路从而诱导成骨分化[8]。因此,OC外泌体在成骨分化过程中扮演重要角色,而强骨饮抑制OP是否与外泌体以及miRNA相关,则有待研究。
本研究首先对M-CSF和RANKL诱导处理的RAW264.7细胞构建OC模型,分别用强骨饮药物和对照药物进行干预。采用TRAP染色证实强骨饮可以抑制OC分化,找到最佳的含药血清浓度。其次,使用最佳含药血清浓度干预OC模型,进行OC来源外泌体检测,发现实验组和对照组均能提取外泌体,说明强骨饮对OC外泌体的释放没有影响。收集外泌体干预成骨诱导液的小鼠BM-MSC细胞,发现强骨饮干预下的OC外泌体作用于OB模型,相比于对照组,能缓解对BM-MSC细胞成骨分化的抑制作用。通过检测ALP含量,OCN、OPN、RUNX2因子表达提供了证据。然而,相比于未加入外泌体的实验组,OB分化未受到明显抑制。本研究证实了OC模型外泌体影响OB分化,但强骨饮可改善这种影响。为了进一步探究干预机制,展开了对wnt/β-catenin通路的相关研究。
Wnt/β-catenin通路负责OB的增殖和分化[9],可促进骨髓间充质干细胞(BMSCs)向OB分化,抑制其向软骨细胞或脂肪细胞分化,并抑制OB凋亡,从而促进骨形成[9]。研究报道,黄芪皂苷I(强骨饮君药成分)可刺激成骨分化,且依赖于wnt/β-catenin通路[10]。印度黄檀异黄酮可激活BMP2-wnt/β-catenin通路诱导成骨分化促进骨生长缓解骨质疏松,该诱导作用可被wnt受体阻断剂DKK1和TCF复合物抑制剂FH535所阻断[11]。Wnt受体阻断剂DKK1含量在卵巢切除的骨质疏松模型大鼠中显著增加[3],说明wnt/β-catenin通路也可抑制OC分化。研究发现强骨饮干预OC时,总蛋白和细胞核内β-catenin显著增加,说明强骨饮可激活wnt/β-catenin通路来抑制OC分化;而在OB中,β-catenin含量受外泌体影响减少,但含药血清可减弱对通路的抑制作用。表明了基于wnt/β-catenin通路强骨饮具有双向调控的作用机制。
然而,对OC来源外泌体抑制OB分化如何影响wnt/β-catenin通路的内在联系仍不明确,需要进一步研究。文献报道,wnt/β-catenin与miRNA关系密切。miR-433-3p可靶向结合DKK1 mRNA UTR端,促进DKK1 mRNA降解,降低DKK1蛋白含量,从而促进成骨细胞分化[3]。miR-194通过抑制wnt负向调控子SUFU激活wnt/β-catenin通路[12]。miR-29c-3p通过靶向结合Dvl2 mRNA 3’UTR从而调节wnt/β-catenin通路调控成骨分化[13]。此外,miR-141、miR-22、miR-185等均可通过调节wnt/β-catenin通路影响成骨分化[14-15]。目前,中药黄芪主要成分通过miRNA影响大鼠细胞癌变和心肌细胞缺血的研究已提示中药与miRNA的关系[16-19]。进一步研究强骨饮与miRNA关系,为阐明强骨饮对wnt/β-catenin通路的调节机制具有创新性和可行性。
通过设置强骨饮含药血清和对照血清进行细胞干预,初步证实了含药血清可以抑制OC分化,能促进OC细胞内β-catenin蛋白的表达。同时,观察到OC细胞可以释放外泌体抑制成骨细胞分化,而强骨饮含药血清可以改善破骨细胞外泌体的抑制作用。在碱性磷酸酶、相关成骨因子和β-catenin蛋白表达上得到了验证。更重要的是,本研究假说上述变化可作用于wnt/β-catenin通路进行调节,这与外泌体传递miRNA作用相关靶基因有密切联系。

