外源NO对NaCl胁迫下冰叶日中花生理指标的影响
王文果,陈志新,石俊华,胡增辉
(1.北京农学院 园林学院,北京102206;2.国家林业和草原局调查规划设计院,北京 100714)
土壤盐渍化已经成为全球性的生态问题。中国农林业土壤的盐渍化程度严重,面积大、分布广,对农业生产造成了严重的威胁[1]。中国耕地面积约3 460万hm2,发生盐渍化的土壤近760万hm2,约1/5耕地成为盐碱地[2]。土壤盐渍化已成为制约农林业生产的一个主要因素,提升农林作物的耐盐性,培育高耐盐性的植物新品种是农林业研究的重要方向。通过研究植物的耐盐机理,能为筛选、改良、培育耐盐植物新品种提供理论基础。植物的耐盐性是一个受多基因、多途径调控的复杂网络,当前已在各个水平开展了对植物耐盐机理的研究,包括生长、生理、分子、蛋白等,而植物对盐害感知机制及信号途径的探索是目前的研究热点。研究发现,多种信号途径参与了植物对盐胁迫的响应。盐胁迫诱导了植物细胞质中的Ca2+的含量迅速升高,脱落酸、茉莉酸等信号物质大量合成,诱导下游基因的表达、蛋白的合成、次生代谢物的积累等,从而提高耐盐性[3]。一氧化氮(nitric oxide,NO)作为近年来发现的具有信号功能的气态分子,广泛存在于植物体内,参与植物生长发育及逆境适应等生理过程,是当前研究的热点[4,5]。研究发现,NO在植物对盐胁迫的响应中也起着重要的信号作用[6,7],但对其作用机理研究较少。
冰叶日中花(Mesembryanthemumcrystallinum)为番杏科日中花属植物,具有极强的耐盐性,是研究耐盐机理的模式植物。但冰叶日中花响应盐胁迫并产生抗性的信号途径研究较少,特别是对于NO的作用未见报道。本研究以冰叶日中花实生苗为材料,在盐胁迫下结合硝普钠(SNP,NO供体)的施用,检测NO对NaCl胁迫下叶片生理指标的影响,初步揭示NO在冰叶日中花响应盐胁迫中的作用,为探索提高农林植物耐盐性途径和方法提供理论依据。
1 材料与方法
1.1 植物材料
试验以冰叶日中花实生苗为材料,在北京农学院园林植物实践基地温室内进行培养。将种子播在50孔穴盘中,待幼苗长到5 cm后移苗到花盆(12 cm×12 cm)中,每盆种植1株。盆土基质配方为草炭∶蛭石∶珍珠岩=3∶1∶1,每3 d浇1次水,每周浇1次1/4 Hoagland营养液。当冰叶日中花长出8片叶子后,选择生长状态一致且无病虫害的植株进行实验。
1.2 NaCl及SNP处理
使用400 mM NaCl进行盐处理,以1/4 Hoagland营养液配置,以S0表示。硝普钠(SNP)处理设置5个浓度梯度(50、100、300、500、800 μM,分别以S1、S2、S3、S4、S5表示),处理时将SNP溶于400 mM NaCl的1/4 Hoagland营养液中。以1/4 Hoagland溶液为对照(CK),每个处理3次重复。浇盐量为500 mL,分3 d完成,第1天浇100 mL,第2、3天分别浇200 mL。于处理后第1、3、5、10、15天取叶片,立即放入液氮中,放入-80 ℃超低温冰箱保存。
1.3 H2O2含量测定
称取0.2 g叶片,加入1.5mL 4℃预冷的丙酮和少量石英砂于研钵中研磨成匀浆,3 000 r/min离心10 min。取1 mL上清液,加0.1 mL 5%(W/V)TiSO4和0.2 mL浓氨水,3 000 r/min离心10 min,将沉淀溶解于3 mL 2 mM H2SO4溶液中,于415 nm波长下测定吸光度。H2O2含量/(μmol/gFW)= (C×Vt)/(Vs×W)。C.标准曲线上查得样品中的H2O2浓度;Vt.提取液总体积;Vs.测定时取样量;W.样品鲜质量。
1.4 丙二醛含量测定
参考陈志新等[8]和赵雪琦[9]的方法,称取0.2 g叶片,取10 mL 10%三氯乙酸及少量石英砂于研钵中研磨成匀浆,3 000 r/min离心10 min。取2 mL上清液,加入2 mL 0.6%硫代巴比妥酸,混匀,沸水浴15 min,迅速冷却,再于3 000 r/min离心10 min,将上清液在532、600、450 nm波长下测定吸光度。MDA含量/(μmol/g)=[6.452×(OD532-OD600)-0.559×D450]×Vt/(Vs×W)。Vt.提取液总体积;Vs.测定用提取液体积;W.样品鲜质量。
1.5 脯氨酸含量测定
称取0.5 g叶片,加5 mL 3%的磺基水杨酸,沸水浴20 min,冷却后3 000 r/min离心10 min。取2 mL上清液,加入2 mL乙酸和2 mL酸性茚三酮,沸水浴30 min。冷却后加入5 mL甲苯溶液萃取,充分摇荡60 s,静置后取上层溶液,再于3 000 r/min离心10 min,取上清液在520 nm波长下测定吸光度。脯氨酸含量/(μg/g )= (C×Vt)/(Vs×W)。C.提取液中脯氨酸的含量;Vt.提取液总体积;Vs.所吸取提取液体积;W.样品鲜质量。
1.6 可溶性糖含量测定
参考陈志新等[8]的方法,称取0.5 g叶片,置于5 mL蒸馏水中沸水浴30 min,过滤后定容至10 mL,即为粗提液。粗提液1 mL,加1.5 mL蒸馏水、0.5 mL蒽酮乙酸乙醋溶液和5 mL浓硫酸,充分振荡,沸水浴1 min,冷却至室温,在630 nm波长下测定吸光度。
可溶性总糖的含量/(mg/g)= (C×Vt)/(Vs×W)。C.提取液中可溶性糖含量;Vt.提取液总体积;Vs.测定时所吸取提取液体积;W.样品鲜质量。
1.7 超氧化物歧化酶活性测定
称取0.5 g叶片,加入4 mL磷酸缓冲液(50 mM,pH7.8)冰浴研磨,4℃ 10 000 r/min离心20 min,上清液冷藏保存。取型号相同两支试管,取50 μL上清液(2支对照试管中各加磷酸缓冲液50 μL),加入3 mL反应液(由蒸馏水、甲硫氨酸、氮蓝四唑、EDTA-Na2、核黄素按5∶30∶6∶6∶6∶6的浓度比配置),其中1支对照试管置于暗处,其余各管于4 000 lx光下反应30 min。以不照光的对照管作空白,于560 nm波长下测定吸光度。
SOD活性/(U/g)=(Ack-AE) ×Vt/(0.5×Ack×W×Vs)。Ack.对照管的吸光度;AE.样品管的吸光度;Vt.样品液总体积;Vs.测定时用酶液体积;W.样品鲜质量。
1.8 过氧化物酶活性测定
提取方法同SOD。取20 μL粗提液加入3 ml反应液,于470 nm波长下测定吸光度。每隔1 min读一次,测定5 min。反应液:50 mL 100 mM pH6.0的磷酸缓冲液,加入28 μL愈创木酚,加入30%19 μL H2O2,存于冰箱中。
POD活性/[U/(min·gFW)]=(ΔA470×Vt)/(0.01Vs×W×t)。式中,ΔA470.吸光度的变化值;Vt.提取酶液的总体积;Vs.测定时取用酶液体积;t.反应时间;W.样品鲜质量。
1.9 过氧化氢酶活性测定
称取0.5 g叶片,加入5 mL 4 ℃预冷的50 mM磷酸缓冲液(pH=7.0,含1%PVP,0.1%巯基乙醇)及少量石英砂和CaCO3冰浴研磨,4℃ 10 000 r/min离心20 min,上清液即为粗提液。反应体系含2.5 mL磷酸缓冲液、0.1 mL 2% H2O2、0.1 mL粗提液,混匀后于240 nm波长下测定吸光度。每1 min读1次数,测定5 min,以每分钟变化0.01为一个活力单位。
CAT活性/[U/(min·g)]=(ΔA240×Vt)/(0.01Vs×W×t)。式中,ΔA240.吸光度的变化值;Vt.提取酶液的总体积;Vs.测定时取用酶液体积;t.反应时间;W.样品鲜质量。
1.10 抗坏血酸过氧化物酶活性测定
提取方法同CAT。反应体系含2.5 mL磷酸缓冲液、0.1 mL 0.1 mM EDTA-Na2、0.1 mL 0.3 mM 抗坏血酸(AsA)、0.1 mL 0.06 mM H2O2、0.l mL粗提液。加入H2O2后启动反应,于290 nm波长测定吸光度。每1 min读1次数,测定5 min,以每分钟变化0.01为1个活力单位。
APX活性/[U/(min·g)]= (ΔA290×Vt)/(0.01Vs×W×t)。ΔA290.反应时间内吸光度的变化;Vt.提取酶液的总体积;Vs.测定时取用酶液体积;t.反应时间;W.样品鲜质量。
使用Excel 2007软件进行数据分析,采用LSD法进行差异显著性比较,统计P值为0.05水平上的差异(P<0.05)。
2 结果与分析
2.1 不同浓度SNP对盐胁迫下冰叶日中花MDA和H2O2含量的影响
表1显示了SNP对盐胁迫下冰叶日中花叶片MDA和H2O2含量的影响。与对照相比,在盐胁迫条件下,冰叶日中花叶片的MDA含量随着处理时间不断的升高,显著高于对照(P<0.05),第5天达到最高19.21 μmol/g,为对照的1.8倍。施用不同浓度SNP处理后,MDA的含量随SNP浓度的增加表现出逐渐降低的趋势。在800 μM的SNP处理后,MDA的含量远低于S0(P<0.05),仅为S0的57%,而且低于对照。H2O2含量表现出与MDA相似的变化规律,随着SNP处理浓度的增加,盐胁迫引起的H2O2的积累逐渐减少。

表1 SNP对盐胁迫下冰叶日中花叶片MDA和H2O2含量的影响
2.2 不同浓度SNP对盐胁迫下冰叶日中花渗透调节物质含量的影响
当冰叶日中花植株受到NaCl胁迫后,脯氨酸和可溶性糖含量均出增加的趋势,均显著高于对照(P<0.05,表2)。加入SNP后,这两种渗透调节物质含量在低浓度下(50~300 μM),呈现出先逐渐升高的趋势,而超过300 μM后,随着浓度的增加,脯氨酸和可溶性糖含量又逐渐降低。加入50 μM SNP后,脯氨酸和可溶性糖含量即表现出显著升高(P<0.05)。在SNP处理第1天,叶片脯氨酸和可溶性糖含量分别较S0增加了57%和44%。而加入300 μM SNP后,叶片脯氨酸和可溶性糖含量在第1天就分别增加到了S0的3.5倍和2.2倍,经过15 d处理后,仍然保持较高的水平,明显比S0高2倍和0.9倍(P<0.05)。

表2 SNP对盐胁迫下冰叶日中花叶片脯氨酸和可溶性糖含量的影响
2.3 不同浓度SNP对盐胁迫下冰叶日中花抗氧化活性酶的影响
表3显示了SNP对盐胁迫下冰叶日中花叶片抗氧化酶活性的影响。可以看出,NaCl胁迫下,SOD、POD、CAT、APX活性均高于对照(P<0.05),而随着处理时间的延长整体上呈现出先升高后下降的趋势。加入SNP后,在低浓度下(50~300 μM),各个酶活性逐渐升高,大于300 μM后,随着浓度的增加,酶活又表现出降低的趋势。4种酶活性在加入300 μM SNP后,均表现出最高的活性。300 μM SNP处理1 d后,叶片SOD活性迅速增加到S0的1.8倍,经过15 d后,又增加到2.3倍。在300 μM SNP处理1 d后,POD活性显著高于S0(P<0.05),为S0的2.5倍,在处理15 d后活性有所降低,但也几乎达到S0的2.0倍。CAT和APX活性在300 μM SNP处理1 d,也分别较S0升高了60%和80%,活性显著增加(P<0.05)。
3 讨 论
植物在高盐、高温、干旱、盐碱等逆境下会发生活性氧增加[10,11],造成膜质过氧化[11,12],破坏蛋白结构,从而影响植物正常代谢[13],导致植物受到伤害。抗氧化酶系统的活化,能有效的清除由于活性氧,提高叶片细胞的渗透调节能力和耐盐性[14]。
冰叶日中花受到盐胁迫后,叶片MDA和H2O2含量的增加,表明其生理生化代谢受到影响。脯氨酸和可溶性糖含量,以及SOD、POD、CAT、APX活性的升高,表明冰叶日中花通过增加渗透调节物含量、提升抗氧化系统活性,提高了耐盐性。亚麻荠(Camelinasativa)经盐胁迫后,活性氧大量积累,引起抗氧化酶系统的迅速活化,剂渗透调节物的大量合成[15]。段吉锋等发现,耐盐性强的茄子(Solanummelongena)品种,在盐胁迫后的脯氨酸等渗透调节物含量,以及SOD、POD等酶活性大幅度升高[16]。冰叶日中花在400 mM的高盐浓度处理1 d后,渗透调节物含量和抗氧化酶活性即出现显著升高,表明其能迅速响应盐胁迫,启动相应的生理生化反应,表现出较强耐盐性。
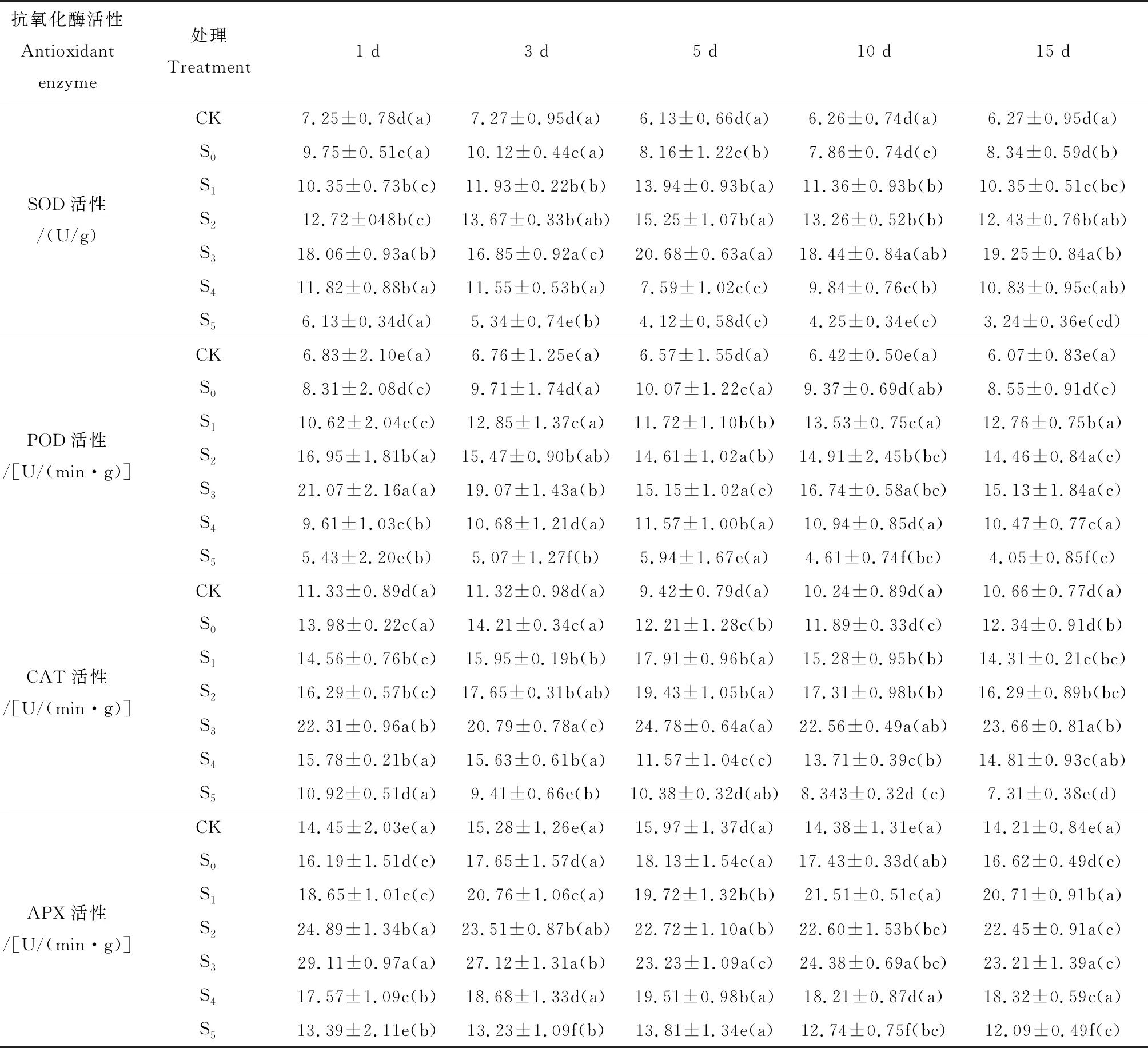
表3 SNP对盐胁迫下冰叶日中花叶片抗氧化酶活性的影响
植物抗逆反应的产生,须有信号物质参与和介导。NO是植物体内重要的抗逆信号分子[17]。NO参与了胁迫下黄瓜(Cucumissativus)幼苗盐抗氧化反应的调控,缓解了膜质过氧化对叶片光合系统的损伤[18]。杨晓伟等研究发现,外源SNP可以显著增加CAT、SOD、POD等抗氧化酶活性,提高台湾桤木(Alnusformosana)的抗氧化能力[19]。在盐胁迫下冰叶日中花经SNP处理后,叶片MDA和H2O2含量的降低,说明膜脂过氧化保持较低水平。另外,脯氨酸和可溶性糖含量的升高,提高了对渗透胁迫的抗性,表明NO能促进冰叶日中花渗透调节物质的合成,提高其耐盐性。裴乐乐等的研究也表明,适当浓度的外源SNP(0.2 mM)能明显抑制由盐胁迫造成的油松(Pinustabuliformis)叶片MDA和H2O2含量的积累,提高脯氨酸和可溶性蛋白的含量[20]。在本研究中,SNP处理同样显著提高了盐胁迫后冰叶日中花叶片中POD、SOD、CAT和APX活性,表明NO激活了抗氧化酶系统,增强了活性氧的清除能力,减轻了膜脂过氧化程度。SNP的处理也提高了盐胁迫下的蒺藜苜蓿(Medicagotruncatula)种子抗氧化酶活性,降低了MDA和活性氧含量,减轻了盐胁迫对种子的伤害[21]。此外,随着SNP浓度的升高,在MDA和H2O2含量下降的同时,抗氧化酶活性以及渗透调节物质含量也相应的呈现出下降的趋势。邵瑞鑫研究表明,外源SNP能够显著提升逆境下植物光合电子传递链的效率,减少活性氧的产生,有效地提升植物叶片对逆境的耐受能力,表明NO对活性氧生产具有重要的调控作用[22]。因此,外源SNP除激活抗氧化酶系统、提高渗透调节物质含量外,还能直接调控减少了盐胁迫后活性氧的产生。总之,外源SNP能够在生理水平上提升冰叶日中花的耐盐性,但其中的机制有待进一步研究。

