广西近岸强额孔雀水蚤对球形棕囊藻的下行控制*
陆家昌,李 杰,赖俊翔,王英辉,姜发军,许铭本,庄军莲
(1.广西科学院,广西北部湾海洋研究中心,广西近海海洋环境科学重点实验室,广西南宁 530007;2.广西大学海洋学院,广西南宁 530004)
0 引言
球形棕囊藻(Phaeocystisglobosa,下文简称棕囊藻)赤潮多以囊体形式存在[1]。大量囊体漂浮水中,会堵塞鱼类的腮,导致鱼类缺氧死亡,给海水养殖业带来危害[2]。棕囊藻赤潮消退时,囊体死亡分解,在海水表面形成大量泡沫,破坏近岸海洋景观,给海洋旅游业带来不利影响[3]。近年来,棕囊藻赤潮多次在广西近海爆发,棕囊藻赤潮形成的大量囊体还可能堵塞防城港核电站冷源取水口的筛网,从而对核电安全造成威胁。赤潮的发生是上下行控制之间的平衡被打破,浮游植物生物量爆发性增殖的结果[4]。因此,研究捕食者的下行控制对揭示棕囊藻赤潮的发生机制具有重要意义。棕囊藻具有复杂的异型生活史,可以在单细胞和囊体之间转换[5]。一旦形成囊体,棕囊藻便可以躲避绝大部分捕食者的捕食[6]。因此,研究捕食者对棕囊藻的下行调控作用,最优的选择是研究其对单细胞棕囊藻的摄食。对单细胞棕囊藻的摄食调控可能抑制棕囊藻赤潮的形成[7,8]。然而,单细胞棕囊藻粒径只有3 μm到9 μm,个体微小,一般认为这样微小的个体只能被原生动物利用[7]。以往的研究也确实表明桡足类不能高效地摄食单细胞棕囊藻,但是他们的研究多以宽水蚤、纺锤水蚤作为捕食者[9-11],这些桡足类粒径大于强额孔雀水蚤。根据甲壳动物摄食棕囊藻的粒径理论预测,强额孔雀水蚤等更小的小型桡足类也可以单细胞棕囊藻为食[12],而且强额孔雀水蚤高效摄食3 μm至9 μm浮游植物已被证实[13-15]。另外,小型桡足类还大量摄食原生动物,引发营养级联效应,从而调控原生动物对单细胞棕囊藻的摄食[16,17]。综上所述,强额孔雀水蚤等小型桡足类的下行控制可能在棕囊藻赤潮的形成中发挥重要的调控作用。由于小型桡足类种类众多,很难对每一种都进行研究,一般的处理方式是选择其中的优势种进行深入研究。强额孔雀水蚤是近岸海区广布种,其适合的盐度为3.4到55.0,温度为5℃到33℃[18]。可是以往的调查却发现,北部湾近岸强额孔雀水蚤密度的数量级仅为101到102[19,20]。这是因为以往在广西近岸的浮游动物调查多采用大孔径浮游生物网进行采样(孔径505 μm)。大孔径浮游生物网采样会在数量级上低估小型桡足类的丰度[21]。王荣等[22,23]调查发现,强额孔雀水蚤在黄海有很高的密度分布,但由于采用大网孔浮游生物网进行采样,导致其密度被低估2个数量级。如果广西近岸强额孔雀水蚤的丰度被严重低估,那么其在棕囊藻赤潮形成中的调控作用也可能被忽略。本研究通过野外调查和室内实验,阐明广西近岸桡足类优势种——强额孔雀水蚤对单细胞棕囊藻的下行控制潜力,对揭示广西近岸棕囊藻赤潮发生机制具有重要意义。
1 材料与方法
1.1 调查海区及采样方法
于2017年到2019年在广西近岸S1到S11站位,以浅水Ⅱ型浮游生物网(孔径160 μm)对浮游动物进行垂直拖网采样(图1)。将拖网样品小心冲洗到2 L样品瓶中,甲醛固定后带回实验室浓缩,于倒置显微镜下对强额孔雀水蚤进行鉴定并计数。强额孔雀水蚤丰度的变化调查每月采样一次,但由于人力物力有限,并非连续逐月采样,而是在3年内完成12个不同月份的样品采集工作。由于项目的不延续性,有些月份会有3—4个站位的缺失。
图1 采样站位Fig.1 Sampling stations
1.2 不同网具的比较
于2016年6月、8月、9月和11月,在S11站和S9站用浅水Ⅰ型(孔径505 μm)和浅水Ⅱ型浮游生物网进行垂直拖网,采集强额孔雀水蚤,比较不同网具采样的区别。为避免连续采样造成的偏差,同一站位不同网具采样时间相差30 min,且每次采样所使用的网具顺序是随机的,不分先后。样品的固定和分析同1.1节所述。
1.3 棕囊藻囊体及强额孔雀水蚤的丰度调查
于2015年9月到2016年3月在S7站和S8站,使用手持式采水器对棕囊藻囊体样品进行采样。将表、中、底层采集的水样混匀后倒入白色托盘中,现场计数囊体的个数。采集囊体的同时,以浅水Ⅱ型浮游生物网对强额孔雀水蚤进行垂直拖网采样,并计数其丰度。
1.4 摄食实验
于2018年6月以浅水Ⅱ型浮游生物网在S8站位附近垂直拖网,收集浮游动物样品并带回实验室。在解剖镜下分离强额孔雀水蚤成体,然后分别在16,20,24,28℃条件下暂养3 d以适应环境,暂养时期以球等鞭金藻作为饵料。摄食实验以单细胞棕囊藻作为食物,投喂单细胞棕囊藻前先通过10 μm筛绢过滤以去除囊体。解剖镜下挑选健康的强额孔雀水蚤成体进行实验。实验前24 h不投喂,在经0.22 μm滤膜过滤的自然海水中暂养以排空肠道。摄食实验在250 mL烧杯中进行,每个烧杯放养5只强额孔雀水蚤成体,培养体积150 mL,实验时间24 h,设4个温度梯度(16,20,24,28℃),每个梯度5组平行。实验同时设置不含捕食者组作为控制组,对实验结果进行校正。摄食率通过食物差减法获得,按以下公式进行计算:
式中,I表示桡足类的摄食率,cells·ind.-1·h-1;V表示实验瓶内水体体积,mL;N表示桡足类的个数,ind.;C0表示食物初始浓度,cells·mL-1;Ct表示控制组实验结束时食物浓度,cells·mL-1;Ctf表示实验组实验结束时细胞的浓度,cells·mL-1;t表示实验时间,h。
2 结果与分析
2.1 不同网具采样获得的强额孔雀水蚤丰度
调查结果表明,小型网采集获得的强额孔雀水蚤丰度比大型网高出2个数量级(表1)。以小型网进行调查,发现强额孔雀水蚤丰度数量级在103时候,大型网调查所获得的丰度只有101。调查期间,小型网捕获的强额孔雀水蚤丰度是大型网的209倍到523倍(表1)。以往广西近岸浮游动物样品的获取多使用大型网采集(浅水Ⅰ型)。较之小型网(浅水Ⅱ型),大型网采集严重低估强额孔雀水蚤的丰度。

表1 大型网和小型网拖网获得的强额孔雀水蚤丰度Table 1 Abundance of P.crassirostris collected from small and big mesh-sized plankton net
2.2 广西近岸强额孔雀水蚤的丰度
调查期间,广西近岸强额孔雀水蚤丰度的最低值出现在1月份,为(1 005±886) ind.·m-3;最高值出现在2月份,为(10 723±5 168) ind.·m-3;年平均值为(5 878±3 373) ind.·m-3(图2)。从折线图看,从5月到12月,水体中强额孔雀水蚤的丰度变化与水温变化趋势类似,但从1月到4月则并不完全匹配。统计分析结果表明,2月份的强额孔雀水蚤丰度与7月、9月的无显著差异(P>0.05),但2月份的水温显著低于7月和9月(P<0.05)。而1月和2月的水温并无显著差异(P>0.05),但2月的丰度显著高于1月(P<0.05)。

图2 广西近岸强额孔雀水蚤丰度的月变化Fig.2 Monthly variations of P.crassirostris abundance in coastal water of Guangxi
2.3 强额孔雀水蚤对单细胞棕囊藻的摄食
在16,20,24,28℃条件下,强额孔雀水蚤对单细胞棕囊藻的摄食率分别为(63.53±27.73)×103cells·ind.·h-1、(61.55±44.65)×103cells·ind.·h-1、(73.92±4.66)×103cells·ind.·h-1和(68.07±21.75)×103cells·ind.·h-1。虽然从平均值上看,24℃条件下强额孔雀水蚤对单细胞棕囊藻的摄食率最高,其次是28℃条件下,但是统计分析结果表明,不同温度条件下强额孔雀水蚤对单细胞棕囊藻的摄食率并无显著差异(P>0.05,图3)。
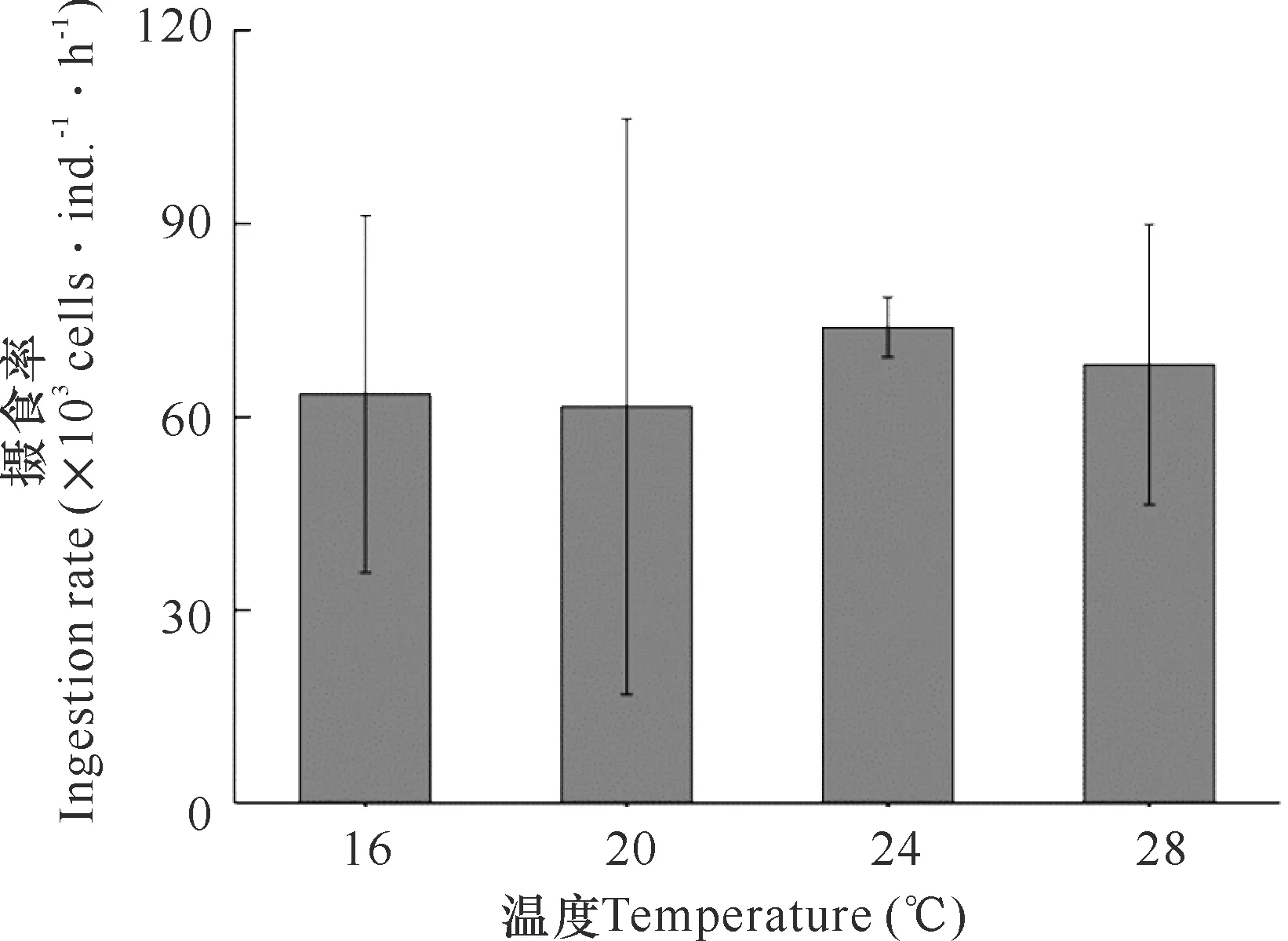
图3 不同温度条件下强额孔雀水蚤对单细胞棕囊藻的摄食Fig.3 Ingestion rate of P.crassirostris on solitary cells of P.globosa under different temperature
2.4 强额孔雀水蚤丰度与棕囊藻囊体密度的关系
棕囊藻赤潮高发时候,在固定站位加密观测强额孔雀水蚤丰度和棕囊藻囊体密度。结果发现强额孔雀水蚤丰度峰值和棕囊藻囊体密度峰值错峰出现,棕囊藻囊体密度峰值出现在强额孔雀水蚤丰度的低值区。在强额孔雀水蚤丰度明显降低1个多月后,棕囊藻囊体开始形成。此后,强额孔雀水蚤丰度继续降低,而棕囊藻囊体密度继续增加,并达到峰值。而当强额孔雀水蚤丰度再次到达峰值时,棕囊藻囊体完全消失(图4)。

图4 强额孔雀水蚤丰度和棕囊藻囊体密度的变化Fig.4 Variations of P.crassirostris abundance and colonies density of P.globosa
3 讨论
3.1 网具对浮游动物采样结果的影响
海洋中型浮游动物(Mesozooplankton)的数量很大一部分由桡足类贡献[24]。然而在温带和热带海区的浮游生态系统中,小型桡足类(<1 mm)发挥着更加重要的作用[25]。由于网具选择不恰当,小型桡足类的作用常被忽略。有研究报道,如果用网孔大于200 μm的浮游生物网进行采样,将有92%的小型桡足类在拖网过程中逃逸,从而严重低估小型桡足类的丰度,进而忽略其在海洋生态系统中的作用[25,26]。当前,我国近岸浮游动物调查主要有浅水Ⅰ型(孔径505 μm)和浅水Ⅱ型(孔径160 μm)这两种浮游生物网。虽然早有学者注意到网具的选择对浮游动物采样的影响,然而广西近岸的大部分海洋调查还是继续采用大网孔的浮游生物网(505 μm)对浮游动物进行调查[19-20,22,23]。强额孔雀水蚤成体体长为500-600 μm,属于小型桡足类[18]。王荣等[22,23]在黄海的调查也发现,用大型网采样将低估2个数量级的强额孔雀水蚤等中小型桡足类的丰度。本研究的调查也证实,以浅水Ⅱ型浮游生物网采样所获得的强额孔雀水蚤丰度比浅水Ⅰ型高2个数量级(表1)。另外,本研究大型网和小型网调查中强额孔雀水蚤的丰度均比王荣等[22,23]的调查结果高几倍,这表明广西近岸强额孔雀水蚤的丰度高于黄海。同时,本研究大型网调查所获得的强额孔雀水蚤丰度与其他学者以大型网在广西近岸调查获得的强额孔雀水蚤丰度结果类似,其丰度的数量级仅为101到102 [19,20],这说明以往的调查严重低估了广西近岸强额孔雀水蚤的丰度。由于广西近岸浮游动物主要由小型浮游动物组成[27],为此,作者呼吁广大海洋工作者,在对广西近岸浮游动物进行调查时应根据调查目的,选择合适的网具。
3.2 强额孔雀水蚤对单细胞棕囊藻的摄食
浮游动物的摄食受到其自身粒径和食物颗粒大小的制约。根据Nejstgaard等[12]建立的甲壳动物粒径和棕囊藻摄食关系理论预测,从粒径大小上看,单细胞棕囊藻粒径3—9 μm[7],强额孔雀水蚤是单细胞棕囊藻的最优捕食者。大量的研究也已证明,强额孔雀水蚤可高效摄食3—9 μm的浮游植物[13-15]。本研究也表明,强额孔雀水蚤可高效摄食单细胞棕囊藻,从16℃到28℃,强额孔雀水蚤对单细胞棕囊藻的摄食率从(61.55±44.65)×103cells·ind.·h-1到(73.92±4.66)×103cells·ind.·h-1(图3),与其他研究者报道的强额孔雀水蚤摄食球等鞭金藻、威氏海链藻等大小接近的浮游植物的摄食率相当[13-15]。虽然有研究认为,某些棕囊藻株系可产生对捕食者有毒害作用的二甲基硫(DMS)和丙烯酸[28,29],影响捕食者的摄食,但是笔者研究发现,北部湾株系并不会对捕食者的摄食造成影响(结果另文报道)。一般认为单细胞棕囊藻主要被原生动物摄食,不能被宽水蚤、纺锤水蚤和胸刺水蚤等桡足类大量摄食[7,9-11]。本研究结果表明,强额孔雀水蚤对单细胞棕囊藻的摄食率是宽水蚤、纺锤水蚤和胸刺水蚤的3—8倍。鞭毛虫和纤毛虫是海洋中主要的原生动物,强额孔雀水蚤对单细胞棕囊藻的摄食率是腰鞭毛虫的153倍,是纤毛虫的7倍[16,17]。更重要的是,强额孔雀水蚤的寿命远长于原生动物,对棕囊藻造成持续的摄食压力。另外,强额孔雀水蚤等小型桡足类还是原生动物的主要捕食者[16,17,30]。由于营养级联效应的存在,强额孔雀水蚤等小型桡足类不仅直接摄食单细胞棕囊藻,还控制着原生动物对单细胞棕囊藻的摄食。由于本研究在摄食实验中没考虑原生动物的作用,这可能高估强额孔雀水蚤的摄食能力。
3.3 广西近岸强额孔雀水蚤对棕囊藻的下行控制
赤潮的发生是浮游植物上行控制和下行控制之间的平衡被打破,浮游植物生物量迅速累积的结果[4]。棕囊藻形成囊体后可逃避绝大多数捕食者的捕食[1,31],因此认识捕食者对单细胞棕囊藻的下行控制对揭示棕囊藻赤潮的发生机理具有重要意义。由于以往的调查网具选择不恰当,广西近岸强额孔雀水蚤丰度被低估(表1)。实际上,强额孔雀水蚤在广西近岸常年存在,且除个别月份外,其密度均大于3 000 ind.·m-3,甚至在某些站位高达50 000 ind.·m-3(图2)。强额孔雀水蚤不仅密度大,而且对单细胞棕囊藻的摄食率也高(图3)。单就大小而言,根据摄食粒径理论,从无节幼体到成体,强额孔雀水蚤都是最优的捕食单细胞棕囊藻的甲壳动物[12]。虽然强额孔雀水蚤只摄食单细胞棕囊藻而不直接摄食囊体,但是在棕囊藻赤潮高发季节的加密观测发现,棕囊藻的囊体密度最高值与强额孔雀水蚤丰度的高值错峰出现(图4)。在不考虑囊体碎片重新形成囊体的情况下,棕囊藻囊体由单细胞发展而成,因为水体中单细胞密度与囊体密度是相互关联的,所以即便不是直接摄食,强额孔雀水蚤丰度与棕囊藻囊体密度的关系曲线依然与热带捕食者与被捕食者的丰度关系曲线类似。棕囊藻是适应性很强的广布种,在高温季节也可以形成囊体[32-36]。但到目前为止,广西近岸的棕囊藻赤潮只在冬春两季发生,这可能与高温季节小型浮游动物的密度更高,从而下行控制加强有关。强额孔雀水蚤是近岸广布种,其适应的温度范围从5℃到33℃[18],调查海区的水温度变化不足以对其生长造成影响。而调查发现,虽然5月到12月的强额孔雀水蚤丰度变化趋势与水温的变化趋势类似,但其丰度变化趋势在1月到4月却与水温不匹配(图2)。这一趋势可能是水温对强额孔雀水蚤的食物和捕食者共同影响的结果。相似的,在广西近岸水温范围内,温度的变化并不会对强额孔雀水蚤摄食单细胞棕囊藻产生显著的影响(图3)。综上所述,以强额孔雀水蚤为代表的小型桡足类可能在广西近岸单细胞棕囊藻的下行控制中发挥重要的作用,应在后续的研究中给予重视。
4 结论
由于采样网具选择不恰当,以往的调查低估广西近岸强额孔雀水蚤的丰度。实际上,有大量丰度的强额孔雀水蚤在广西近岸常年存在。鉴于强额孔雀水蚤对单细胞棕囊藻的高效摄食,推测其可能在棕囊藻的下行控制中发挥着重要的作用。建议海洋工作者在研究广西近岸棕囊藻赤潮的发生机理时,应重视以强额孔雀水蚤为代表的小型桡足类的下行控制作用。
——以“不同咖啡因饮料对水蚤心率的影响”为例

