血管生成及淋巴管生成在不同亚型甲状腺乳头状癌中的临床意义*
赵迎春, 李勇
1芜湖市中医医院甲状腺乳腺外科(安徽芜湖 241000); 2芜湖市第二人民医院病理科(安徽芜湖 241000)
临床中甲状腺恶性肿瘤最常见的是乳头状癌,甲状腺乳头状癌包含数种组织亚型并且预后较好[1]。但不同组织亚型的甲状腺乳头状癌具有不同的生物学侵袭行为,尤其在最常见的经典型及滤泡型甲状腺乳头状癌中,其转移的机制并未完全了解。而血管生成及淋巴管生成是肿瘤进展过程中最基本的步骤,并反映了肿瘤微环境的基本特征。血管生成为肿瘤的生长与转移提供必要的营养,而淋巴管生成则为肿瘤的淋巴结转移提供了便利的通路[2],在肿瘤的血管生成及淋巴管生成过程中有重多的调控因子,血管内皮生长因子(vascular endothelial growth factor,VEGF)是调控肿瘤血管生成及淋巴管生成的重要刺激因子,并且能够调控内皮细胞的存活、增殖及迁移[3]。环氧化酶-2(cyclooxygenase-2,COX-2)能够调控VEGF的转录,因而能够上调VEGF的表达。有研究表明,在肿瘤中COX-2能够增加瘤体的血管密度,促进肿瘤的浸润与转移[4]。p27是周期素依赖蛋白激酶(cyclin-dependent kinase,CDK)抑制剂,主要调控细胞周期G1向S期的转变,研究表明p27的表达在多种肿瘤的诊断与预后中都起到重要的指导作用[5]。甲状腺乳头状癌虽然具有较好的预后,但其淋巴结转移的发生率较高,各种亚型肿瘤的转移机制尚不明确。本研究的目的主要探讨VEGF、COX-2及p27在各种甲状腺亚型中表达的差异及对于肿瘤血管生成和淋巴管生成的影响,从而进一步揭示不同亚型甲状腺肿瘤转移的机制。
1 资料与方法
1.1 一般资料 将芜湖市中医医院甲乳外科2017年1月至2019年12月收治的共69例可切除原发性甲状腺乳头状癌患者的资料纳入本研究。患者年龄23~68岁,其中年龄<50岁者21例(30.4%),≥50岁者48例(69.6%),中位年龄56岁。所有原发肿瘤的直径按照TNM分期系统分为≤2 cm为pT1期、2~4 cm为pT2期及>4 cm为pT3期,pT1共有44例,pT2有15例,pT3有10例。按照WHO病理学诊断标准有40例诊断为经典型甲状腺乳头状癌,有29例诊断为滤泡型甲状腺乳头状癌。将年龄≥50岁且有包膜浸润的患者归为高危组,其余为低危组。所有患者均行一侧甲状腺腺叶切除或甲状腺全切合并区域淋巴结清扫。另采用12例甲状腺良性疾病标本作为对照,石蜡包埋组织标本。
1.2 免疫组化染色 69例甲状腺癌与12例结节性甲状腺肿组织蜡块均行4 μm连续切片,分别作HE和免疫组织化学染色。鼠抗人单克隆抗体VEGF、COX-2、p27、D2-40及CD31抗体等相关试剂均购自福州迈新公司。免疫组化染色按照说明书步骤进行。经DAB显色后,苏木精复染,中性树胶封片。用已知阳性切片作阳性对照,PBS 缓冲液代替一抗作阴性对照。
1.3 结果判定 VEGF、COX-2及p27蛋白阳性表达主要定位于细胞的胞浆或胞核,呈棕黄色颗粒,选取5个高倍镜(×400)视野做阳性细胞计数,阳性细胞数≤10%为阴性,>10%为阳性。而微血管密度(MVD)及淋巴管密度(LVD)以CD31或D2-40染色以阳性着色的单个内皮细胞或内皮细胞簇计数,以微管或脉管内皮细胞胞质或胞膜内出现棕黄色颗粒为阳性,每张切片由2 名病理医师分别计数LVD及MVD,在双盲法下进行。参照Weidner[6]的方法对MVD及LVD进行分别统计,先在40倍光镜下确定5个着色密集的区域(hotspot),200倍光镜下分别计数5个视野,取其均值。

2 结果
2.1 VEGF、COX-2及p-27在甲状腺乳头状癌中的表达 本组病例中甲状腺癌组织中VEGF的阳性表达率为52.2%,COX-2的阳性表达率为46.4%,p27的阳性表达率为28.9%,在甲状腺良性病变中VEGF、COX-2 及p27的阳性率分别为16.7%、8.3%、33.3%,甲状腺癌组织中VEGF、COX-2阳性表达率明显高于甲状腺良性病变组织 (P<0.01),而p27的表达两者差异无统计学意义(P>0.05)。肿瘤组织中VEGF的表达、COX-2及p27的表达与患者的年龄、性别、肿瘤最大径、脉管内侵犯及包膜外侵犯无明显相关性(P>0.05),见表1。但VEGF在经典甲状腺乳头状癌中的表达阳性率明显高于滤泡型乳头状癌(P<0.05)。在年龄≥50岁的甲状腺乳头状癌中,VEGF的表达随肿瘤最大径的增大而明显升高(P=0.04),见图1;而在<50岁的患者中,VEGF的表达与肿瘤最大径无明显相关性(P>0.05)。虽然VEGF、COX-2的表达与相关临床病理因素无明显相关性,但本组病例按照VEGF及COX-2的表达细分为VEGF(-)/COX-2(-)、VEGF(-)/COX-2(+)、VEGF(+)/COX-2(-)及VEGF(+)/COX-2(+)四个亚组时发现,VEGF、COX-2表达的共同升高与肿瘤的脉管内侵犯密切相关(P=0.035),见图2。
2.2 MVD、LVD与甲状腺癌临床病理因素的关系 D2-40及CD31的在甲状腺癌中阳性表达见图3。MVD与患者的年龄、性别、肿瘤最大径、COX-2的表达、p27的表达无关(P>0.05),但与风险的高低、脉管内侵犯、肿瘤包膜外侵犯及VEGF的表达密切相关(P<0.05)。而LVD与患者的年龄、性别、肿瘤最大径、VEGF、COX-2及p27的表达、风险的高低、肿瘤包膜外侵犯等无关,但与组织亚型密切相关(P<0.05),进一步亚组分析发现在滤泡型甲状腺癌中COX-2的表达与LVD密切相关(P<0.05),见表2。分析MVD在预测脉管内浸润中的作用,绘制受试者工作曲线(ROC)发现MVD>6.52时预测脉管内浸润敏感度达到79.41%,特异度达到83.79%,见图4。
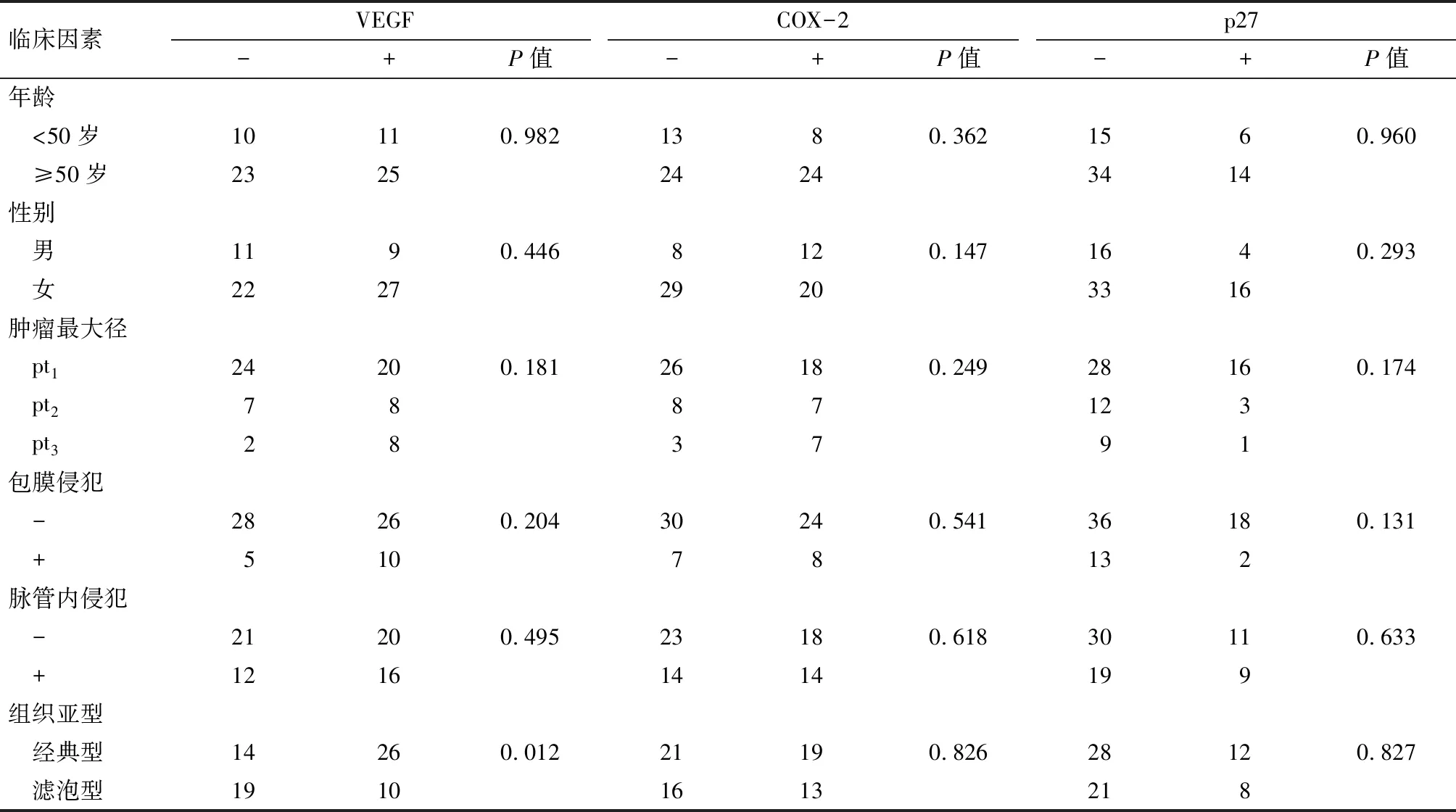
表1 VEGF、COX-2、p27与临床病理因素的关系 例
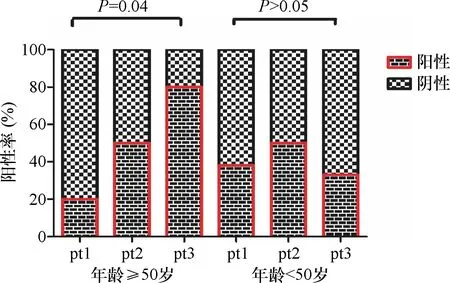
图1 不同年龄中VEGF的阳性表达率与肿瘤直径的关系
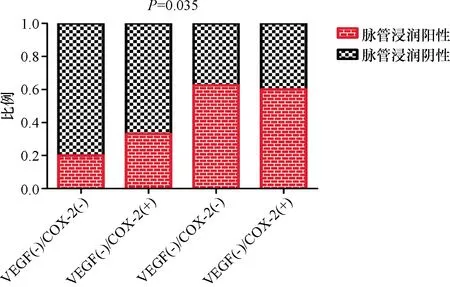
图2 VEGF与COX-2的共表达与脉管内浸润的关系

注:A:D2-40在甲状腺癌中的阳性表达,箭头所示为淋巴管;B:CD31在甲状腺癌中的阳性表达,箭头所示为微血管
表2 LVD、MVD与甲状腺癌临床病理因素的关系

图4 ROC曲线显示MVD预测脉管内浸润的敏感度与特异度
2.3 不同亚型甲状腺乳头状癌血管、LVD的差异 LVD与甲状腺乳头状癌的临床病理因素无明显的相关性(P>0.05),但在滤泡型甲状腺乳头状癌中LVD(9.13±1.78)明显高于MVD(5.73±1.25)(P<0.05),也高于经典型甲状腺癌的LVD(7.82±1.46)(P<0.05),且滤泡型甲状腺乳头状癌中LVD与脉管内侵犯密切相关(P<0.05)。经典型甲状腺乳头状癌中两者的密度却差异无统计学意义(P>0.05)。但滤泡型甲状腺乳头状癌的MVD明显低于经典型甲状腺乳头状癌(P<0.05),而且经典型甲状腺乳头状癌的VEGF的阳性表达率(65.0%)明显高于滤泡型甲状腺乳头状癌(34.5%)(P<0.05),但在滤泡型甲状腺乳头状癌中COX-2的表达与P27的表达呈明显负相关(r=-0.455,P<0h05),在经典型甲状腺乳头状癌中两者的表达无明显相关性(P>0.05)。
3 讨论
甲状腺癌的进展主要依赖于肿瘤血管生成的程度[7]。与以往的研究相同,本研究发现,高风险组、包膜外侵犯及脉管侵犯的甲状腺癌具有更高的MVD,而MVD预测甲状腺癌发生脉管侵犯的敏感度达到79.41%,特异度达到83.79%。而在甲状腺乳头状癌组织中VEGF的表达与MVD及肿瘤的大小密切相关,且VEGF与COX-2的共表达与脉管内侵犯密切相关,说明VEGF与COX-2在乳头状癌中可能共同调控了肿瘤的生长及肿瘤微血管的密度。但是作为肿瘤的异质性,不同亚型的甲状腺乳头状癌血管生成及淋巴管生成的机制并不完全相同。在滤泡性甲状腺乳头状癌中,LVD明显高于MVD,而在经典甲状腺乳头状癌中,两者的密度并无差异;另外与经典乳头状癌相比,滤泡性乳头状癌的MVD相对降低,但LVD却明显升高。相应地在滤泡性乳头状癌中VEGF的阳性表达率也明显低于经典乳头状癌。进一步证实在经典型乳头状癌中VEGF可能在血管生成方面起到重要的调控作用,而在滤泡型乳头状癌中COX-2与p27在调控淋巴管生成方面起到重要的调控作用。
脉管内及包膜外侵犯是体现甲状腺侵袭性的重要标志[8],肿瘤发生脉管内侵犯后使得肿瘤细胞更易通过血管或淋巴管进行播散,使得肿瘤转移的发生。本研究发现MVD与脉管内侵犯,包膜外侵犯密切相关,而且与高危组甲状腺癌密切相关。Alitalo等[9]研究发现甲状腺乳头状癌中MVD越高,患者的复发风险越大,无病生存期也会越短,这也进一步证实了本研究的结果。
大量研究表明,VEGF mRNA及蛋白的表达在进展期甲状腺癌原发病灶及转移灶中都明显升高[10],而且VEGF mRNA的表达随着肿瘤的增大会明显升高。与上述研究的结论相同,本研究发现VEGF的阳性表达率在甲状腺乳头状癌中明显升高,但其与肿瘤病灶的直径,包膜侵犯及脉管内侵犯等临床病理因素并无明显关系,但VEGF的表达与MVD密切相关,而且在50岁以上患者中VEGF的表达随肿瘤的增大明显增加,pT3肿瘤中的VEGF阳性表达率最高,提示可能随着肿瘤的增大肿瘤内缺氧及酸性的环境刺激肿瘤大量分泌VEGF的表达,从而为肿瘤的生长提供更多的血供。但COX-2的表达与MVD及相关的临床病理因素并无明显相关性,提示在甲状腺乳头状癌的血管生成中,可能VEGF起到了重要的调控作用。
淋巴管生成对于肿瘤的淋巴结转移及全身转移的发生起到重要的促进作用,既往大量研究表明[11]淋巴管生成因子VEGF-C的表达与LVD与甲状腺癌淋巴结的转移密切相关,本研究也表明VEGF与COX-2的共表达与脉管浸润密切相关,提示VEGF或COX-2可能共同促进了肿瘤的浸润与转移。
研究表明[12],滤泡型甲状腺乳头状癌与经典型甲状腺乳头状癌在形态及临床表现方面都完全不同,本研究发现两者在血管生成及淋巴管生成方面也存在较大的差异性。这与Lang等[13]的研究结论相同,说明在不同的甲状腺癌组织亚型中血管生成与淋巴管生成在肿瘤转移发展中可能起到完全不同的作用。本研究发现在滤泡型乳头状癌中COX-2的高表达常常伴随着p27的低表达及LVD的增加。这可能与COX-2的表达上调了前列腺素E2的表达,而前列腺素E2的表达能够促进p27的磷酸化,从而促使p27降解而使得淋巴内皮细胞增殖,因此在滤泡型乳头状癌中COX-2与p27的表达对调控LVD起到重要的作用。但在经典甲状腺乳头状癌中,VEGF的高表达与MVD密切相关,提示在经典甲状腺乳头状癌中VEGF的表达对MVD起到重要的调控作用。
综上所述,在不同组织亚型的甲状腺乳头状癌中血管生成与淋巴管生成可能在肿瘤的浸润转移中发挥不同的作用,而VEGF、COX-2及p27在肿瘤的血管生成及淋巴管生成中也起到不同的调控作用。在经典型甲状腺乳头状癌中VEGF的高表达可能促进了血管生成作用,使得肿瘤更易生长与转移;而在滤泡型甲状腺乳头状癌中COX-2的高表达降解了p27的表达,促进了淋巴管的大量生成从而使得肿瘤更易发生浸润与转移。理解不同亚型肿瘤发生转移的不同机制,为肿瘤的个体化治疗提供了理论依据,也为将来的靶向治疗提供了新的作用靶点。

