表观扩散系数值对不同Gleason评分前列腺癌的诊断价值
成戈, 周智鹏, 陈鑫辉
桂林医学院附属医院放射科(广西桂林 541001)
前列腺癌是成年男性中最为常见的恶性肿瘤之一,其5年生存率从局部疾病的100%到转移性前列腺癌的29%不等[1]。1974年实施的Gleason评分(GS)是局部疾病预后的一个强有力的预测指标,是目前临床应用最广泛的前列腺癌病理分级系统;该评分系统可以对前列腺癌危险度进行评估,并指导临床治疗策略的选择;不同Gleason评分的前列腺癌临床预后差异显著,众多研究表明[2-3],高分级前列腺癌与低分级相比,具有较高侵袭性及显著的高复发转移率。一些最新的研究提出[4-5],前列腺癌的预后不仅仅在不同Gleason评分中表现不同,甚至在相同Gleason评分的不同Gleason模式(Gleason Pattern GP)中亦存在差异;比如对于同样为7分的前列腺癌行根治性前列腺切除术,不同Gleason模式的复发率差异显著,GP3+4的5年生存率为88%,而GP4+3前列腺癌仅为63%。以上研究表明,术前对于前列腺癌的精准评分具有重要的临床意义。前列腺多参数MRI(prostate multiparametric MRI,mpMRI)是目前临床检测和定位前列腺癌,指导治疗和前列腺癌风险分层的有效检查手段,而扩散加权成像(DWI)和表观扩散系数(ADC)图因其可显著提高前列腺癌检出、定位的准确度,已经被纳入美国放射学会标准化mpMRI协议。但DWI技术的运用目前多集中在前列腺癌的检出及定位方面,关于DWI和ADC值与Gleason评分之间相关性的研究报道较少。目前,多数研究将穿刺活检结果作为病理对照的标准,但是有文献报道[6-7],该方法所取得的病理结果准确度有限,这也影响了各研究结果的准确性,故本研究为排除这种干扰,选择前列腺切除术所取得的病理结果作为金标准。本研究目的是评估DWI技术与Gleason评分之间的相关性,旨在为前列腺癌的诊疗及预后预测提供参考。
1 资料与方法
1.1 一般资料 收集桂林医学院附属医院2017年1月至2019年6月期间符合以下标准的患者。
纳入标准:(1)所有患者术前均行规范MRI扫描,MRI扫描序列包括T1WI、T2WI、动态增强(DCE)-T1WI、DWI。(2)MRI 扫描发现明确占位性病变并且影像学高度怀疑前列腺癌。(3)MRI扫描完成后2周内进行了根治性前列腺切除术,术后病理证实为前列腺癌,并且根据Gleason评分病理分级明确。
排除标准:(1) MRI 扫描前进行过前列腺癌相关治疗。(2)MRI扫描序列不完善,扫描图像质量不佳,不能用于诊断。(3)肿瘤较大侵犯周围组织。(4)合并其他肿瘤患者。
根据以上标准,最终入组患者84例,年龄53~82岁,平均(65.3±7.1)岁。根据Gleason评分结果,将84例患者分为3组,GS<7分13例,GS=7分32例,GS>7分39例。
1.2 检查方法 采用SiemensMagnetomVerio3.0TMRI扫描仪,16通道相控阵腹部线圈,扫描范围自腹主动脉分叉处至耻骨联合。扫描序列及参数:(1)TSE T1WI,TR 668 ms,TE 13 ms,层厚6 mm,层间距1.8 mm,FOV 380×380 mm,矩阵384×384;(2)TSET2WI,TR 3 330 ms,TE 103 ms,层厚3 mm,层间距0.6 mm,FOV 200×200 mm,矩阵320×320;(3)DWI,b值分别为0、400、800 s/mm2,TR 6 300 ms,TE 83 ms,层厚3.5 mm,层间距0 mm,FOV 220×220 mm,矩阵102×102;(4)DCE-T1WI,采用T1VIBE技术,TR 5.42 ms,TE 1.97 ms,层厚4 mm,层间距0.8 mm,FOV 260×260 mm,矩阵256×256。经肘静脉团注对比剂钆喷酸葡胺,总量为0.1 mmol/kg,注射速率为2.0 mL/s,连续扫描12个期相,扫描总时间为2 min 57 s。
1.3 图像分析及处理 将扫描完成的图像传输至PACS系统,由2名副主任医师根据T1WI、T2WI、DWI、DCE-T1WI图像及手术记录在ADC图上手动勾画前列腺癌灶感兴趣区(regionofinterest,ROI)。ROI选定标准:(1)癌灶的感兴趣区选择尽量放置于病灶中央,不超过病灶边缘,并且需避开囊变、坏死区域。(2)感兴趣区大小保持一致,均为15~25 mm2,分别测量3次,取其平均值。
1.4 病理学检查 所有患者均行根治性前列腺切除术,取得标本由病理科医师进行Gleason评分。

2 结果
2.1 不同Gleason评分组间ADC值 GS<7分组ADC值为(0.805±0.040)×10-3mm2/s;GS=7分组ADC值为(0.680±0.245)×10-3mm2/s ;GS>7分组ADC值为(0.533±0.015)×10-3mm2/s ;GS<7分与GS>7分两组之间及GS=7分与GS>7分两组之间ADC值差异有统计学意义(P<0.05)。见图1~3。
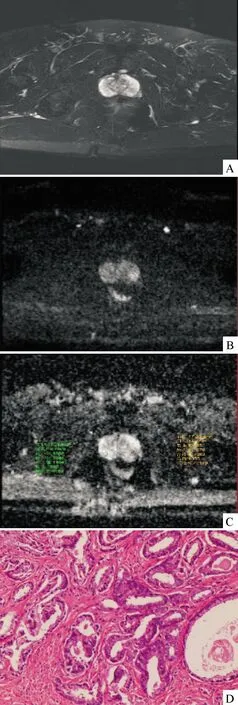
注:A:T2WI示前列腺左侧外周带信号减低;B:DWI示癌灶呈高信号;C:ADC图示癌灶呈稍低信号,ADC值为1.06×10-3mm2/s;D:病理切片,Gleason5分(HE,×10)
2.2 ROC曲线分析 ADC值可对GS<7分和GS>7分及GS=7分和GS>7分进行鉴别。分别绘制GS<7分与GS>7分及GS=7分与GS>7分组ADC值ROC曲线并计算AUC(图4~5)。ADC值对于GS<7分和GS>7分及GS=7分与GS>7分的鉴别具有较高的敏感度与特异度,ADC值取0.655×10-3mm2/s,鉴别GS<7分与GS>7分敏感度、特异度最高;ADC值取0.625×10-3mm2/s,鉴别GS=7与GS>7分敏感度、特异度最高。见表1。
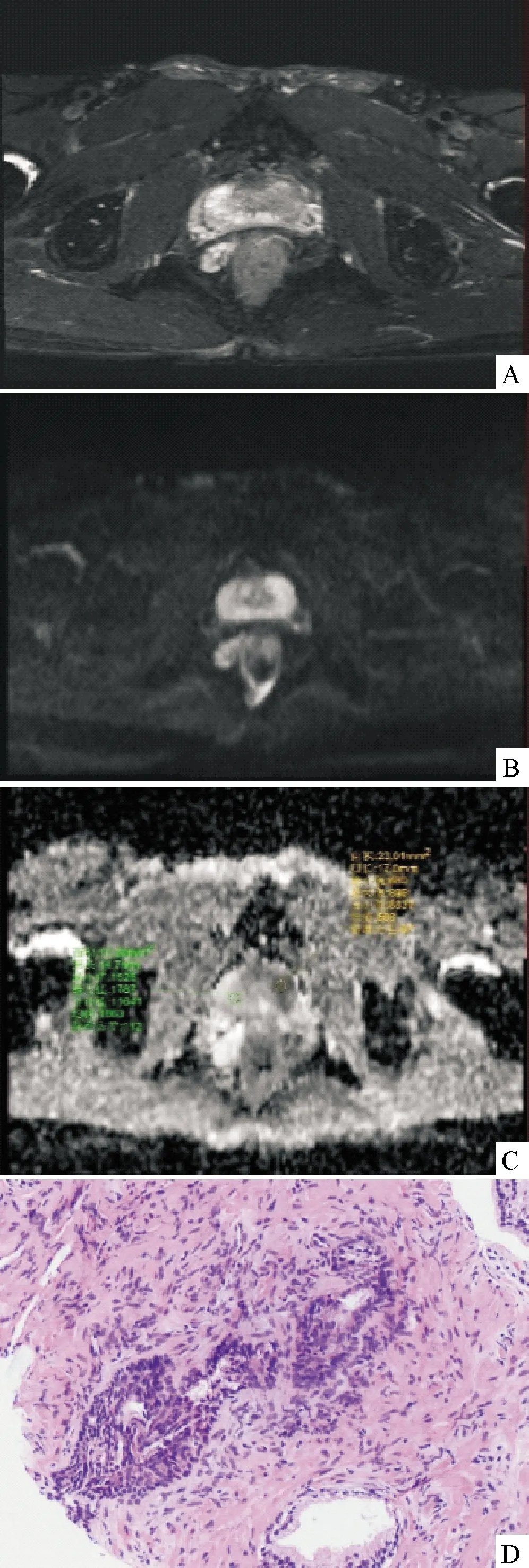
注:A:T2WI示前列腺左侧外周带及移行带信号减低;B:DWI示癌灶呈高信号;C:ADC图示癌灶呈低信号,ADC值为0.83×10-3mm2/s;D:病理切片,Gleason 7分(HE,×10)
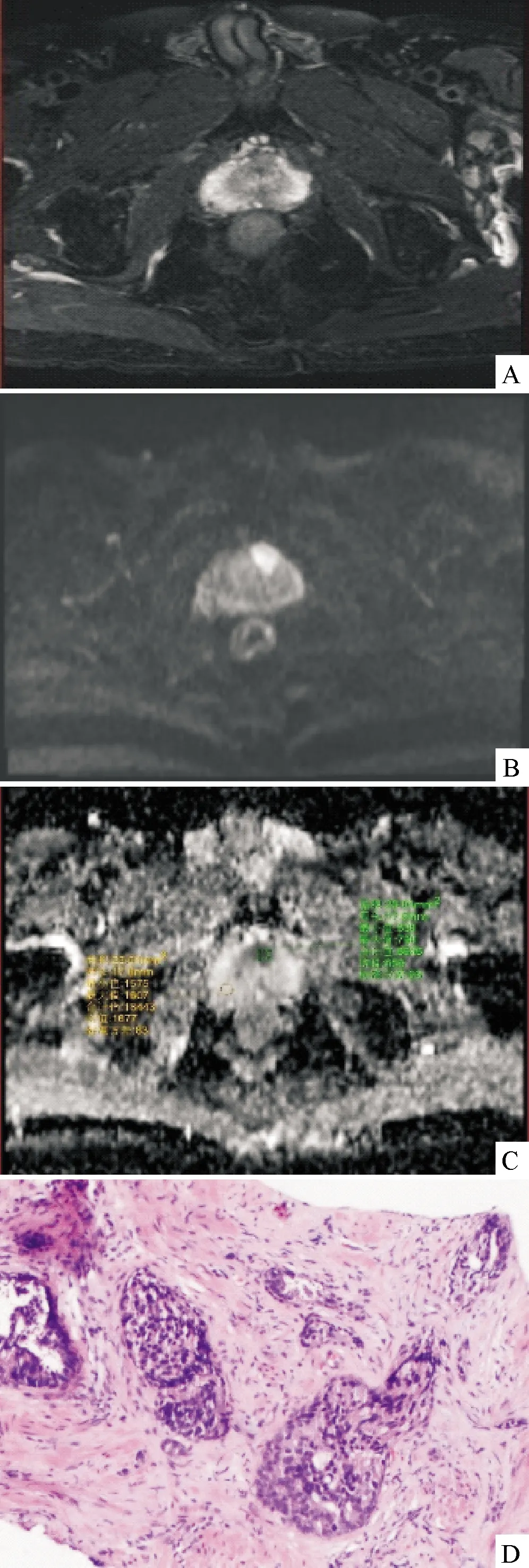
注:A:T2WI示前列腺左侧移行带信号减低;B:DWI示癌灶呈高信号;C:ADC图示癌灶呈低信号,ADC值为0.66×10-3mm2/s;D:病理切片,Gleason 9分,(HE,×10)
3 讨论
Gleason评分系统是目前临床最常用的评价前列腺癌生物学侵袭特征的病理学标准。该评分系统是根据HE切片中镜下癌组织的主要结构和次要结构进行分级,共分为1~5个级别,1级代表肿瘤分化程度高,预后最好;5级代表肿瘤分化程度低,预后最差。GS=主要结构评分+次要结构评分,共分为2~10分,9个等级,不同的病理评分的前列腺癌治疗方法及预后存在很大差异,Gleason评分越高,肿瘤侵袭性越强,复发转移率越高,目前普遍认为[8],GS<7分提示预后良好,GS≥7分提示预后不良,而GS>8分需高度怀疑淋巴结转移可能。目前临床主要通过根治性前列腺切除术来确定Gleason评分,术前通过经直肠超声引导下前列腺穿刺活检术亦是Gleason评分的常用方法,但该方法仅仅表现出了适度的准确性,有研究表明[6-7],临床中经常出现活检标本的Gleason评分低于手术大体标本Gleason评分的现象,通过根治性前列腺切除术进行评分升级的比例甚至达到了43%。而穿刺活检术由于穿刺针数较多,往往会检出一些微小及惰性行为低风险前列腺癌,客观上导致过度诊断及过度治疗,此类患者推荐主动监测,应避免根治性前列腺切除术的治疗。迄今为止,仍没有一种风险分层工具能够以足够的准确度预测根治性前列腺切除术的Gleason评分。而且由于穿刺活检术为有创性检查,加重了患者的不适并增加了并发症发生风险,常见并发症包括穿刺后的感染及全身脓毒血症等。因此,寻找一种无创、可靠的Gleason评分评估方法,以提供准确的预后评估及选择适当的治疗管理方案具有重要的临床意义。
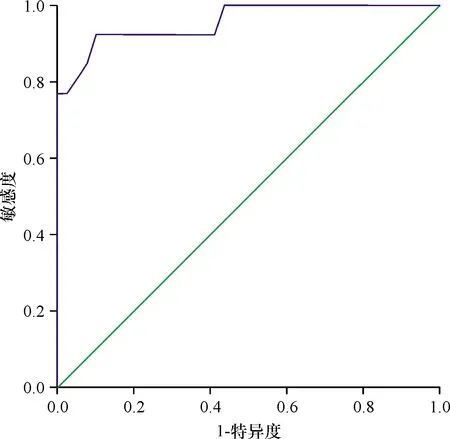
图4 ADC值鉴别GS<7分与GS>7分诊断效能的ROC曲线
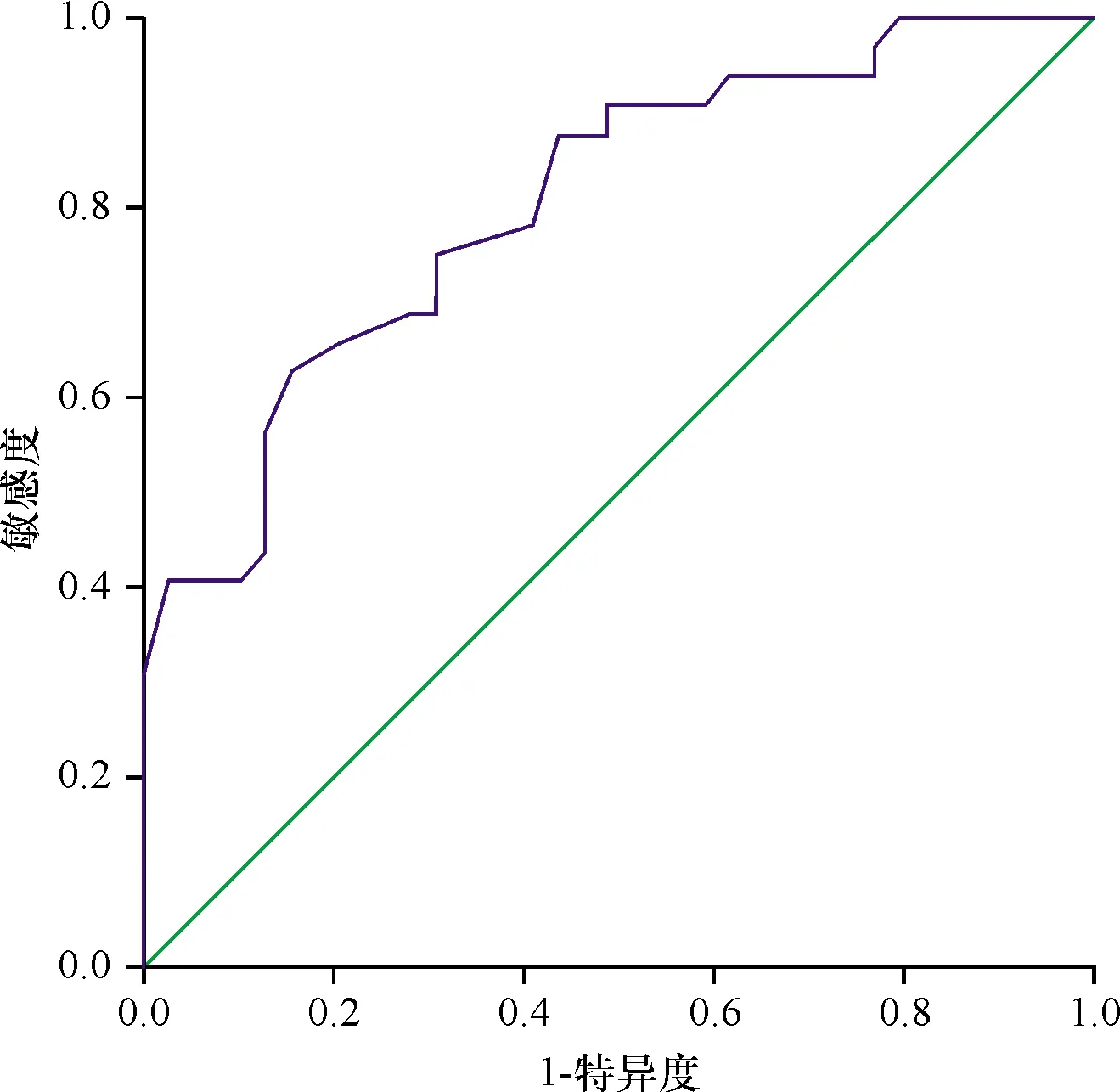
图5 ADC值鉴别GS=7分与GS>7分诊断效能的ROC曲线

表1 ADC值对不同GS分值人群的诊断效能
DWI技术,由于其良好的反应活体组织内水分子扩散情况的特性,已被广泛应用于改善肿瘤检测和肿瘤定位中。正常组织中,水分子扩散是一种随机的热运动,正常前列腺组织的间质较稀疏,水分子扩散运动自由性较高,当正常腺体组织发生癌变时,正常腺体被排列紧密的肿瘤细胞所取代,细胞密度增大,细胞间隙减小,此外,肿瘤细胞细胞核形态发生变化,核质比改变,均造成水分子扩散运动明显受限,MRI图像上表现为DWI信号增高,相应ADC值减低。目前,由DWI得到的表观扩散系数(ADC)对前列腺癌及良性前列腺增生的鉴别作用已经被多数学者肯定,然而,目前对于ADC值在不同Gleason评分中的研究仍较少,最新的一些研究表明[9-11],由DWI得到的ADC和Gleason评分之间存在重要关联。这些研究提示,ADC值可能潜在地作为前列腺癌治疗选择的预后生物标志物,并且可以有效改善当前风险分层策略存在的有创性问题。然而,ADC值与Gleason评分之间的关系程度在这些研究之间仍存在分歧,并且对于不同Gleason评分前列腺癌并未形成统一的ADC值诊断标准。造成这种现象的原因一方面是由于部分研究把穿刺活检术作为对照标准,病理学结果本身存在不准确性导致研究结果存在偏倚。另一方面,目前多数关于ADC值的研究均基于不同b值基础,这也会导致各研究结果间存在差异。
本研究结果显示,GS<7、GS=7、GS>7三组的ADC值呈现逐渐减低趋势,ADC值对GS<7与GS>7以及GS=7与GS>7具有鉴别诊断价值,对GS=7与GS<7无鉴别诊断价值。该种趋势亦符合前列腺癌的病理组织学特性,前列腺癌组织的分化程度不同,其结构亦显著不同,低分化癌组织与高分化相比,肿瘤细胞核浆显著增大,细胞外间隙减少,水分子扩散能力减低,从而导致其ADC值低于高分化癌组织。部分学者的研究中也体现出ADC值与Gleason评分之间存在负相关[12-13];本研究进一步通过ROC曲线比较ADC值对于GS<7与GS>7以及GS=7与GS>7的诊断效能结果显示,ADC值对GS<7与GS>7以及GS=7与GS>7的鉴别诊断具有较高的敏感度与特异度。ADC值取0.655×10-3mm2/s,鉴别GS<7和GS>7敏感度、特异度最高,敏感度为92.3%,特异度为82.7%; ADC值取0.625×10-3mm2/s,鉴别GS=7与GS>7敏感度、特异度最高,敏感度为62.5%,特异度为84.6%。通过本研究可以发现ADC值对于GS<7与GS>7的诊断敏感度、特异度要显著高于GS=7与GS>7,说明Gleason评分差异越大,ADC值的诊断效能越高。另一些研究结果[14-15]与本实验结果存在一定差异,这些研究结果显示,ADC值在不同Gleason评分前列腺癌中均存在较为显著的差异,而本研究中GS<7与GS=7之间ADC值差异无统计学意义。笔者分析认为,造成这种差异的原因可能是由于低评分前列腺癌在临床中较为少见,多数研究中所收集到的GS<7病例数较少,从而导致各研究结果存在差异。此外,这些学者的研究多数是基于穿刺活检作为病理对照,亦可能对实验结果存在影响;而本研究的优势在于采用根治性前列腺切除术所得到的病理结果作为金标准,排除了穿刺活检术结果不准确的干扰。所以,笔者认为本研究结果具有较好的可信度。当然,本研究也存在一定的局限性。GS<7分病例数较少可能对结果造成偏倚。另外,有文献表明,Gleason评分本身的确定在病理学中是可变的[16],参考标准的这种固有的异质性是目前放射学界研究中未考虑的ADC指标性能变化的另一潜在来源。
综上所述,本研究结果表明ADC值对于不同Gleason评分的前列腺癌具有较好的诊断效能,可以初步判定前列腺癌的生物学行为,为治疗方案的选择及预后评估提供一种较为可靠的影像诊断依据,是值得继续探索的研究方向。

