尿NGAL及KIM-1水平对藏区糖尿病肾脏病的临床诊断价值研究
张盈莹 卓永 欧佩 李晨光 赵耕,
1天津医科大学朱宪彝纪念医院检验科,国家卫生健康委员会激素与发育重点实验室(天津医科大学),天津市代谢性疾病重点实验室,天津医科大学朱宪彝纪念医院&天津市内分泌研究所 300134; 2西藏自治区昌都市藏医院检验科 854000
2型糖尿病(T2DM)是由于胰岛β细胞分泌胰岛素不足或靶细胞对胰岛素不敏感所致的慢性代谢紊乱性疾病。在美国,T2DM是导致慢性肾脏疾病的主要原因之一,大约占终末期肾脏疾病新发病例的44%[1]。在我国,糖尿病肾脏病(DKD)同样是糖尿病患者最重要的并发症之一,其发病率逐年上升,目前已成为终末期肾脏疾病的第二大原因[2]。近年来,随着藏区人民生活水平的提高,藏区内T2DM的发病率不断上升,糖尿病相关肾病的发病率也随之升高。DKD早期仅表现为微量白蛋白尿,而随着病情发展,逐渐出现肾功能损害甚至肾衰竭等不可逆损伤,严重影响患者的生活质量以及预后。因此,对DKD进行早期诊断,使患者尽早得到有效治疗尤为重要。
目前,临床多使用尿白蛋白/肌酐比值(ACR)和血肌酐对早期DKD进行诊断。然而,ACR根据随机尿进行检测,结果容易受饮食、饮水以及生理状态波动的影响,重复性较差。血肌酐则较不敏感,当肾小球滤过率下降到50%时,才会较快升高[3]。为了更好的对DKD进行早期诊断,近年来,新的诊断标志物成为研究的热点。研究表明,在T2DM早期肾损伤时,尿中性粒细胞明胶酶相关脂质运载蛋白 (NGAL)及尿肾损伤分子-1(KIM-1)浓度会明显升高[4-6]。但可能是由于地域、种族差异等影响,各研究得出的KIM-1和NGAL的诊断效果相差较大。本研究以藏区T2DM DKD患者作为研究对象,首次对藏区患者中尿KIM-1和NGAL的临床诊断价值进行评估,探讨尿KIM-1、NGAL用于T2DM DKD早期诊断的可能。
1 对象与方法
1.1 研究对象 选取2019年1—6月在昌都市藏医院治疗的150例DKD患者作为研究对象,患者根据24 h尿检连续尿白蛋白排泄率(UAER)水平分为:正常白蛋白尿(DM1)组、微量白蛋白尿(DM2)组、临床白蛋白尿(DM3)组,每组各50例患者。同时随机选取同期健康体检者50名作为对照组。纳入标准:(1)符合T2DM合并肾病诊断标准。(2)年龄在40~70岁。(3)神志清楚,生命指征平稳,能配合治疗。(4)签署知情同意书。排除标准:(1)原发性高血压病、妊娠或哺乳期。(2)存在泌尿系结石、肾小球肾炎或肾盂肾炎等其他病因导致的急性肾损伤。(3)合并创伤、手术、感染等应激情况,或正在使用全身性皮质醇治疗等影响糖代谢药物。(4)伴恶性肿瘤、恶性血液病、结缔组织病。(5)病例资料不完整。
1.2 相关标准 T2DM诊断标准:参照 2013年版T2DM防治指南提出的糖尿病诊断标准[7]:(1)空腹血糖≥7.0 mmol/L。(2)口服葡萄糖耐量试验(OGTT)中,2 h血糖≥11.1 mmol/L,无典型表现的患者应该择日再测定1次。(3)具有“三多一少”(多饮、多食、多尿、体重降低)等糖尿病的典型表现,且随机血糖测定≥11.1 mmol/L。
糖尿病合并肾病诊断及分期标准:根据肾脏损伤的严重程度,按照Mongensen分期如下:(1)正常白蛋白尿(DM1):24 hUAER<30 mg/24 h。(2)微量白蛋白尿(DM2):3个月内UAER为30~300 mg/24 h。(3)临床白蛋白尿(DM3):UAER>300 mg/24 h。
1.3 研究方法
1.3.1 标本采集 患者入院第2天清晨采集空腹静脉血及清洁中段尿,其中,肝素抗凝血离心后,血清用于空腹静脉血糖、血肌酐、甘油三酯、总胆固醇等生化项目的检测;EDTA抗凝血用于糖化血红蛋白检测。尿KIM-1和尿β2微球蛋白(β2-MG)的检测:患者用无菌管收集清洁中段尿液3 ml,离心20 min左右(2 000~3 000 r/min,r=20.9 cm),仔细收集上清,保存过程中如有沉淀形成,应再次离心。患者于入院第2天清晨开始留取24 h尿,留取完成后,记录总尿量,混匀,并吸取5 ml置于干净试管内用于24 h尿微量白蛋白检测。
1.3.2 指标检测 采用日立公司008AS全自动生化分析仪测定尿素(尿素酶-谷氨酸脱氢酶法)、肌酐(肌氨酸氧化酶法)、甘油三酯(GPO-PAP酶法)、总胆固醇(CHOD-PAP酶法)、胱抑素C(胶乳增强免疫比浊法)、尿β2-MG(胶乳增强免疫比浊法)、HbA1c(胶乳免疫比浊法)、尿微量白蛋白(MAlb)(免疫透射比浊法)、NGAL(胶乳免疫比浊法),配套试剂由四川迈克生物公司提供。尿KIM-1采用酶联免疫吸附法,所有检测均严格按照说明书进行。24 hUAER=尿微量白蛋白(UmAlb)×尿量;采用MDRD方程计算估算肾小球滤过率(eGFR),即eGFR=175×血肌酐(SCr)-1.234×年龄-0.179×性别(男性=1,女性=0.79)[8]。

2 结果
2.1 一般资料及相关生化指标分析 不同阶段DKD组及对照组的一般资料及相关生化指标比较如表1所示。其中,患者的一般资料比较,性别、吸烟、饮酒各组间差异无统计学意义(P均>0.05),而DKD组年龄高于对照组(P<0.05)。相关生化指标中,DKD组空腹血糖、HbA1c、甘油三酯及总胆固醇均高于对照组(P均<0.05),而各阶段DKD组间比较差异无统计学意义(P>0.05)。
2.2 肾损伤相关指标分析 不同阶段DKD组及对照组的肾损伤相关指标分析如表2所示。其中,DM3、 DM2、DM1、对照组尿微量白蛋白、肌酐、胱抑素C、尿β2-MG、尿NGAL及尿KIM-1水平均逐渐降低,且各组间比较差异均有统计学意义(P均<0.05);而DM1组与NC组、DM1组与DM2组血尿素氮水平差异无统计学意义(P均>0.05),其余各组间比较差异均有统计学意义(P均<0.05); DM1组与NC组eGFR水平差异无统计学意义(P>0.05),其余各组间比较差异均有统计学意义(P均<0.05)。

表1 4组患者一般资料及相关生化指标比较

表2 4组患者肾损伤相关指标比较
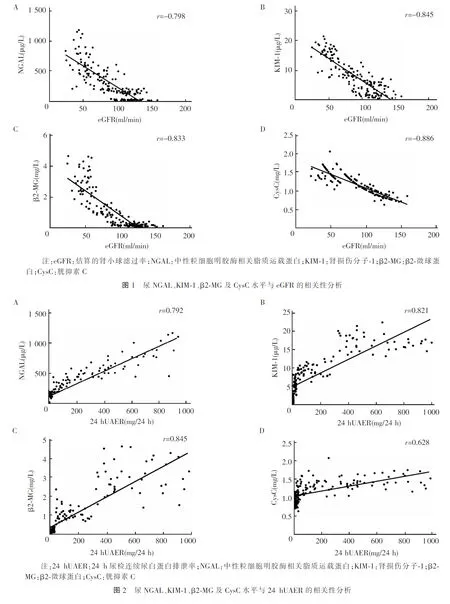
2.3 尿NGAL、尿KIM-1、尿β2-MG、尿CysC水平与eGFR、24 hUAER的相关性分析 尿NGAL、KIM-1、β2-MG、CysC水平与eGFR相关性分析如图1所示,尿NGAL及KIM-1与eGFR呈负相关,r分别为-0.798和-0.845;尿β2-MG、CysC与eGFR呈负相关,r分别为-0.833和-0.886。尿NGAL、KIM-1及β2-MG、CysC水平与24 hUAER相关性分析如图2所示,尿NGAL及尿KIM-1与24 h UAER呈正相关,相关系数r分别为0.792和0.821;尿β2-MG、CysC与24 hUAER呈正相关,r分别为0.845和0.628。
2.4 尿NGAL、尿KIM-1单独或联合应用于DKD的诊断效能评价 采用ROC曲线评价尿NGAL、KIM-1单独或联合应用于DKD的诊断效能,结果如图3所示。尿NGAL单独用于诊断DKD的AUC值为0.876(95%CI: 0.821~ 0.931),当取切点值211.6 μg/L时,敏感性为0.802,特异性为0.851。尿KIM-1单独用于诊断DKD的AUC值为0.861(95%CI: 0.811~ 0.924),当取切点值7.40 μg/L时,敏感性为0.837,特异性为0.878。尿NGAL、KIM-1联合应用于DKD的诊断AUC值为0.914(95%CI: 0.843~ 0.954)。

3 讨论
DKD是T2DM最常见的并发症之一,严重影响糖尿病患者的生活质量以及预后。近年来,随着T2DM发病率的不断上升,DKD的患病率也随之升高。DKD早期发病较为隐匿,临床症状不明显,容易被忽略,从而导致不可逆的肾脏损伤。因此,对DKD进行早期诊断、治疗,有助于逆转肾脏损伤、改善患者的生活质量以及预后。基于KDOQI的定义,DKD的诊断是基于白蛋白尿增加和eGFR下降[9-10]。然而,在患有肾小球滤过功能减退相关肾病的T2DM患者中,约有30%~ 45%的患者没有发现白蛋白尿增加[11]。且随着DKD肾功能的改变,eGFR的降低出现较晚[12]。白蛋白尿和eGFR均不能及早的准确反映肾脏受损程度以及疾病进展情况,临床亟需新的诊断指标,更为准确地评估DKD的早期肾损伤及损伤程度。

NGAL属于脂calin家族,是由肾小管细胞、肝细胞和免疫细胞分泌的蛋白质,是人脂质运载蛋白家族中的一个新成员,与中性粒细胞的明胶酶共价相连,参与调节免疫应答,在调节糖脂类和能量代谢中起重要作用[17]。NGAL在肾脏早期缺血损伤时即可产生并分泌到尿液中,因此有希望成为DKD早期诊断的敏感生物标志物。已有研究表明,T2DM患者尿中NGAL的出现早于尿微量白蛋白,可以用于提示早期肾小球损伤[18]。最近的一项研究报道,T2DM患者尿NGAL水平明显高于正常体检者,微量和大量白蛋白尿患者尿NGAL水平明显高于正常白蛋白尿患者,且与尿白蛋白排泄呈正相关[19]。另一项研究发现,在没有早期肾小球损伤症状且尿白蛋白正常的糖尿病患者中,已经出现尿NGAL水平升高,表明尿NGAL可以作为早期DKD的备选标志物[20]。Yang等[21]对74例T2DM患者进行1年随访观察研究发现,从正常白蛋白尿组到大量白蛋白尿组基线和随访尿NGAL均呈上升趋势,尿NGAL与CysC、尿素氮、血清肌酐呈正相关,与GFR呈负相关,提示尿NGAL可用于预测T2DM患者DKD的进展。
在本研究中,从对照组、DM1组、DM2组到DM3组,尿NGAL及KIM-1水平逐渐升高,尿NGAL、KIM-1水平与白蛋白尿呈正相关,与eGFR呈负相关,尿NGAL及KIM-1可以明显区分阴性对照组、正常白蛋白尿组、微量白蛋白尿组、临床白蛋白尿组,因此,尿NGAL及KIM-1可以用于疾病进展的预测。尿NGAL及KIM-1水平在正常白蛋白尿组明显高于对照组,表明尿NGAL及KIM-1水平变化早于白蛋白尿的出现,具有早期诊断意义。在ROC曲线分析中,尿NGAL的AUC为0.876,诊断敏感性和特异性分别为0.802和0.851;尿KIM-1的AUC为0.833,诊断敏感性和特异性分别为0.837和0.878;在相关性分析中,尿NGAL、KIM-1与eGFR的相关系数分别为-0.798和-0.845;尿NGAL及KIM-1与24 h UAER的相关系数分别为0.792和0.821。因此,在诊断DKD时,尿KIM-1与尿NGAL相比,具有更好的敏感性和特异性,但尿NGAL的AUC高于尿KIM-1。Nielsen等[22]对150例糖尿病患者进行研究,发现糖尿病组尿KIM-1水平明显高于正常对照组,而各糖尿病组组间差异没有统计学意义;尿NGAL水平在正常对照组、正常白蛋白尿组、微量白蛋白尿组、大量白蛋白尿组逐渐升高,且各组间差异均有统计学意义。梁雅灵等[23]对118例T2DM患者进行研究,发现尿KIM-1、NGAL水平在糖尿病各组中均较正常对照组显著升高,且与UACR呈正相关,但与eGFR无相关性。李晨晨等[24]研究表明,在慢性肾脏病肾小管间质损伤中,尿NGAL的诊断特异性、敏感性均优于尿KIM-1。上述研究与本研究得出结论不相符,这可能是由于本研究对象均来自于西藏地区,与其他地区存在地域和种族差异所致。为进一步探讨尿NGAL、KIM-1在DKD中的诊断意义,本研究对这两种指标联合检测进行了ROC曲线分析,结果显示,尿NGAL、KIM-1联合检测对DKD的诊断意义明显优于尿NGAL和尿KIM-1单独检测,尿NGAL、KIM-1联合检测可以作为DKD诊断的候选生物指标。
综上所述,尿NGAL、KIM-1是DKD早期诊断及疾病进展预测的敏感指标,两者联合检测可进一步提高对DKD的诊断能力。

