德国小蠊对高效氯氰菊酯抗性选育与抗性机制研究*
李秋红 刘美德 周小洁 张 勇 佟 颖 曾晓芃
(北京市疾病预防控制中心,北京市预防医学研究中心,北京 100013)
拟除虫菊酯因具有广谱的杀虫活性,且对害虫击倒速度快,在环境中易降解等特性,在防治德国小蠊中应用广泛。1991年,Atkinson等(1991)测定了美国Gainesville和Florida的德国小蠊对拟除虫菊酯类杀虫剂的敏感性,发现其抗性系数达到27.4~337.1倍。2000年美国佛罗里达野外德国小蠊对氯氰菊酯的抗性倍数也达到93倍(Vallesetal., 2000);此外,印度野外德国小蠊对氯氰菊酯的抗性倍数为80倍(Scharfetal., 1997),新加坡22个野外品系德国小蠊对拟除虫菊酯抗性为3~468倍(Chaietal., 2010)。近年来,我国也有学者相继报道国内不同省市野外品系德国小蠊对高效氯氰菊酯产生了约2~30倍的抗性(马红梅等,2017;谭良飞等,2018;张守刚等,2019)。德国小蠊对拟除虫菊酯类杀虫剂的抗药性日趋严重。
为研究德国小蠊对高效氯氰菊酯的抗性机制,本文通过室内对德国小蠊进行高效氯氰菊酯的抗药性筛选以获得德国小蠊的抗性品系,从而比较德国小蠊抗性品系和敏感品系羧酸酯酶(Carboxlesterase,CarE)、谷胱甘肽S-转移酶(glutathione S-transferases, GSTs)和细胞色素P450(Cytochrome P450,CYP450)3种解毒酶的活性以及抗击倒个体基因型的差异,探究德国小蠊对高效氯氰菊酯抗性产生的机制,对延长高效氯氰菊酯的使用寿命以及制定科学合理的防制措施具有重要的指导作用。
1 材料与方法
1.1 试虫来源
德国小蠊敏感品系(S),采自北京市各区的餐饮、娱乐、企事业单位、工厂或医院等场所,选择抗性水平较低的试虫,在北京市疾病预防控制中心消毒与有害生物防制所医学昆虫饲养室建立种群并驯养多代,视为敏感品系。德国小蠊抗性品系(R),从敏感品系开始培育德国小蠊的抗性品系。选取其中健康、活跃的成虫,利用单一杀虫剂高效氯氰菊酯在杀死种群50%左右个体的选择压力下持续对其进行抗性筛选,筛选数代后,为保证50%左右的选择压力,适当提高用药浓度,经多代筛选后获得抗性品系。
1.2 供试药剂及试剂
99%高效氯氰菊酯(Bete-cypermethrin)原药,拜尔公司产品。其他试剂均为国产分析纯。毒扁豆碱(eserine)Fluka公司产品,α-乙酸萘酯(α-naphthol acetate,α-NA)Fluka公司产品;固蓝B盐,Fluka公司产品;十二烷基硫酸钠(SDS),Fluka公司产品;考马斯亮兰G-250,Fluka公司产品;牛血清白蛋白(bovine serum albumin, BSA),美国Sigma公司产品。PMSF(含量>99%),德国Merk公司产品;二硫苏糖醇(DTT)(含量为99%),美国Promega公司产品;甘油、EDTA、硫代硫酸钠、苯胺、KH2PO4及Na2HPO4均为国产分析纯。
1.3 酶液的制备
1.3.1羧酸酯酶 取羽化后7~14 d德国小蠊成虫10只,雌雄各半,剪掉双翅和六足,在预冷的pH 7.0的0.04 mol/L磷酸缓冲液中冰浴匀浆,然后在4 ℃,8 000 g离心30 min,取上清液抽滤后作为酶源。
1.3.2细胞色素P450 参照文献报道的方法(于彩虹等,2002)。取羽化后7~14 d德国小蠊成虫10只,雌雄各半,剪掉双翅和六足,加入一定量的0.1 mol/L磷酸缓冲液(pH 7.5,含1 mol/L EDTA、0.1 mmol/L DTT、1 mmol/L PTU、1 mmol/L PMSF和体积分数为10%的甘油),用玻璃匀浆器在4 ℃冰浴中匀浆,12 000 g(4 ℃)下离心30 min,将上清液转移至超速离心管中,28 500×g(4 ℃)条件下离心65 min,去除上清,沉淀用缓冲液重悬,同时加入PMSF、DTT至终浓度,分装保存于-82 ℃冰箱中。
1.3.3谷胱甘肽S-转移酶 取羽化后7~14 d德国小蠊成虫10只,雌雄各半,剪掉双翅和六足,在预冷的pH 6.5的0.1 mol/L磷酸缓冲液中冰浴匀浆,然后在4 ℃,10 000 g离心30 min,取上清液作为酶源。
1.4 抗性选育和生物测定
抗性品系的选育采用逐代淘汰筛选法,用丙酮将高效氯氰菊酯原药稀释成5个浓度,取2.5 mL工作液于500 mL锥形瓶,放置一夜使丙酮完全挥发。在锥形瓶中制成均匀药膜。每个浓度重复3次,再统一设置单纯丙酮为无药对照组。之后于各瓶颈处涂石腊油和凡士林的等量混合物。每瓶放10头羽化后7~14 d德国小蠊成虫,雌雄各半,24 h后记录死亡数,测得德国小蠊对高效氯氰菊酯的半数致死浓度(LC50)。以杀死种群50%左右个体的选择压力配制杀虫剂溶液,按前述制成药膜,24 h后记录死亡率并将存活个体作为下一代亲本转入正常饲养。每代用杀虫剂进行淘汰选择前均进行LC50测定,确定筛选剂量。
以丙酮为溶剂将高效氯氰菊酯配制成有效成分为0.05%的工作液。每次选取10头羽化后7~14 d德国小蠊雄性成虫,观察击倒情况,测定各品系试虫半数击倒时间(KT50),记录抗性发展情况。最后一次抗性筛选后,存活个体用PBO预处理,30 min后测定KT50,将最后击倒的5只德国小蠊取出,液氮速冻后-70 ℃保存作为下一步提取DNA的实验材料,重复5次。
1.5 酶活测定
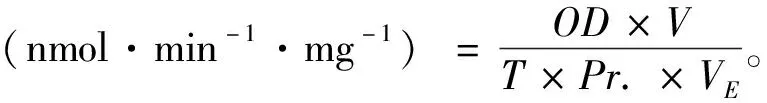
1.5.2细胞色素P450 标准曲线的制作 将标准品7-羟基香豆素加入缓冲液中,使终浓度为0~10 nmol/L,读取激发波长为368/456 nm下的荧光值,绘制标准曲线。乙氧基香豆素-O-脱乙基酶(ethoxy-coumarin-O-deethylase,ECOD)活性测定:主要参照文献方法(Hungetal.,1989;邱立红等,1999)。1.5 mL反应体系中包含0.1 mol/L Tris-HCl缓冲液(pH 7.8)、150 mmol/L KCl、1 mmol/L EDTA、0.5 mL 0.02 mmol/L的乙氧香豆素(用缓冲液溶解)。加入10 μL 10 mmol/L NADPH 启动反应,34 ℃反应1 min。
1.5.3谷胱甘肽S-转移酶 参照文献方法(Habig,1981),以CDNB为底物,采用900 μL体系,依次加入pH 6.5 0.1 mol/L磷酸缓冲液,30 mmol/L GSH,酶液,30 mmol/L CDNB。在340 nm处测定其光吸收值在5 min内的变化(OD340/min)。每组样品活性测定至少3个独立重复,每次重复测定3次。
1.6 德国小蠊钠离子通道ⅡS4~S6区击倒抗性基因片段序列分析
引物设计:根据文献(Dongetal.,1998)中报道的德国小蠊钠离子通道击倒抗性基因序列设计引物:forward primer(F):5′-G G A T A T G C C G A G A T G G A A C T T T A C-3′,reverse primer(R):5′-C C C T G A C C A A C C T G T G A A-3′。反应体系:10×缓冲液5.0 μL,dNTPs 4.0 μL,上游(F)、下游(R)引物各2.0 μL,Pyrobest DNA Polymerase(5 U/μL)5 μL,模板2.5 μL,用无酶水补足至50 μL。反应参数:94 ℃预变性3 min;94℃50 s、56℃30 s、72 ℃ 1 min 50 s,共30个循环;最后72 ℃延伸10 min。PCR产物直接测序,引物F、R用于产物的测序。
2 结果
2.1 德国小蠊对高效氯氰菊酯的抗药性选育
高效氯氰菊酯对德国小蠊连续筛选10代后抗性增至约8倍(表1)。由表1可知F0~F1代初次用药筛选后抗性增加较快,抗性倍数增加0.87。F1~F5代抗性倍数较均匀增加,平均每次用药后抗性倍数增加0.41。F5~F7抗性上升缓慢,变化不大,但F7~F10抗性发展迅速,平均每次用药后抗性倍数增加1.46。
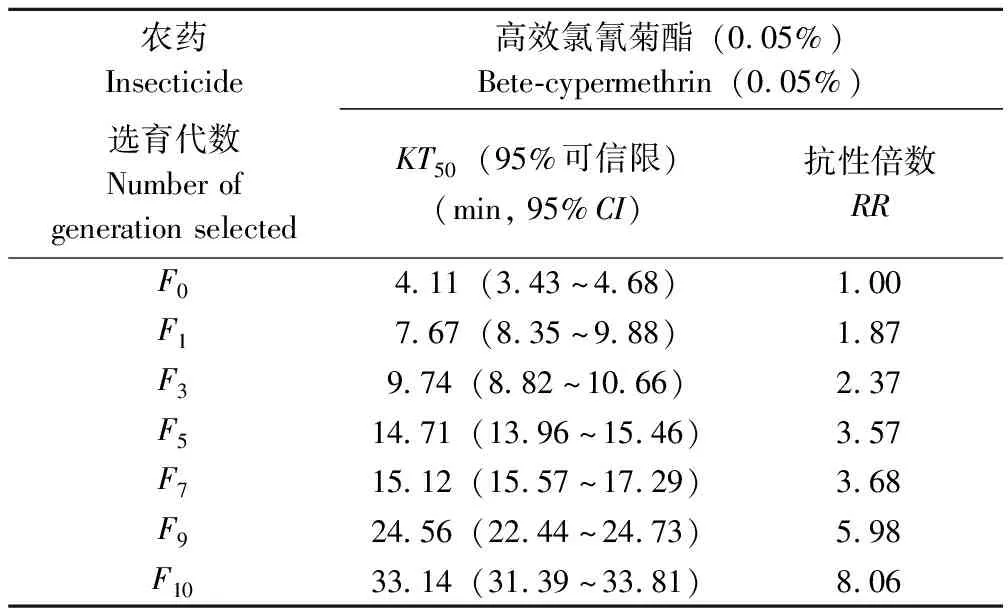
表1 高效氯氰菊酯对德国小蠊的抗药性选育
2.2 德国小蠊敏感品系和抗性品系CarE、细胞色素P450和GSTs比活力比较
以α-NA为底物对德国小蠊敏感和抗性品系羧酸酯酶活性进行测定,测定结果显示,抗性品系的羧酸酯酶比活力高于敏感品系,为敏感品系的2.02倍。抗性品系与敏感品系比活力差异显著(P<0.05)(表2)。德国小蠊成虫体内细胞色素P450的活性不是很高,但是抗性品系细胞色素P450比活力与敏感品系相比有所升高,为敏感品系的1.88倍,抗性品系与敏感品系细胞色素P450比活力差异显著(P<0.05)(表2)。德国小蠊抗性品系GSTs 活性高于敏感品系,为敏感品系的2.70倍,抗性品系GSTs 比活力与敏感品系差异显著(P<0.05)(表2)。
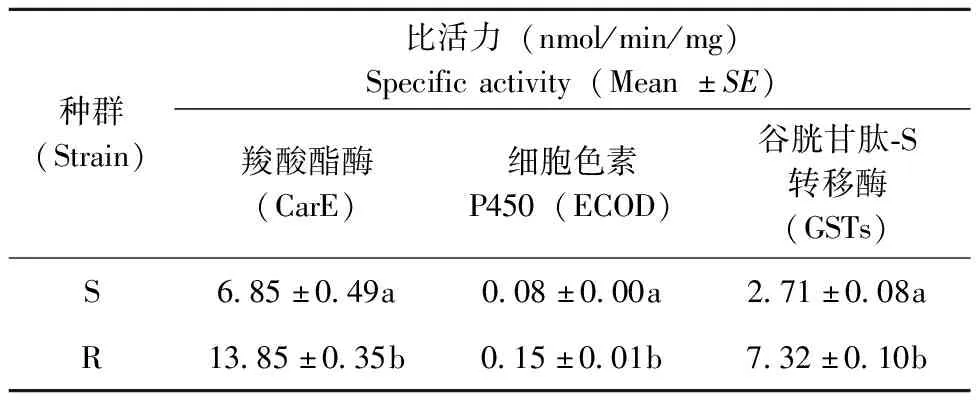
表2 德国小蠊敏感品系和抗性品系CarE、细胞色素P450和GSTs比活力比较
2.3 德国小蠊击倒抗性基因PCR扩增产物测序结果
将-70 ℃冻存保存的25只德国小蠊个体单只提取基因组DNA后进行击倒抗性基因型检测,同时以25个敏感品系个体作为对照。测定结果显示,共检测出3种基因型,即SS(敏感纯合)、抗性杂合(RS)和抗性纯合(RR)(图1)。敏感品系不携带有抗性基因,抗性品系100%携带抗性基因,其中抗性杂合子占到了56%,抗性纯合子占到了44%(表3)。

表3 德国小蠊抗性等位基因检测结果

图1 德国小蠊kdr抗性的基因型种类
3 讨论
本文在室内连续筛选10代后,德国小蠊对高效氯氰菊酯的抗性倍数增至8.06倍,说明在杀虫剂的选择压力下,室内筛选和野外品系一样抗性发展迅速。从筛选10代的结果来看,德国小蠊抗药性的增加没有明显的规律性,后续还应继续筛选以发现抗性增加的规律以及获得更高抗性的品系。
生理、生化过程的改变是导致害虫对杀虫剂产生抗药性的主要机制之一,其变化的程度决定着害虫的抗性水平。昆虫体内解毒酶的量变和质变是昆虫对化学药剂产生抗性的重要原因之一(韩晓莉等,2017)。本文研究结果显示,德国小蠊抗性品系CarE活性显著高于敏感品系,说明CarE活性水平的提高可能是德国小蠊产生抗性的原因之一。
德国小蠊抗性品系的P450酶系中ECOD比活力高于敏感品系,这表明德国小蠊对高效氯氰菊酯产生的抗性可能与P450介导的解毒代谢作用具有一定的关系。上述结果与对抗拟除虫菊酯蝇(Leeetal.,1989)、铜绿蝇(Kotze, 1993)以及小菜蛾(李卫民等,1997)的研究结果相似。但是本实验中只测定了P450酶系中ECOD一种组分的活性,其他组分也可能参与了P450酶的代谢抗性。不同的杀虫剂可能使细胞色素P450酶系的不同组分或者不同的P450同工酶的表达上升,而对另一些组分没有影响或使其受到抑制。P450酶系各组分对不同类型杀虫剂的抗性分子机理可能也不一样,它们之间可能共同作用导致抗性的产生。
从德国小蠊本身GSTs的生物学特性研究抗药性的产生机制及其影响因素,对加强抗性监测及寻找克服或延缓抗性发展的有效方法具有重要意义。许多研究证据已表明,昆虫对杀虫剂的抗性与GSTs对CDNB(或DCNB)的高活性有关。如草地粘虫的几个田间品系对拟除虫菊酯、有机磷和氨基甲酸酯类杀虫剂的抗性与GSTs对CDNB和DCNB的活性增加有关(Yu, 1992)。表2的结果显示北京地区德国小蠊野外种群GSTs的比活力普遍高于敏感品系,表明GSTs对底物的催化能力提高,从而加快对有毒物质的排泄,降低其毒性进而参与抗性形成。抗性品系体内GSTs的活性要显著高于敏感品系,其分子机制可能是由于GSTs基因扩增或者表达量上调,或GSTs序列的活性位点突变等原因。
目前,生物测定法对于害虫防治效果的预测和评估仍然是十分必要的。本文用PBO预处理试虫,抑制德国小蠊部分解毒酶的活性(Youngetal., 2005),从而得到击倒抗性更强的试虫,再通过分子生物学检测法检测出其携带的抗性基因类型,这对于能鉴别出一个表现型为敏感却携带有大量抗性基因的杂合子的种群尤其重要。因为抗性基因频率与拟除虫菊酯的媒介生物控制效果密切相关,又因为kdr抗性突变具有多样性,所以对一些抗性机制复杂的种群,在使用由单点突变设计的分子诊断方法时,可能抗性水平相同,kdr基因频率却不完全相同(Soderlund, 2003)。本文以德国小蠊为研究对象,研究了钠离子通道基因选择对抗性表型的影响。结果发现,抗性品系个体中均存在kdr点突变,因此,德国小蠊抗性的产生可能与kdr基因的定向选择相关。

