微染色体维持蛋白6高表达与肝细胞癌预后关系的研究
邵 珲,胡 志,宋 强,闫丹丹,杨龙宝
(1.西安交通大学第一附属医院结构性心脏病科,陕西 西安 710061;2.西安交通大学第二附属医院消化内科,陕西 西安 710004)
肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌的主要类型,是全球范围内最为常见的一种恶性肿瘤。随着近年来分子生物学等新技术的发展,识别特定的分子生物标记物对肝癌的诊治、预后有着重要的临床意义[1]。目前多数研究重点放在针对肝癌的分子发病机制基础上,试图寻找新的肿瘤标记物和潜在靶向治疗点[2]。微染色体维持蛋白(minichromosome maintenance protein,MCM)家族是一个新近报道的基因家族,在真核生物基因组复制过程中发挥重要作用。其家族成员包括MCM2~7,其中MCM6是由Holthoff等在突变酵母中发现并分离提取出来的。诸多研究报道,MCM蛋白在癌症进展及预后方面发挥重要作用,其在多种恶性肿瘤中异常表达[3~6]。有研究发现,HCC患者血浆MCM6 mRNA和蛋白水平与血管浸润、TNM分期、淋巴结转移相关,MCM6被认为是特异性细胞增殖相关因子,血清MCM6可作为肝癌的一种独立生物标记物[7]。本研究评估了MCM6在HCC中的表达及与HCC临床特征的关系,探讨了MCM6在HCC患者中的潜在预后意义。
1 资料与方法
1.1 一般资料2008年1~12月癌症基因组图谱(TCGA)数据库中376例HCC患者的临床资料,其中MCM6表达374例,癌旁组织50例。
1.2 方法收集HCC患者的基因表达谱和临床资料,如年龄、性别、组织学分级、病理分期及总生存率等。
1.3 统计学方法所有统计分析均采用R软件[8]进行。采用Wilcoxon符号秩和、Kruskal-Wallis检验及Logistic回归分析MCM6表达水平与临床参数的关系。采用Kaplan-Meier法分析MCM6表达水平与患者总生存率(OS)之间的相关性。多变量Cox分析用于验证MCM6表达与生存率以及其他临床特征之间的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 患者的临床参数376例HCC患者的临床资料,包括年龄、性别、病理分期、组织学分级、总生存率及预后等。见表1。
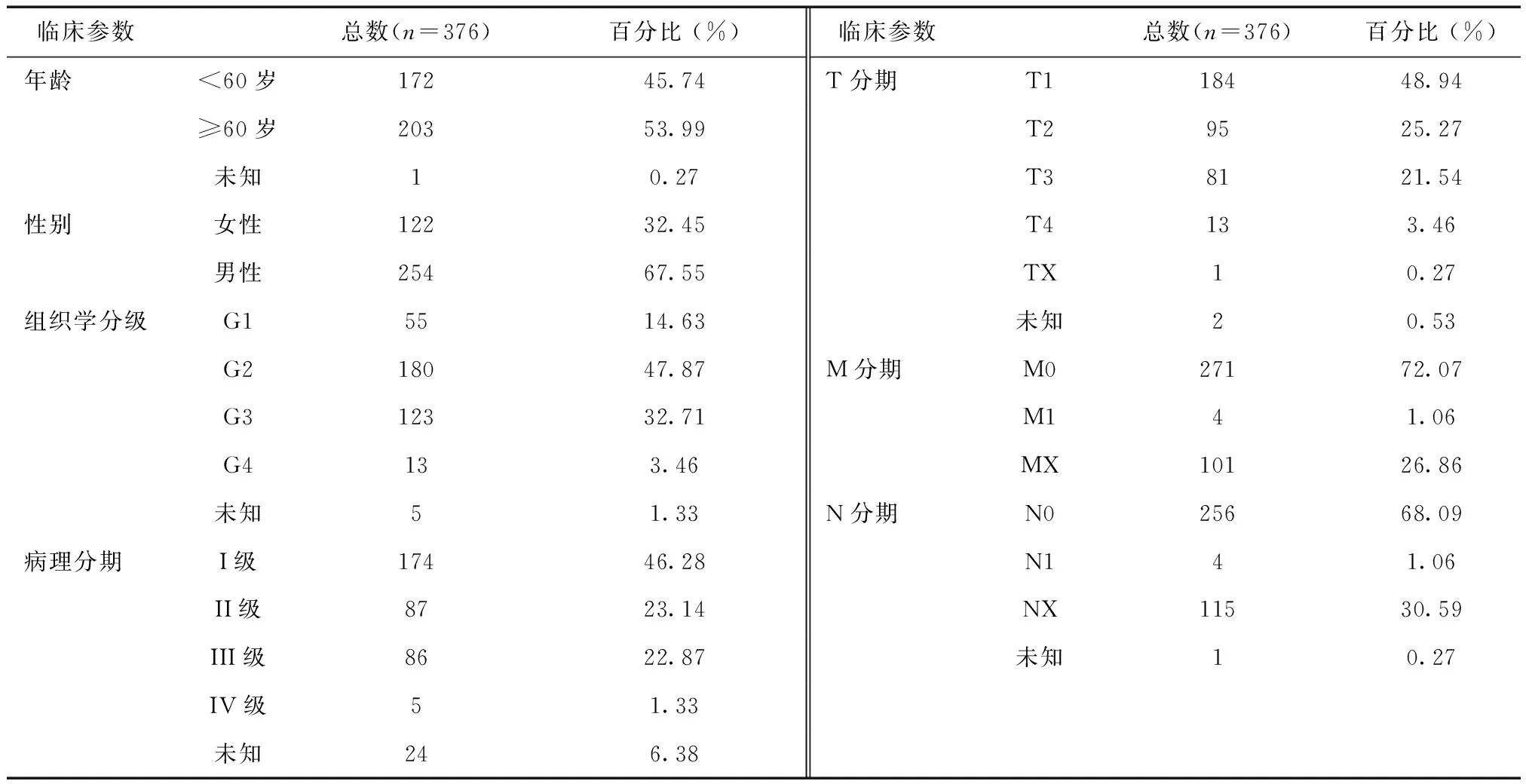
表1 HCC患者的临床参数
2.2 MCM6在HCC中的表达HCC中MCM6的表达水平明显高于癌旁组织(P<0.05)。MCM6在50例HCC中的表达水平亦显著高于配对的癌旁组织(P<0.05),见图1。

图1 HCC中的MCM6明显高于癌旁组织 a.癌组织与癌旁组织;b.癌组织与配对的癌旁组织
2.3 HCC患者中MCM6表达的影响因素Logistic回归分析显示,MCM6在<60岁HCC中的高表达风险明显高于≥60岁HCC患者(P<0.05),且随着组织学分级(G3 vs G1,G4 vs G1)、病理分期(III+IV级 vs I+II级)、T分期(T2 vs T1,T3 vs T1)的分级逐渐增高,MCM6在HCC中的高表达风险亦愈高(P均<0.05),见表2。
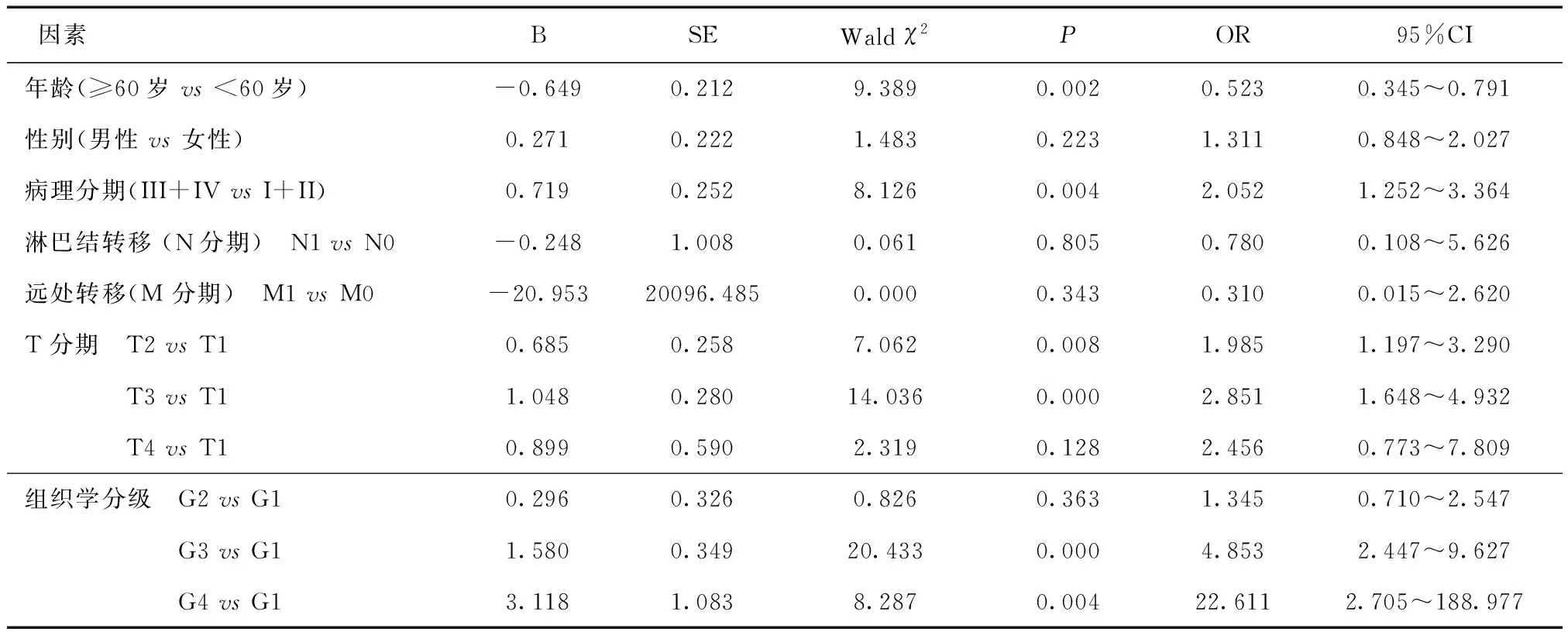
表2 HCC患者中MCM6表达的影响因素分析
2.4 MCM6表达对HCC患者预后的影响根据HCC患者中MCM6表达值的中位数将患者分为高表达组和低表达组。缺乏完整临床资料的患者数据不被纳入分析。Kaplan-Meier生存分析表明,与MCM6低表达组相比,MCM6高表达组的HCC患者生存期限明显较差(P<0.05),见图2。多因素cox回归分析表明,仅有MCM6表达与OS明显独立相关(P<0.05),见表3。
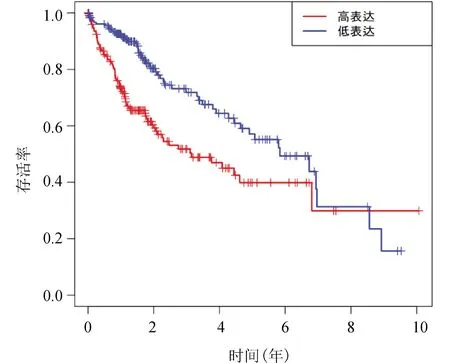
图2 MCM6不同表达水平的HCC患者的生存曲线

表3 HCC患者中MCM6表达与患者总生存率关系的多因素cox回归分析
3 讨论
HCC是全球范围内普遍存在的一种恶性肿瘤,因其临床症状出现较晚,症状出现时多数已处于中晚期,因而易错过最佳手术时机,预后较差。目前其治疗手段仍然较局限,治疗效果不甚理想,复发率和死亡率较高,因此对于肝癌的早发现、早诊断、早治疗就显得尤为重要,而肝癌的治疗对我们来说仍是一个巨大的挑战[2]。肝癌的发生发展过程十分复杂,目前尚没有完全统一明确的发病机制[9]。由于目前分子生物技术、基因组学工程等发展迅速,人们对肝癌的研究也逐渐深入,众多学者开始致力于筛选理想的肝癌标记物,试图从分子标记物着手,希冀发现较为特异的肝癌标记物,从而为肝癌的诊治提供有利帮助。目前在肝癌的研究领域里,尚未发现任何一种肝癌分子标记物能够较为特异的诊断肝癌。当前用于筛查HCC的常用方法是血清α-甲胎蛋白(AFP)检测和肝脏成像,例如超声和计算机断层扫描,但由于AFP在某些组织学类型肝癌和部分小肝癌患者中可能表现出阴性结果,因此迫切需要开发新的生物标记物以对部分类型肝癌进行早期诊断和作为AFP阴性肝癌的补充筛查手段。有研究发现,临床最常见的肝癌肿瘤标志物 AFP蛋白和MCM6蛋白在区分总HCC组和非HCC组方面的敏感性分别为78.7%、67.2%,而在特异性方面分别为57.6%、89.8%。在全部HCC患者中,MCM6 mRNA和蛋白与AFP蛋白水平无显著相关性(P>0.05)[7]。因此,为了能够在肝癌的早发现、早诊断及靶向治疗方面有所突破,寻求特异性和敏感性更高的肝癌分子生物标记物迫在眉睫。
MCM6是MCM基因家族成员之一,而MCMs在DNA复制中起着至关重要的作用[10]。有研究报道MCMs只在增殖细胞和具有增殖潜能的细胞和中表达,在肿瘤细胞中的表达明显高于正常细胞[11,12]。MCMs是细胞增殖的候选标记物,MCMs水平升高提示恶性细胞增殖。越来越多的证据表明MCMs可以预测肿瘤进展和预后。研究发现MCM6在乳腺癌中高表达,并可作为其临床诊断及预后的一个很有意义的生物学指标[13]。在霍奇金淋巴瘤病人的活检淋巴结中,MCM6高表达是淋巴瘤细胞的一个显著特点[13]。同时,MCM4、MCM5、MCM6、MCM10和RECQL4 mRNA的过度表达被认为是宫颈癌预后不良的指标[5]。MCM2被证明是食管癌和膀胱癌的生物标记物[14,15]。总之,近年来越来越多研究发现,MCM6在多种恶性肿瘤中表达上调,如胃癌、子宫内膜癌、脑胶质瘤等,MCM6表达增加与肿瘤患者的低生存率明显相关[7,9,10]。MCMs除了作为细胞增殖标记外,MCM蛋白的诊断潜力也一直是人们关注的焦点。有研究[16]通过免疫染色结果和临床实践证实MCM阳性细胞大多分布在恶性和癌前上皮细胞的表面,这意味着临床细胞学标本容易获取和复制。因此,MCMs在癌症筛查和诊断中具有广阔的应用前景。有研究证实,与非肿瘤标本相比,MCM2、MCM6和MCM7蛋白在HCC中的表达水平显著增高[4]。另有学者发现,MCM2-7蛋白可作为HCC的敏感诊断标志物,其中生存分析和联合效应分析表明,MCM2联合MCM6可共同作为HCC的预后指标[17]。通过PCR和平行免疫染色进一步证实,MCM6在HCC中的诊断和预后优于MCM2和其他MCM[4,7]。MCMs水平的升高既有助于肿瘤的早期诊断,又能够预测肿瘤的复发[4]。以上这些研究足够说明MCM6在癌症的发生、发展及预测预后中发挥关键作用。
在本文中,我们试图确定MCM6表达在HCC进展中的作用,特别是作为HCC预后因素的作用。既往研究发现[18,19],肝癌高发年龄段多集中在50~60岁,本研究将60岁设为年龄节点,结果发现MCM6在HCC组织中的表达明显高于癌旁组织,其高表达与发病年龄、组织学分级、病理分期、T分期有关,即MCM6在<60岁患者中的表达明显高于≥60岁患者(P<0.05),随着组织学分级(G3vsG1,G4vsG1)、病理分期(III+IV级vsI+II级)、T分期(T2vsT1,T3vsT1)的分级逐渐加重,MCM6表达亦随之增加(均P<0.05)。这些结果表明,随着MCM6表达的增加,HCC患者病情有可能进展到更晚期,肿瘤浸润范围可能更广,恶性程度更高。其次,Kaplan-Meier生存分析显示,与MCM6低表达组相比,MCM6高表达组的OS较差,进一步的多因素分析表明MCM6的表达是HCC的一个独立预后因素,与既往研究结果[4]一致,即MCM6独立预测了HCC患者的较差生存率,以及血清MCM6水平被报道为HCC的独立生物标志物,特别是在AFP阴性和小肝癌患者中。
如上所述,MCM6是一种HCC较优的诊断和预后指标,可作为肝癌患者一种新型生物标志物,同时是常见肿瘤标志物AFP筛查HCC的补充手段,为以后肝癌患者的临床诊治工作提供了新的选择和诊疗思路。当然,我们的研究也有一些局限性。首先,我们在本研究中分析的数据是从公共数据库中提取出来的,这些数据库没有经过验证。其次,MCM6调控HCC发生发展以及预后的机制有待进一步研究,推测其可能通过改变细胞增殖而引起肝癌的发生发展,当然同时需要更大规模的临床试验来证实MCM6在HCC患者中的诊断和预后价值。
综上,本研究显示MCM6在HCC中高表达,参与了HCC的发生发展,是预测HCC患者OS很有价值的预后因素,可作为HCC的潜在诊断和预后标志物。但需要更多的研究来验证本研究的发现。

