FMR1基因突变与自然流产及复发性流产的相关性研究
黄凌云,沈 晔,钱芳波
(南京医科大学附属无锡市妇幼保健院计划生育科,江苏 无锡 214002)
自然流产是指在孕28周前,排除人为因素导致的妊娠终止;复发性流产则是指同一位女性在短期内连续发生至少2次自然流产[1]。流产发生在12周之前称之为早期流产,若流产发生在12周之后则称为晚期流产[2]。在全部的自然流产中,有80%发生在早期,多与解剖、遗传、感染、内分泌、自身免疫性疾病等诸多因素有关,其中遗传因素中染色体异常最为常见[3]。脆性智力低下1号基因(Fragile X retardation-1,FMR1)5端非编码区有一段以CGG为单位的三核苷酸动态重复序列,该序列长度(CGG的重复次数)在传代过程中表现出动态变化[4]。卵巢早衰、脆性-X综合征、脆性X相关震颤-共济失调综合征是与之相关的各类疾病,这些疾病的特征与该序列扩张的程度相关[5]。自然流产、复发性流产夫妇其FRM1基因CGG重复数量是否高出普通人群,目前尚未见较多相关报道证实。本研究拟检测早期自然流产及复发性流产患者FRM1基因CGG重复序列数来了解FRM1基因与自然流产及复发性流产之间的相关性,旨在为未来自然流产与复发性流产的病因学研究提供依据。现报道如下。
1 资料与方法
1.1 一般资料选择2018年6月至2019年5月在我院计划生育科就诊的早期流产与复发性流产患者144例作为试验组,同期在我院接受常规产检的70例既往无自然流产或复发性流产史的女性70例作为对照组,均在我院接受正常孕检并顺利分娩。纳入标准:①试验组均为有不良孕产史者,包括早期自然流产史、≥2次流产史、≥2次稽留流产史;②对照组经查无任何内科合并症及自身免疫性疾病,既往无不良孕产史,既往无流产史;③全部入组女性对本次研究实施的方法、目的等内容均知情,并签署知情同意书。排除标准:①合并内外科合并症者;②既往接受腹腔手术治疗史者;③心理疾病或精神障碍等无法很好的配合研究者。试验组年龄18~40岁[(30.70±4.71)岁];孕次1~7次[(3.24±1.15)次];产次0~2次[(0.89±0.24)次];对照组年龄20~40岁[(31.02±4.81)岁];孕次1~5次[(3.14±1.21)次];产次0~2次[(0.87±0.25)次]。两组年龄、孕次、产次等一般资料比较差异无统计学意义(P>0.05),有可比性。该研究获得我院医学伦理委员会批准。
1.2 方法全部患者均接受FMR1基因检测。①DNA提取:全部受试者均接受外周静脉采血2 ml,提取DNA,提取试剂盒为德国 Qiagen公司提供的全血DNA试剂盒,严格参照试剂盒说明书进行操作,取溶解后DNA溶液1 μl,以相同蒸馏水作为空白对照组,在紫外分光光度仪上检测DNA纯度合格,稀释DNA浓度至20 ng/ μl备用。②检测FMR1基因CGG重复序列数:冻寸24 h内统一快递空运至北京大学第一医院中心实验室,每批次反应均设有全突变、空白对照各1例,提取基因组DNA后使用美国Asuragen公司提供的FMR1基因Amplide试剂盒经X检测技术与荧光PCR技术,使用美国ABI公司提供的3730DNA分析仪毛细管电泳仪实施毛细管电泳,使用美国ABI公司提供的GeneMapper4.0软件进行扩增产物分析,检测FMR1基因CGG重复序列数。PCR反应体系包括11.45 μl、GC-Rich Amp buffer、1.5 μl 6′-FAM-FMRI引物、0.5 μl FRM1CGG引物、0.5 μl无核酸酶的水、0.05 μl高GC的多聚酶混合物、30 ng的DNA模板。
1.3 观察指标记录所有患者的各项资料,结合FRM1基因突变检查结果,对有关数据及研究对象临床资料进行对比分析。使用国内目前普遍采用的分类[6]:①正常重复范围:n=5~44次;②中间型或灰区:n=45~54次;③前突变:n=55~200次、④全突变:n=200次。
1.4 统计学方法应用SPSS 20.0统计学软件处理数据,计量资料以均数±标准差表示,比较采用t检验,计数资料以百分比表示,采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 试验组与对照组FMR1基因CGG重复序列分布规律比较试验组144例患者中自然流产者84例,复发性流产者60例。自然流产组与复发性流产组患者CGG重复最大频率等位基因n=30,其次为n=29,再次为n=36、n=31,对照组最大频率等位基因n=30,后频率由高至低依次为n=29、36、31,三者高度一致。自然流产组与复发性流产组检测到不同等位基因共35种,CGG重复次数变异范围为n=21~133,最大频率基因为n=30,后依次为n=29、31。对照组检测到不同等位基因25种,CGG重复次数范围22~58,最大频次等位基因为n=30、36、31。三组CGG重复均数分别为(29.34±5.21)次、(30.34±5.32)次、(28.78±6.41)次,组间比较差异无统计学意义(F=1.479,P=0.854)。3组FRM1基因CGG重复序列分布情况见表1。
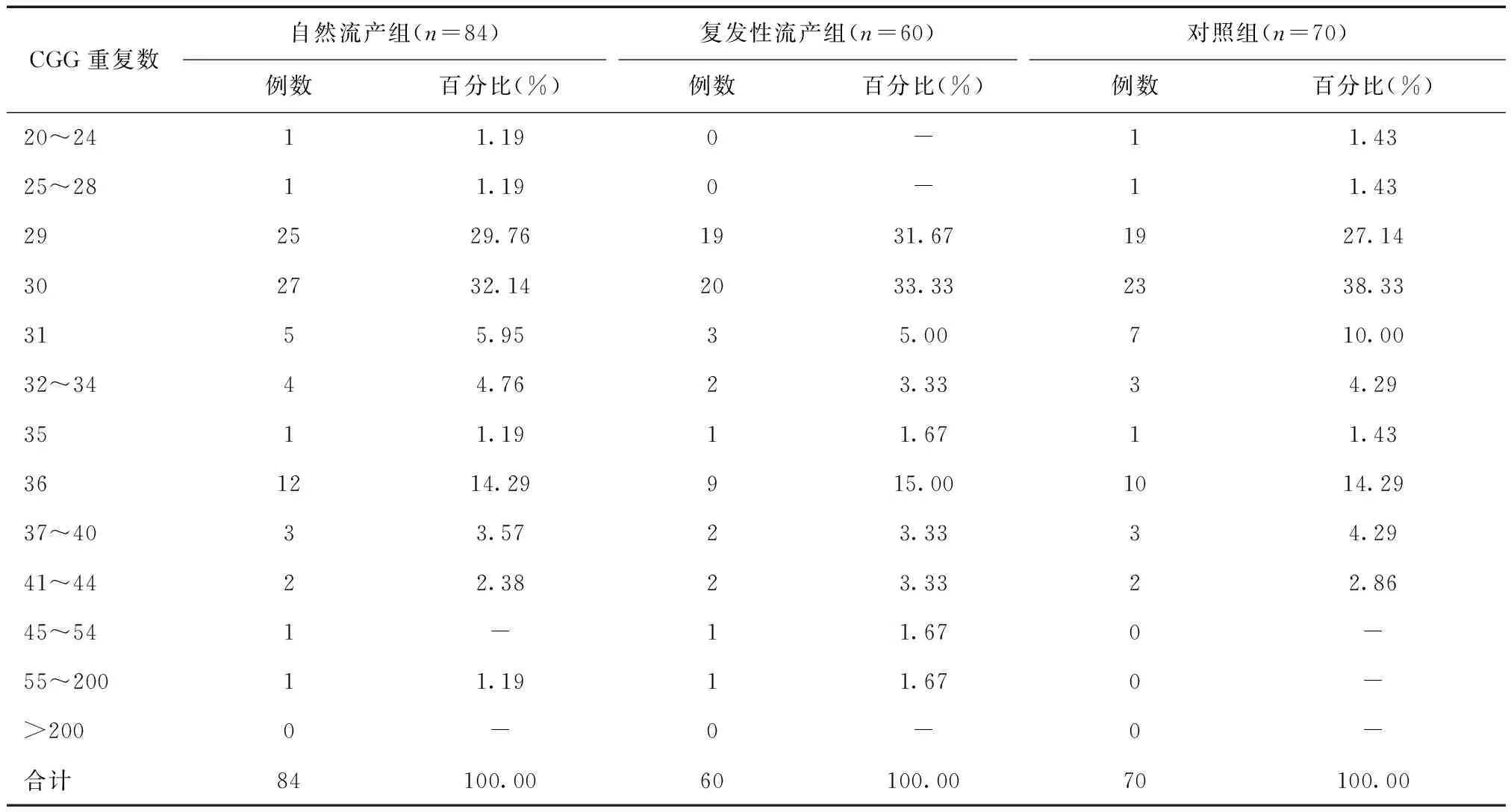
表1 3组FRM1基因CGG重复序列分布情况比较
2.2 中间型分布情况本研究将中间型(灰色区域)的CGG重复次数扩增范围定义在45~54,结果发现,自然流产组中间型FMR1基因检出1例,中间型FMR1基因携带率为1∶84;复发性流产组中间型FMR1基因检出1例,中间型FMR1基因携带率为1∶60;对照组未检出中间型FMR1基因。3组间比较,差异无统计学意义(χ2=1.282,P=0.744)。
2.3 基因突变情况比较试验组患者FMR1基因前突变携带者2例,携带频率为1∶72,对照组中未检出FMR1基因前突变者,组间比较差异无统计学意义(χ2=0.055,P=0.452)。不论是试验组患者或是对照组女性均未检出FMR1基因全突变。
3 讨论
近来早期胚胎停育现象愈发多见,中华医学会妇产科分会《复发性流产诊治的专家共识》明确提出妊娠12周前发生的早期复发性流产多因遗传因素导致,但该指南中仅仅提到夫妻双方全核型分析与胚胎绒毛染色体[7]。FMR1基因位于X染色体末端Xq23.7,编码脆性-X智力障碍基因,会引起女性卵巢储备功能下降,诱发卵巢早衰[9]。卵巢储备功能直接与女性生育能力及妊娠结局相关,CGG重复序列为55~200已被研究证实与卵巢早衰息息相关[10]。给予上述论证,本研究主要分析CGG重复扩增是否与自然流产及复发性流产相关。
目前,CGG重复数量变化划分标准被国际公认的有两个,分别由欧洲人类遗传学会与美国医学与遗传学会制定[8],后者在临床上的应用较常见。根据CGG扩增频率高低,会诱发不同的临床症状,诸如脆性X相关原发性卵巢功能不全、脆性X综合征及脆性X相关共济失调等[9]。CGG重复数在5~44次的FMR1基因为被定义为正常型或未受累型,携带这类正常基因者其不会表现出显著的临床病症,这类人群的CGG重复数以29、30次最常见,位于这个区段的CGG重复序列不会存在子代扩增的风险;CGG重复数在45~54次的FMR1基因被定义为中间型或灰区FMR1基因,携带这类基因者无显著临床病症,也无证据证明这个区段内CGG重复序列可能会增加子代脆性X综合征的风险;CGG重复序列次数在55~200之间的FMR1基因被定义为FMR1前突变型基因,其扩增程度在母系遗传中极其明显,可能会导致后代的CGG重复数由前突变扩增至完全突变,对于这类携带FMR1前突变型基因的携带者而言,其每次怀孕均应该接受产前诊断[10~12]。目前尚无报道发现父系遗传扩增至完全突变的案例,故父亲存在FMR1基因前突变者在生育后代时可不进行产前诊断。经上述论证可以认为FMR1基因突变可能与自然流产及复发性流产相关,这可能与以下机制有关:①FMR1基因前突变型、完全突变型的CGG序列超甲基化,故有发生脆性X综合征的风险;②女性FMR1基因前突变型携带者有超过20%的几率会出现卵巢早衰及早期闭经的情况,故对生育能力产生明显影响;③CGG重复数在200次以上的全突变型FMR1基因,其在临床上会导致X脆性综合征[13,14]。
本研究结果显示,无论是自然流产组、复发性流产组还是对照组女性的CGG重复次数频率最高的均为30、29,其次为36、31,这与国内张有成等[15]报道结果高度一致。此外,结果显示,3组FMRI基因中间型携带率比较未见明显差异,试验组FMR1基因前突变携带率高于对照组,但经统计学分析后未见差异,结果可以看出,FMR1基因突变可能会增加自然流产及复发性流产风险,而在本研究中未见差异可能与本次研究纳入样本量较少有关,结果的真实性与可靠性还应在未来展开大样本的研究加以证实。FMMR1等位基因大小在45~200,是减数分裂不稳定的,可以遗传为减数分裂的后代,FMR1基因也经历了异常甲基化,这些不稳定的突变可能会导致与生命不相容的缺陷,并引起流产,且前突变型FMR1基因对卵巢功能的损害现已被医学界广泛接受,可以猜测该基因可能通过对卵巢的影响来增加女性流产风险[16]。但上述机制均未被循证医学所证明,也尚无相关的报道能够给予其理论支持,这就需要检测复发性流产患者流产物内DNA表达来证明,寻找其扩增等位基因或改变的FMR1基因。
综上所述,FRM1基因突变可能与自然流产及复发性流产相关,检测自然流产及复发性流产患者的FRM基因突变情况,对给予下次妊娠优生指导有着积极意义。

