响应面法优化超声波协同酶法提取杜仲叶多糖工艺
陈雪花,杨万根(吉首大学林产化工工程湖南省重点实验室,湖南张家界 427000)
杜仲(EucommiaulmoidesOliver)是一种名贵的中药材,在我国已有2000多年的药用历史[1],中国古代医学典籍中就曾记载杜仲具有补肾、补肝虚、强筋骨、降血压等功效[2]。杜仲全身都是宝,杜仲的茎、皮在临床上可用于治疗高血压、阳痿、腰痛以及坐骨神经痛,而杜仲叶可用于治疗糖尿病或被制成增强体质、预防疾病的功能性饮料或保健食品[3-4]。长期以来人们都是以杜仲皮入药,但因杜仲树生长缓慢,往往需要经过多年的生长才能取皮入药,故在市场上杜仲皮供不应求[5]。研究证实,杜仲叶和杜仲皮的化学成分基本一致,富含绿原酸、黄酮类化合物、桃叶珊瑚甙、环烯醚萜及多糖等活性成分,功效基本相同,可以以叶代皮入药[6-7]。2018年4月,国家卫生健康委员会公布 “关于征求将党参等9种物质作为按照传统既是食品又是中药材物质管理意见的函(国卫办食品函〔2018〕278号)”,杜仲叶作为9种物质之一被列入其中。“药食同源”给了杜仲叶一个新身份,在此背景下杜仲叶相关保健产品的市场需求将持续增大。
多糖有广泛的药理活性,在抗氧化[8]、抗肿瘤[9]、免疫调节[10]等方面有独特的功效,并且基本对机体无毒害作用,而受到研究者越来越多的关注。热水萃取是传统的多糖提取方法,但其存在能耗高、效率低、环境污染严重等问题[11],因此相关学者一直在研究多糖的高效提取方法,出现了诸如超声波辅助提取[12]、微波辅助提取[13]、酶法辅助提取[14]、超高压辅助提取[15]、亚临界提取[16]等新方法。关于杜仲多糖的提取已有较多的文献报道,如孙曦晓等[17]以杜仲树皮为原料,采用超声辅助法提取杜仲多糖,多糖得率为1.94%。刘晓河等[18]研究了果胶酶、中性蛋白酶和纤维素酶对杜仲多糖提取率的影响,发现三种酶均能提高多糖提取率,其中以果胶酶提高多糖提取率效果最为显著。但是这些报道均集中于杜仲多糖单一辅助提取技术研究,多糖得率不高。
目前国内外还未见将超声波和酶法辅助同时应用于杜仲叶多糖提取的文献报道,因此本文采用Plackett-Burman设计和响应面法对超声波-协同酶法提取杜仲叶多糖的工艺进行研究。先通过单因素实验考察复合酶添加量、pH等因素对多糖得率的影响,再通过Plackett-Burman实验确定影响显著因素,并对这些影响显著因素进行最陡爬坡实验以逼近各因素的最大响应区域,最后采用Box-Behnken实验优化提取工艺。本研究将为杜仲叶多糖的高效提取技术提供参考,对以杜仲叶多糖为主要原料的保健食品、药品的开发和杜仲产业的经济效益的提高都具有重要的意义。
1 材料与方法
1.1 材料与仪器
杜仲叶(2019年10月采摘于吉首大学林产化工湖南省重点实验室杜仲基地),洗净后于60 ℃鼓风干燥箱中烘干,然后粉碎成粉末,过60目筛备用;木瓜蛋白酶(1×106U/g)、纤维素酶(5×105U/g)、果胶酶(5×105U/g) 浙江东进生物科技有限公司;葡萄糖、乙酸、乙酸钠、苯酚、浓硫酸、石油醚(60~90 ℃沸程)、无水乙醇、正丁醇、三氯甲烷、活性炭 国药集团化学试剂有限公司;所有有机溶剂 均为国产分析纯。
TF-650CT型多用途恒温超声波提取机 上海拓纷机械设备有限公司;RE-501A型真空旋转蒸发器 郑州特尔仪器设备有限公司;GZX-9246MBE型数显鼓风干燥箱 上海博讯实业有限公司医疗设备厂;PHSJ-4A型实验室pH计 上海雷磁精科有限公司;TG165型台式高速离心机 长沙平凡仪器仪表有限公司;JA2003型电子天平 上海舜宇恒平科学仪器有限公司。
1.2 实验方法
1.2.1 杜仲叶粉的预处理 取杜仲叶粉于60 ℃鼓风干燥箱中干燥至恒重,用5倍体积的石油醚(W/V)于80 ℃恒温水浴浸提2 h除去杜仲胶和脂类,重复3次,过滤、晾干。滤渣再用5倍体积的80%乙醇(w/V)于80 ℃恒温水浴浸提取2 h除去小分子单糖、双糖、寡糖等物质,重复3次,过滤、晾干,置于干燥器中备用。
1.2.2 杜仲叶多糖提取 精确称取2.0 g预处理后的杜仲叶干粉,以蒸馏水为提取溶剂,按照工艺研究中的不同参数设定超声波协同酶法提取条件进行多糖的提取。提取结束后,4000 r/min离心10 min,上清液即为多糖提取液。多糖提取液于-0.09 MPa、60 ℃条件下真空减压浓缩至原体积的十分之一,室温条件下往浓缩液中加入95%乙醇至溶液乙醇浓度达80%,4 ℃静置12 h后,4000 r/min离心10 min,弃去上清液,将得到的沉淀用无水乙醇洗2次,晾干后即得到杜仲叶粗多糖。用蒸馏水将多糖充分溶解并定容至1000 mL,测多糖含量,计算多糖得率。
1.2.3 杜仲叶多糖含量的测定及多糖得率计算 用苯酚-硫酸法[19]测多糖含量。葡萄糖标准曲线绘制:取葡萄糖于105 ℃干燥至恒重,精确称取20 mg,加蒸馏水溶解,定容至500 mL。分别吸取0.0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mL的葡萄糖标准液,置于10 mL试管中,各加蒸馏水补足至2 mL,加入6%苯酚1 mL摇匀,迅速滴加浓硫酸5 mL,摇匀,室温放置5 min,置沸水浴中加热20 min,迅速冷却至室温,于490 nm处测吸光度A。以蒸馏水为空白,标准葡萄糖质量浓度C(mg/mL)为横坐标,吸光度A为纵坐标,绘制标准曲线,得出回归方程:A=0.0108C-0.0114,R2=0.9991。精密吸取1.0 mL定容后的杜仲叶多糖液样品,加蒸馏水补足至2 mL,测吸光度A。以蒸馏水为空白,重复测定三次,取平均值。按下式计算杜仲叶多糖得率(Y):
式中:C为待测样品液中的多糖质量浓度(mg/mL);V为待测样品液的体积(mL);n为样品液的稀释倍数;m为杜仲叶粉的质量(g)。
1.2.4 单因素实验 精确称取2.0 g预处理后的杜仲叶粉,预设4%复合酶(木瓜蛋白酶∶纤维素酶∶果胶酶=1∶1∶1[20])添加量,pH4.0,提取温度50 ℃,超声波功率100 W,液料比 20∶1 mL/g,提取时间20 min为单因素实验中的常规量。以复合酶添加量(3.0%、3.5%、4.0%、4.5%、5.0%、5.5%)、pH(3.0、3.5、4.0、4.5、5.0、5.5)、提取温度(35、40、45、50、55、60 ℃)、超声波功率(40、60、80、100、120、140 W)、液料比(5∶1、10∶1、15∶1、20∶1、25∶1、30∶1 mL/g)、提取时间(5、10、15、20、25、30 min)6个因素变量替换实验中的常规量。按1.2.2与1.2.3中的方法提取、测定并计算多糖得率,每组重复三次。
1.2.5 Plackett-Burman实验 以单因素实验为基础,利用Plackett-Burman实验筛选出显著影响杜仲叶多糖得率的关键因素。每个因素取高(+1)和低(-1)两个水平,共12组实验。实验因素与水平取值见表1。

表1 Plackett-Burman实验的因素与水平Table 1 Factors and levels of Plackett-Burman experiment
1.2.6 最陡爬坡实验 根据Plackett-Burman实验得到的一次拟合方程,设计各关键因素的爬坡方向和步长。通过最陡爬坡实验使关键因素的取值逼近最大响应区域,确定响应面实验的0水平,以便建立有效的响应面拟合方程[21]。
1.2.7 响应面优化实验 根据Plackett-Burman实验和最陡爬坡实验结果,对筛选出的复合酶添加量、pH和超声波功率3个关键因素进行三因素三水平的Box-Behnken实验(见表2)。对Box-Behnken实验结果建立数学回归模型并分析。

表2 Box-Behnken实验因素与编码水平Table 2 Factors and levels of Box-Behnken experiment
1.3 数据统计
所有实验都进行3次重复操作,运用minitab 17软件设计Plackett-Burman实验,Design-Expert.8.0.6软件设计Box-Behnken实验,SPSS 23和Origin 9.0软件进行ANOVA分析和图形绘制。
2 结果与分析
2.1 单因素实验结果
2.1.1 复合酶添加量对杜仲叶多糖得率的影响 复合酶添加量对杜仲叶多糖得率的影响见图1。当复合酶的添加量从3.0%增加到4.0%时,杜仲叶多糖得率快速提高,在4.0%达到最大值4.09%±0.02%,但当添加量大于4.0%时,得率呈缓慢下降趋势。这可能是因为随着酶的量增加,酶与底物的接触机会增大,加速了细胞壁的溶解,有利于多糖的溶出[22]。但是,过高的酶添加量会造成蛋白酶自溶和其他两种酶的水解,从而使底物的水解速度下降。因此,确定4.0%作为复合酶的最佳添加量。
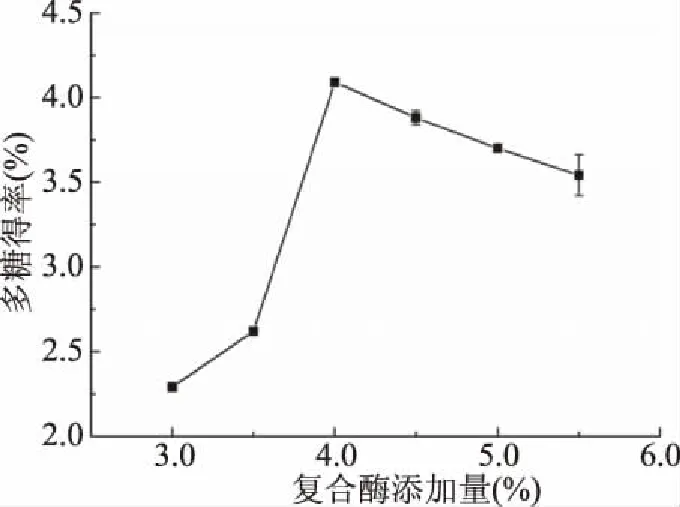
图1 复合酶添加量对多糖得率的影响Fig.1 Effects of multienzyme complex dose on the yield of polysaccharide
2.1.2 pH对杜仲叶多糖得率的影响 pH对杜仲叶多糖得率的影响见图2。随着pH的增大,杜仲叶多糖得率先快速上升,然后急速下降,在pH为4.0时达到最大值4.21%±0.04%。pH能改变酶的构象和影响酶的生物活性[23],不同种类的酶有各自最适作用pH,但在复合使用时,各类酶对某一特定底物的综合作用效果最大时为该复合酶的最佳pH。图2显示,pH4.0是复合酶的最佳pH。此外,有研究显示酶辅助提取法对果胶酶有很大的依赖性,而果胶酶的最适作用pH为4.0[24]。故确定pH4.0作为最适pH。
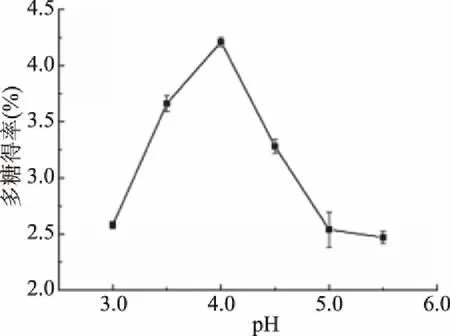
图2 pH对多糖得率的影响Fig.2 Effects of pH on the yield of polysaccharide
2.1.3 提取温度对杜仲叶多糖得率的影响 提取温度对杜仲叶多糖得率的影响见图3。当提取温度从35 ℃升高到45 ℃时,杜仲叶多糖的得率迅速提高,然后随着温度的进一步升高而降低,在45 ℃时达到最大值4.37%±0.03%。温度的升高会提高酶的活性和分子运动,加速细胞内多糖的释放和溶剂的进入[25],但温度过高则会使酶变性,酶活降低[26],从而导致多糖得率下降。
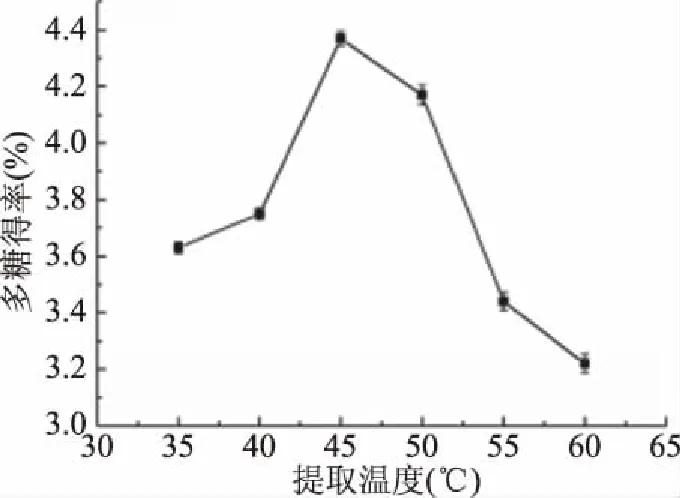
图3 提取温度对多糖得率的影响Fig.3 Effects of extraction temperature on the yield of polysaccharide
2.1.4 超声波功率对杜仲叶多糖得率的影响 超声波功率对杜仲叶多糖得率的影响见图4。多糖得率随着超声波功率的增大先缓慢上升然后下降,在100 W时达到最大值4.49%±0.02%。这是因为超声波产生的空洞效应和振动可以促进细胞破碎,有利于多糖的溶解和扩散,但是过高的功率可能会导致多糖降解[27]。因此,100 W被选为最佳超声波功率。
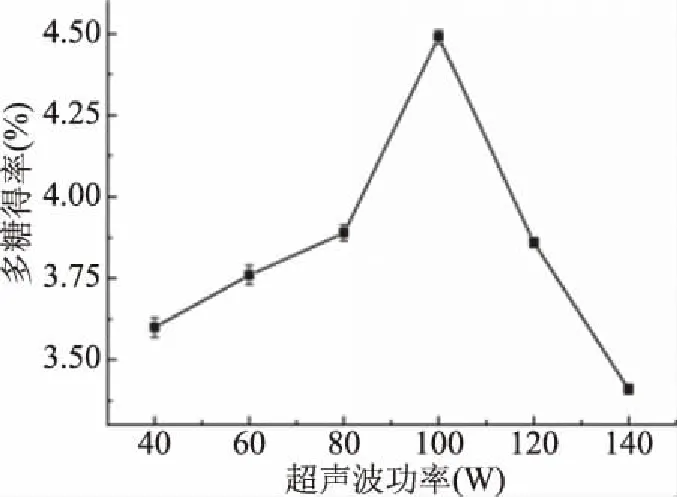
图4 超声波功率对多糖得率的影响Fig.4 Effects of ultrasonic power on the yield of polysaccharide
2.1.5 液料比对杜仲叶多糖得率的影响 液料比对杜仲叶多糖得率的影响见图5。随着液料比的增加,杜仲叶多糖的得率增加,在20∶1 mL/g时达到最大值4.60%±0.03%。这是因为较大的液料比可以提高溶剂在细胞中的扩散速率,并从材料中溶解更多的多糖[28-29]。而当液料比大于20∶1 mL/g时多糖得率反而下降,这可能是因为酶与底物接触机会降低,细胞壁降解减慢所致。考虑到提取效率和后继浓缩的成本,液料比选择20∶1 mL/g为宜。
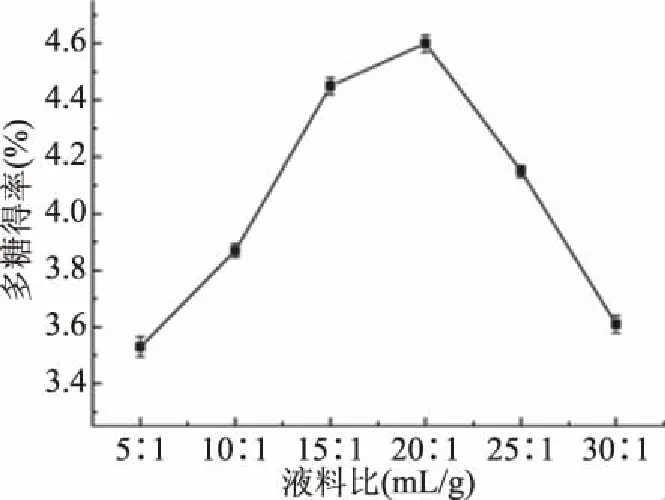
图5 液料比对多糖得率的影响Fig.5 Effects of ratio of liquid to solid on the yield of polysaccharide
2.1.6 提取时间对杜仲叶多糖得率的影响 提取时间对杜仲叶多糖得率的影响见图6。杜仲叶多糖的得率随着提取时间的延长而上升,在15 min达到最大值4.72%±0.03%,超过15 min得率下降。溶剂的渗入以及多糖的溶出都需要一定时间,但提取时间过长可能会导致多糖遭到超声波的破坏,影响多糖得率[30]。因此选择最佳提取时间为15 min。
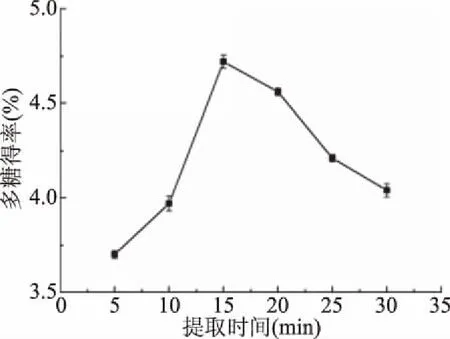
图6 提取时间对多糖得率的影响Fig.6 Effects of extraction time on the yield of polysaccharide
2.2 Plackett-Burman实验结果
Plackett-Burman实验结果及各因素的效应评价如表3、表4所示。

表3 Plackett-Burman实验结果Table 3 Results of Plackett-Burman experiment
由表4可知,影响多糖得率的显著因素为复合酶添加量、pH和超声波功率,根据其P值大小可知重要性依次为:pH(B)>超声波功率(D)>复合酶添加量(A),其中pH对杜仲叶多糖得率的影响达到极显著水平(P<0.01)。提取温度、液料比和提取时间为非显著影响因素,故选择pH、超声波功率和复合酶添加量开展下一步的响应面优化实验。考虑到提取效率与节约成本,在响应面优化实验中将提取温度、液料比和提取时间分别固定为45 ℃、20∶1 mL/g和15 min。
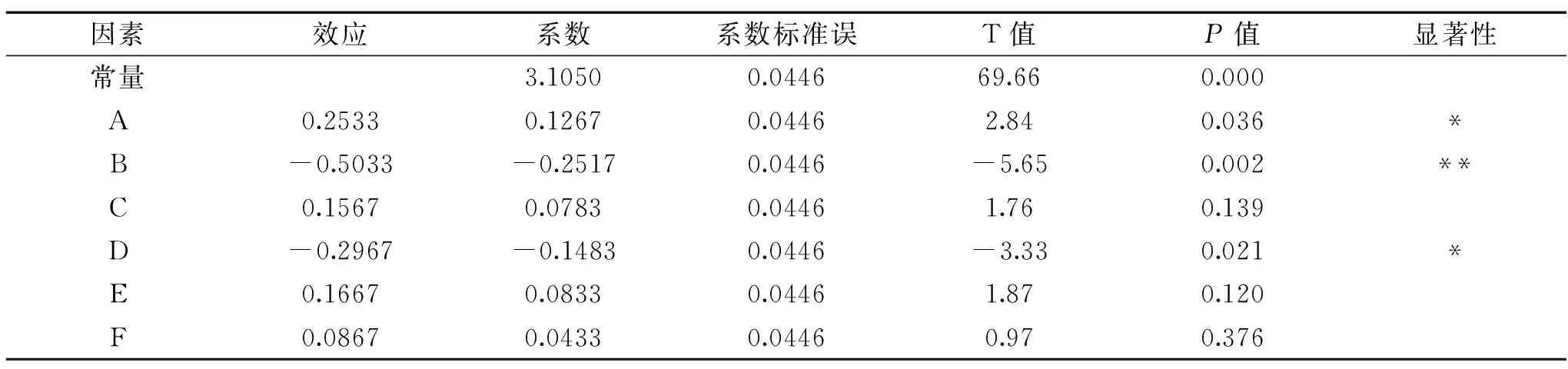
表4 Plackett-Burman实验各因素效应评价Table 4 Effect evaluation of factors of Plackett-Burman experiment
2.3 最陡爬坡实验结果
对表3中的数据进行回归分析,得到一次拟合方程:Y=0.031042+0.001258A-0.002508B+0.000792C-0.001475D+0.000825E+0.000425F。根据该拟合方程中各因素的系数设计最陡爬坡实验的方向,系数如果为正值,爬坡实验中各因素水平值为由小变大,反之,则由大变小。步长根据单因素实验结果进行设计。表5为最陡爬坡实验设计与结果。结果表明表5中第4号实验的多糖得率最大,故选择第4号实验中的实验条件作为后面Box-Behnken实验的0水平。

表5 最陡爬坡实验结果Table 5 Results of steepest climb experiment
2.4 Box-Behnken响应面实验结果
Box-Behnken响应面实验结果见表6。

表6 Box-Behnken响应面实验结果Table 6 Results of Box-Behnken experiment
对实验结果进行回归拟合,得到显著影响杜仲叶多糖得率(Y)因素的二元回归方程:
Y=-0.6+0.58475A+0.054625B+0.75475C+4.125×10-3AB-1.70553×10-6AC+4.125×10-3BC-0.122A2-4.3625×10-4B2-0.157C2

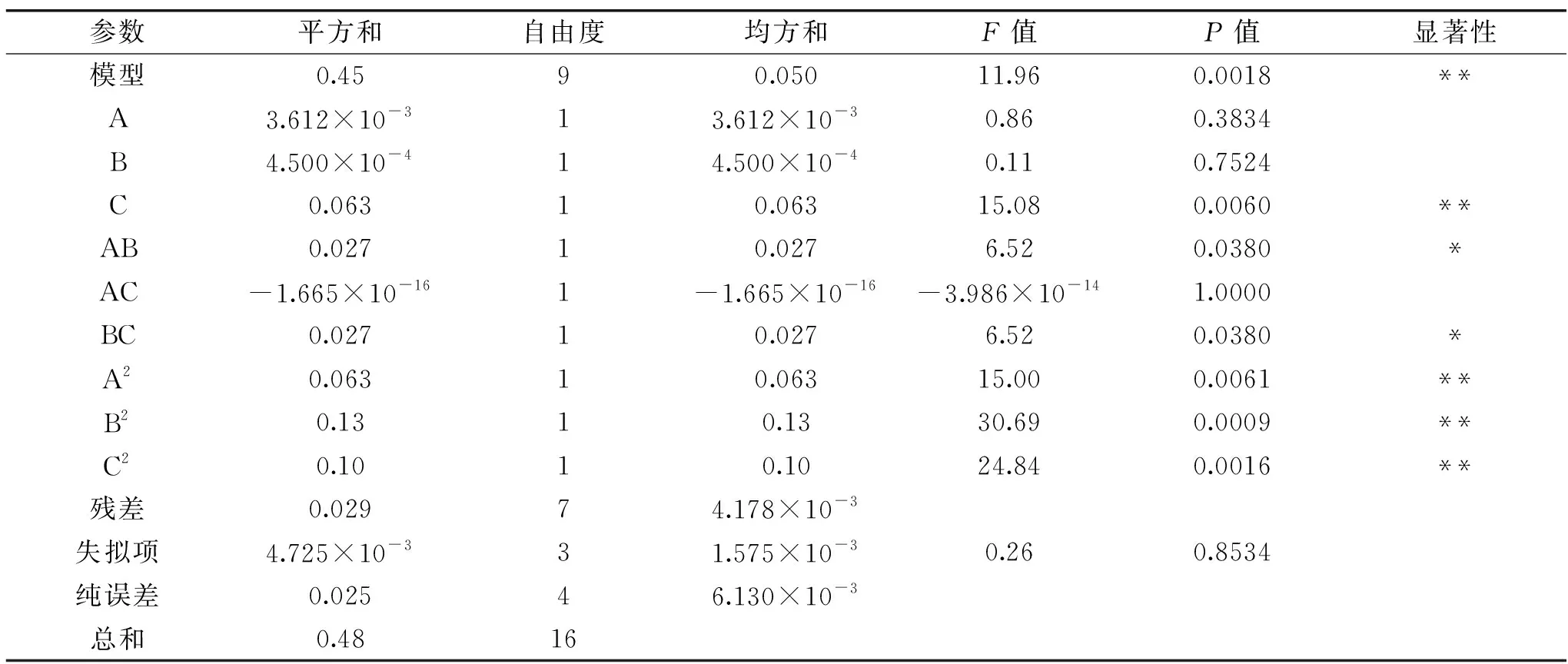
表7 回归模型方差分析结果Table 7 Results of variance analysis of response surface quadratic model
将一个因素固定在0水平,其余两因素间交互作用对多糖得率影响的响应面图见图7。图7(A)和图7(C)的响应面坡度较陡,说明pH与超声波功率、超声波功率与复合酶添加量间交互作用显著,而图7(B)的响应面坡度较前面两个小,即pH与复合酶添加量间交互作用不显著。
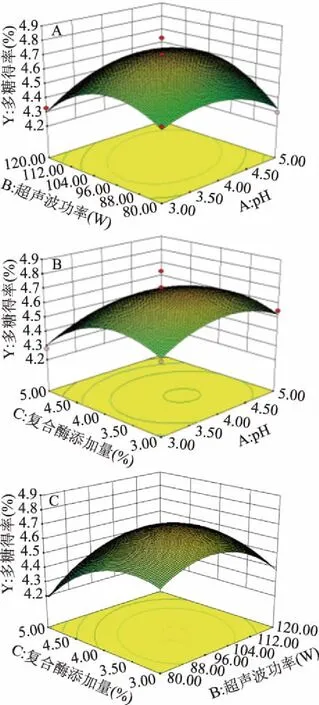
图7 两因素间交互作用响应面图Fig.7 Response surface plots of interaction between two factors
3 结论
本实验对超声波-协同酶法提取杜仲叶多糖工艺条件进行优化,通过Plackett-Burman实验筛选出三个显著影响多糖得率的因素:pH、超声波功率和复合酶添加量,其重要性依次为:pH>超声波功率>复合酶添加量。超声波-协同酶法提取杜仲叶多糖的最佳工艺条件为复合酶添加量3.7%、pH4.0、超声波功率100 W、提取温度45 ℃、液料比20∶1 mL/g和提取时间15 min,在此条件下杜仲叶多糖的实际得率为4.79%±0.02%,与理论得率4.87%接近,且得率远高于传统的水浸提法。研究结果表明,与传统提取方法相比,超声波-协同酶法辅助提取法能高效提取杜仲叶多糖,有利于降低生产成本,对杜仲叶多糖的工业化生产具有重要意义。但是,超声波物理场作用下的生产规模如何放大、如何通过酶的筛选进一步提高提取效率等问题还有待进一步的研究。

