媒介蚊虫抗病毒重要途径的研究进展*
朱春玲 李金福 郭晓霞 赵彤言
(1.军事科学院军事医学研究院微生物流行病研究所,病原微生物生物安全国家重点实验室,媒介生物危害和自然疫源性疾病北京市重点实验室,北京 100071;2.贵州医科大学人体寄生虫学教研室,贵州贵阳 550000)
蚊媒病毒是由蚊虫通过叮咬人、畜而传播的病毒,它能在蚊虫体内繁殖而不使其致病,但可通过叮咬将病毒传播给人类从而使人出现出血、脑炎、发热等症状。绝大多数蚊媒病毒均是RNA病毒,其中包括黄病毒科(Flaviviridae)(+ssRNA)、披膜病毒科(Togaviridae)(+ssRNA)、布尼亚病毒科(Bunyaviridae)(-ssRNA)、弹状病毒科(Rhabdoviridae)(-ssRNA)和呼肠孤病毒科(Reoviridae)(dsRNA)(Gubler 2001; Contigianietal., 2017)。由于全球旅游和城市化的迅猛发展,蚊虫在全球范围内快速扩张,蚊媒病的暴发流行和传播扩散对全球人类和动物健康构成了潜在风险(Kraemeretal., 2015),其中登革热和寨卡病毒病是最具破坏性的疾病。近年来,登革热发病率急剧上升,每年估计有3.9亿人感染登革病毒。寨卡病毒是一种新兴的蚊媒病毒,2015—2016年寨卡病毒的流行在拉丁美洲产生了巨大影响,这种疾病对人类健康构成重大威胁。因此,2016 年 2 月世界卫生组织(WHO)宣布将寨卡疫情列为全球紧急公共卫生事件(Mayeretal., 2017)。目前,多数蚊媒病毒病仍然没有有效的疫苗或特定的治疗方法。因此,抑制病毒在蚊虫体内复制和阻断病毒传播将是控制蚊媒病毒传播的有效途径。而对蚊虫体内先天抗蚊媒病毒感染的免疫机制进行研究将有助于制定新的蚊媒病控制策略。
大多数蚊媒病毒可造成脊椎动物显著的发病率和死亡率,而蚊虫本身不致病,普遍认为蚊媒病毒感染在蚊虫体内是持久性和系统性的(Lambrechtsetal., 2009),因为蚊虫已经进化出一种独特、有效的免疫系统,能将病毒复制降低到非致病水平。与哺乳动物的免疫系统不同,蚊虫不具备适应性免疫反应,其主要依靠先天免疫来对抗病毒感染。小RNA干扰(RNAi)和一些保守的固有免疫信号途径,如JAK-STAT(Janus kinase-signal transducer and activator of transcription)途径、Toll样信号通路(Toll-like receptors)途 径 和免 疫 缺 陷(Immune deficiency,IMD)途径,是蚊虫细胞内抗病毒机制的主要组成部分。其中,蚊虫体内最强大的抗病毒防御是RNA干扰(RNAi)途径(Dingetal., 2007)。
1 RNA干扰(RNAi)途径
RNA干扰(RNAi)是蚊虫抗病毒的核心机制,特别是通过RNA的降解(又称RNA沉默)来控制病毒感染。RNAi 途径主要包含3种主要的小RNA途径:小干扰RNA(siRNA)、微小RNA(miRNA)和PIWI蛋白相互作用RNA(piRNA)(Keeneetal., 2004; Campbelletal., 2008;Fragkoudisetal., 2009; Donaldetal., 2012; Blairetal., 2015; Miesenetal., 2016)(图1)。
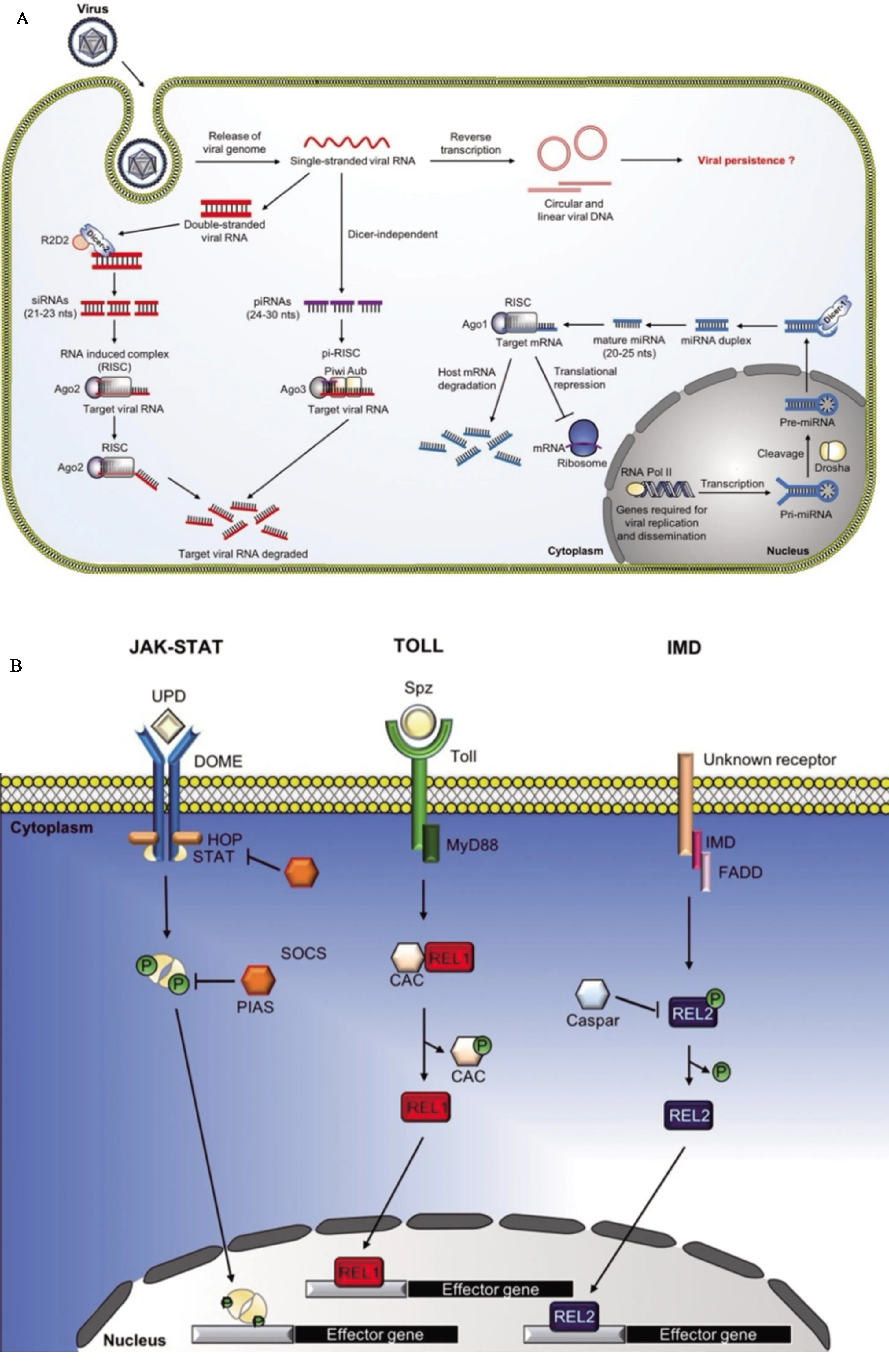
图1 蚊虫的RNAi途径(A)和JAK-STAT, Toll, Imd途径(B)(Lee et al., 2019)
1.1 siRNA途径
蚊虫的siRNA抗病毒免疫是由病毒复制过程中产生的外源长双链RNA(dsRNA)分子触发的。这些dsRNA被一些siRNA生物发生成分识别,并被加工成21个核苷酸(nt)为主的成熟病毒siRNA(vsiRNA)。这些vsiRNAs被加载到包含内切酶Argonaute-2(Ago-2)的多蛋白RNA诱导沉默复合物(RISC)中。Ago-2可与含有互补序列的病毒RNA基因组(或mRNA)靶向结合,触发靶RNA的裂解,从而减少病毒的复制。这些结果强调了外源RNAi途径在控制病毒复制中的作用(Keeneetal., 2004; Campbelletal., 2008; Sanchez-Vargasetal., 2009; Carissimoetal., 2015; Dietrichetal., 2017)。
siRNA在蚊虫体内抗病毒作用首次在冈比亚按蚊Anophelesgambiae细胞系中被证实,在该细胞系中,抑制病毒RNA的复制依赖于Ago-2蛋白(Lietal., 2004)。随后,多个研究报道,在敲除siRNA通路相关成分后,感染蚊媒病毒的蚊虫和细胞株中的病毒复制水平均升高(Keeneetal., 2004; Lietal., 2004; Campbelletal., 2008; Cirimotichetal., 2009;Brackneyetal., 2009; Sanchez-Vargasetal., 2009; Varjaketal., 2017)。一些研究还表明,成蚊和蚊虫细胞系感染蚊媒病毒后会产生病毒衍生的siRNAs(vsiRNAs)(Mylesetal., 2008; Mylesetal., 2009; Brackneyetal., 2009; Scottetal., 2010; Siuetal., 2011; Legeretal., 2013; Schnettleretal., 2013)。此外,这些siRNAs被证明在蚊虫感染甲病毒的过程中具有重要的抗病毒作用。埃及伊蚊Aedesaegypti和冈比亚按蚊在感染了能够表达dsRNA结合蛋白和RNA沉默病毒抑制因子(VSR)的重组甲病毒后,蚊虫体内的vsiRNAs显著减少,导致病毒复制量和蚊虫死亡率显著增加(Mylesetal., 2008)。这些蚊虫感染了能够表达VSR蛋白的重组甲病毒后的反应与RNAi缺失的突变果蝇感染病毒时病毒复制增加的疾病表型相似(Hardyetal., 1983; Matrangaetal., 2005;Ghildiyaletal., 2009)。最近在敲除Dcr-2的埃及伊蚊感染Sindbis病毒(SINV)时也观察到类似的疾病表型,这表明Dcr-2能够引发抗病毒免疫反应,并限制病毒在媒介宿主中的致病作用(Matrangaetal., 2005; Basuetal., 2015; Samueletal., 2016)。在同一项研究中,与野生型蚊虫相比,Dcr-2基因突变型的埃及伊蚊感染黄病毒后体内病毒的复制显著增加,表明RNAi也是蚊虫重要的抗黄病毒机制。
在受到蚊虫宿主的先天免疫消除的同时,蚊媒病毒也在进化,以对抗蚊媒的抗病毒免疫途径。通过鉴定蚊媒病毒基因组中编码的RNA沉默的抑制因子(VSR),有助于了解蚊媒病毒在蚊虫体内的长期感染和传播机理(Schusteretal., 2014)。布尼亚维拉病毒(Bunyamwera virus, BUNV)S段(NSs)编码的非结构蛋白是VSR,研究表明BUNV-NSs缺失突变株在Dcr-2缺陷型蚊虫细胞系的病毒复制水平比正常蚊虫细胞系高,并且对于埃及伊蚊来说,BUNV-NSs缺失突变株的感染能力比野生型BUNV低(Szemieletal., 2012)。另一研究表明登革热病毒(Dengue virus,DENV)NS4B蛋白可干扰Dicer对siRNAs的处理(Kakumanietal., 2013)。哺乳动物细胞中的基因沉默研究表明,跨膜结构域3和5在某种程度上参与了VSR抑制病毒增殖的活性(Kakumanietal., 2013)。然而,其具体的抑制机制尚不清楚。此外,有研究发现在Dcr-2缺陷型蚊虫细胞系中,黄病毒衣壳蛋白(yellow fever virus capsid, YFC)可作为VSRs,从而拮抗siRNA途径(Samueletal., 2016)。YFC 可能通过dsRNA的非特异性结合而使siRNA途径产生拮抗作用,继而干扰Dicer产生vsiRNA。VSRs与dsRNA的非特异性结合在探讨其拮抗作用的过程中起着重要作用。
1.2 piRNA途径
piRNAs是最大的一类与PIWI蛋白相互作用的小的非编码RNA,大小通常在24~30 nt之间,并调节转座因子转录或转座(Hirakataetal., 2016)。piRNA 的生成不依赖 Dicer,而依赖 PIWI 亚家族蛋白,piRNA分子与Argonaute-3(Ago-3)和PIWI蛋白相互作用,形成所谓的“乒乓”机制(Brenneckeetal., 2007)。与果蝇相似,冈比亚按蚊基因组编码3个PIWI亚家族成员:Ago3、PIWI和Aub,致倦库蚊Culexquinquefasciatus有7个,而埃及伊蚊的已经增加到8个(PIWI 1-7和Ago3),其中一些蛋白的表达已经在蚊虫细胞或组织中得到证实(Brenneckeetal., 2007; Campbelletal., 2008; Lewisetal., 2016)。一些研究发现在病毒感染的伊蚊细胞和组织中可以检测到多种病毒piRNAs(vpiRNAs),这些vpiRNAs属于Togaviridae(Brackneyetal., 2010; Vodovaretal., 2012),黄病毒科(Brackneyetal., 2010; Hessetal., 2011; Miesenetal., 2016),布尼亚病毒科(Brackneyetal., 2010; Vodovaretal., 2012)和Reoviridae(Schnettleretal., 2012)。
除了siRNA途径外,piRNA途径也是抵御蚊媒病毒的重要防线。比如,有研究表明,在埃及伊蚊Aag2细胞中,Piwi4基因被敲除后,SFV的复制能力得到了显著提高(Schnettleretal., 2013)。Aag2细胞中Piwi5和Ago3的敲除导致SINV中vpiRNA的表达显著下降,但病毒复制没有受到太大的影响(Miesenetal., 2016)。感染了SINV或RVFV的伊蚊U4.4和Aag2细胞的培养物中检测到病毒基因组衍生的siRNAs和具有乒乓循环特征的piRNAs(Morazzanietal., 2012; Vodovaretal., 2012;Legeretal., 2013)。在果蝇的研究中首次发现piRNA乒乓通路,原发的piRNA与两种PIWI蛋白(Aub和PIWI)相关,与Ago3无关。二次乒乓扩增是piRNAs特异性特征的起源,其中包括反义链piRNAs的第一核苷酸位置(1U)偏向和正义链piRNAs的位置10(10 A)偏向(Brenneckeetal., 2007; Brackneyetal., 2010)。对感染CHIKV的白纹伊蚊头部和胸部的小RNA序列进行分析,发现病毒衍生的piRNAs的数量增加了5.7倍,且在缺乏生殖组织的蚊虫中有59U和A10的标记,提示这些piRNAs是一种非典型乒乓依赖性途径的产物(Morazzanietal., 2012)。
研究发现整个或部分RNA病毒序列在宿主基因组中持续整合或内化(Holmes 2011; Feschotteetal., 2012),这为蚊媒病毒基因组起源和进化提供了记录。这些内源性病毒元素(EVEs)可能在蚊虫的抗病毒免疫中发挥作用。最近,在白纹伊蚊和埃及伊蚊的基因组中发现了大量的EVE(Suzukietal., 2017),是类piRNA分子的重要来源。这些由内源性黄病毒素(EFVEs)产生的piRNAs主要以反义方向转录,提示EVEs通过靶向病毒RNA在piRNA途径中的作用。
科学家们现在对piRNAs的生物起源和功能有了初步的了解,但仍有许多问题有待探索。需要进一步的研究来确定vpiRNA产生的分子机制以及piRNA途径对蚊媒病毒媒介相互作用的贡献。
1.3 miRNA途径
MicroRNAs(miRNAs)是约22个核苷酸(nt)的非编码 RNA,通过在转录水平或转录后水平调控基因表达,在各种生物学过程中发挥重要作用(Jonasetal., 2015)。miRNA前体(pri-miRNAs)起源于独立的miRNA基因或mirtrons,在RNA转录产物中被编码为内含子。发夹结构的pri-miRNA被RNaseⅢ型内切酶Drosha加工成约70 bp的发夹,然后由Dicer-1将其从细胞核中导出到细胞质中,再由Exportin 5将其切割成约20 bp的miRNA双链(Yietal., 2003; Kimetal., 2009; Haetal., 2014)。根据miRNA诱导沉默复合物(miRISCs)的不同结构,细胞质中的miRNA双链被装载到Ago-1或Ago-2蛋白中(Forstemannetal., 2007; Ghildiyaletal., 2010; Yangetal., 2014)。miRISC主要利用成熟miRNA(种子区)5′-端的残基2-8,利用前导链寻找互补的RNA序列,从而导致RNA降解(由Ago-2进行)、翻译抑制或两者兼有(由Ago-2以外的其他Ago蛋白介导)(Lietal., 2014;Wilczynskaetal., 2015)。通常,动物miRNA结合位点主要位于3′-UTR(Pillaietal., 2007),然而5′-UTR或编码区的miRNA结合位点也有报道,并且能参与转录后基因调控(Leeetal., 2009;Hausseretal., 2013; Brummeretal., 2014)。
迄今为止,已有一些虫媒病毒媒介(主要是蚊虫)的miRNAs被报道。包括埃及伊蚊(Lietal., 2009)、白纹伊蚊(Skalskyetal., 2010;Guetal., 2013)、冈比亚按蚊(Winteretal., 2007)、斯蒂芬斯按蚊Anophelesstephensi(Meadetal., 2008)和致倦库蚊(Skalskyetal., 2010)。在无脊椎动物和脊椎动物中,病毒感染可引起细胞miRNAs的差异表达,这可能是由宿主对感染的反应或病毒干扰miRNA的生物发生所致。
早期的一项研究中,致倦库蚊感染西尼罗河病毒(纽约株99,WNVNY99)后可引起蚊体内少量miRNAs表达量的变化(Skalskyetal., 2010)。其中miR-989下调了2.8倍,而miR-92在病毒感染后上调1.5倍。对感染WNVNY99的致倦库蚊进行高通量测序,发现除这两个miRNAs外,另外还有4个miRNAs、miR-957、miR-970、miR-980和miR-33在WNVNY99感染的蚊虫中的表达量也有不同程度的变化。研究人员推测miR-989和miR-92可能在WNV与蚊虫的相互作用中起作用。在埃及伊蚊中,有研究表明DENV(Campbelletal., 2014)和ZIKV(Saldanaetal., 2017)的感染都可引起蚊虫体内miRNA谱发生改变。将感染登革病毒2型(DENV-2)后2、4和9 d的蚊虫miRNA谱与对照组蚊虫进行了对比。结果显示,DENV-2感染后,共有35个miRNAs的表达量发生显著差异;在感染后2 d(dpi)有5个miRNAs,在感染后4 d有3个miRNAs,在感染后9 d有27个miRNAs;其中4个上调,其余下调。有趣的是,在每个时间点差异表达显著的miRNAs是不同的(Campbelletal., 2014)。而感染ZIKV后2、7和14 d的埃及伊蚊和未感染的埃及伊蚊进行对比,发现寨卡病毒感染后3个时间点都有miRNAs发生显著差异表达,并且发现了17个miRNAs在所有时间点都有差异表达(Saldanaetal., 2017)。此外,有研究表明某些特定的miRNA还会影响病毒的复制,在DENV病毒感染白纹伊蚊后,蚊体内miRNA的miR-252表达增加;并且抑制该miRNA会使病毒的复制增强,而该miRNA的过表达则会抑制病毒的复制(Yanetal., 2014)。在白纹伊蚊中也有类似研究,喂食含DENV-2的血餐的白纹伊蚊与喂食不含DENV-2的血餐的白纹伊蚊相比,喂食含DENV-2的血餐后一共有 43 个 miRNA 上调,4个miRNA下调;并且通过细胞实验验证aal-miR-4728-5p 转入C6/36 细胞中可以使DENV-2的复制增强(Suetal., 2017)。通过进一步研究,感染 DENV-2与未感染DENV-2的白纹伊蚊的中肠相比,有 15 个miRNA 上调,2 个 miRNA 下调;并且 miR-1767 和miR-276-3p 在C6/36 细胞中起到增强DENV-2复制的作用(Suetal., 2019)。这些研究表明,病毒感染可引起蚊媒病毒和宿主miRNAs之间复杂的相互作用。虽然有少量miRNAs的功能被验证,但是还需要其他的功能实验来确定具体的机制。
综上所述,RNAi在蚊虫中具有一定的抗病毒作用。近年来,RNAi被运用于改造蚊虫以改变蚊虫与病毒的相互作用。
在早期的一项研究中发现,在中肠上皮细胞中表达DENV序列特异性反向重复序列(IR)的埃及伊蚊,经过siRNA机器处理后,这些蚊虫对DENV的敏感性降低了(Franzetal., 2006)。然而,这种表型在经过几代传代后就消失了,可能是由于异染色质重排导致的(Franzetal., 2009)。这个研究小组,在之前的研究基础上,将表达IR的蚊虫与野生型蚊虫杂交几次,获得了更高的稳定性(Franzetal., 2014)。另一项研究中,在蚊虫唾液腺中表达IR时,使用了类似的方法,也降低了DENV敏感性,从而降低蚊虫的媒介能力(Mathuretal., 2010)。在最近的研究中,研究者设计了一个系统来表达针对CHIKV和DENV的miRNA类似分子,这些分子在普遍存在的启动子或可诱导的中肠特异性启动子下表达,结果显示这些蚊虫对DENV和CHIKV的感染、传播和传播率低于对照组(Leeetal., 2019)。与依赖siRNA途径的IR方法不同,这种方法主要依赖miRNA途径。总之,RNAi途径已经成功地应用于蚊虫中,以产生对特定病毒更具抵抗力的蚊虫,不过使用RNAi方法来消除蚊媒病毒传播仍存在很多困难,有待进一步研究。
2 其他保守的固有免疫信号途径
虽然RNAi途径似乎是存在于蚊虫体内的一种强大的抗病毒途径,但有一些证据表明,其他进化保守的免疫途径,如Jak-STAT、免疫缺陷(Imd)和Toll途径,在抵抗病毒感染的反应中也起着重要作用(Chengetal., 2016; Marquesetal., 2016)(图1)。
2.1 JAK/STAT途径
JAK/STAT途径主要是将细胞外的化学信号传递至细胞核,从而导致免疫相关基因的转录,产生大量的细胞因子和生长因子参与抗病毒反应。哺乳动物和昆虫JAK/STAT途径的核心组成部分在整个进化过程中高度保守(Dostertetal., 2005; Souza-Netoetal., 2009; Liuetal., 2012),并被认为在两组抗病毒免疫中都起着关键作用(Claytonetal., 2014; Xuetal., 2014)。
虽然Jak-STAT通路在蚊虫对病毒的免疫反应中的作用的研究不如模型生物D-melanogaster深入。但近年来也有不少关于蚊虫JAK-STAT通路的研究,比如:埃及伊蚊感染蚊媒病毒后,能够使JAK-STAT通路相关基因的表达上调(Behuraetal., 2011; Colpittsetal., 2011);并且JAK-STAT通路的有关成分被敲除后,虽然并未报道病毒复制的显著增加和蚊虫存活率的降低,但被敲除的埃及伊蚊对登革病毒的易感性增强(Souza-Netoetal., 2009)。于此相反的是,白纹伊蚊细胞系(U4.4)感染甲病毒(Semliki Forest virus,SFV)后,并未激活STAT途径,这表明该途径的抗病毒作用与果蝇相似,可能具有病原体或组织特异性(Fragkoudisetal., 2008)。
在脊椎动物中,包括日本脑炎病毒(JEV)、WNV和DENV在内的蚊媒病毒通过抑制JAK磷酸化来干扰JAK-STAT途径,从而防止STAT1和STAT2向细胞核的移位,或改变ISG基因的表达(Linetal., 2004; Guoetal., 2005; Hoetal., 2005)。尽管没有直接证据表明蚊媒病毒干扰了蚊虫体内的JAK-STAT途径,但在感染JEV的C6/36蚊虫细胞中,STAT磷酸化和DNA结合活性受到抑制(Linetal., 2004)。类似地,热灭活细菌与SFV相比对U4.4细胞中JAK-STAT途径的激活程度更低(Fragkoudisetal., 2008)。因此,有必要进行更多的研究,以确定蚊媒病毒是否已经进化成编码蚊虫媒介中JAK-STAT通路的特异性拮抗剂。
2.2 Toll 样途径和Imd途径
Toll和Imd途径是两种不同的天然免疫途径,与哺乳动物NF-κB信号途径非常相似,后者是AMPs产生的关键调控因子。Toll通路最早在果蝇中被报道,其对真菌和革兰氏阳性细菌等病原体有天然免疫作用,而革兰氏阴性菌感染激活的是Imd途径(Duneauetal., 2017)。病原体通过PAMPs与宿主PRRs的结合激活Toll和Imd途径,从而导致一系列反应,继而激活产生AMPs的免疫效应基因。Toll途径是由细胞因子Spz的裂解而启动的,Spz是一种与Toll跨膜受体结合的配体;激活的Toll通过MyD88、Tube(与Toll相关的衔接蛋白)和Pelle激酶触发信号传导。随后,Toll通路的负调控因子Cactus被磷酸化后被蛋白酶降解,导致转录因子Rel1从细胞质转移到细胞核,并与许多AMPs基因启动子上的k-B基序结合,比如对真菌和革兰氏阳性细菌有活性的二尖瓣霉素和抗菌肽(Shinetal., 2006)。而Imd途径的激活导致负调节因子Caspar的降解,从而导致Rel2转移到细胞核,导致AMPs的转录(Kimetal., 2006;Xietal., 2008)。
除了对细菌和真菌病原体的防御作用外,Toll和Imd途径也与昆虫的抗病毒反应有关。这些途径依赖于模式识别受体的激活,通过抗菌肽介导下游抗病毒反应(Zambonetal., 2005; Xietal., 2008; Avadhanulaetal., 2009; Costaetal., 2009; Luplertlopetal., 2011)。果蝇感染SINV后,Imd途径基因突变会导致病毒复制增加(Avadhanulaetal., 2009)。将冈比亚按蚊的Imd途径的相关组分敲除后,用 O′nyong nyong 病毒(ONNV)感染敲除后的冈比亚按蚊的研究中也得到了类似的发现(Carissimoetal., 2015)。在其他蚊虫的抗病毒免疫反应中,Toll通路也发挥着重要的作用。研究表明,埃及伊蚊感染DENV-2导致Toll通路相关基因表达上调;Toll通路基因的激活可降低DENV-2易感性;而抑制该通路可使病毒载量增加(Xietal., 2008; Panetal., 2012)。然而,果蝇或蚊虫的Toll通路在甲病毒感染时并未起到抗病毒作用(Fragkoudisetal., 2008; Avadhanulaetal., 2009; McFarlaneetal., 2014)。因此,与JAK-STAT途径类似,Toll途径对抗病毒的作用也可能是病毒特异性的。
综上所述,这些研究表明Toll、IMD和JAK/STAT通路有助于抵御蚊虫的病毒感染,并且具有病毒特异性,可用于抵抗特定蚊媒病毒的传播。然而,目前许多生物信息学和实验证据仅表明固有免疫信号通路参与了载体病毒的免疫反应,而这些通路是如何被病毒激活的以及所涉及的特定免疫因子仍有待进一步研究。
3 小结
目前,对于大部分的蚊媒病毒,还没有有效的疫苗或特定的治疗方法。媒介控制仍然是阻止蚊媒病毒传播的有效策略。最近,随着CRISPR/Cas9基因编辑技术的发展,转基因蚊虫已经被开发出来,并且正在进行实地试验,作为控制蚊虫传播疾病的潜在替代策略。然而,这些策略仍不完善,还不足以阻断病毒的传播。此外,对于病毒与其媒介蚊虫之间的相互作用知之甚少。因此,更深入地了解蚊虫如何对病毒感染作出反应,先天免疫系统如何控制病毒感染,促进病毒复制的其他宿主因素,病毒如何在蚊虫体内持续存在,以及不同的蚊虫物种或毒株在允许病毒感染的分子水平上如何变化,可以改善和最大限度地提高当前策略的有效性,并可能为新的病媒控制策略贡献新的分子靶点。

