猪肚菇多糖结构表征及其抑制乳腺肿瘤增殖转移的机制研究
李婷婷,张秀茹,刘淑文,古丽米然·阿里同别克,吴启赐,林志超,潘裕添
(闽南师范大学菌物产业工程技术中心,福建 漳州 363000)
癌症是致命的全球性疾病,也是影响人口累积生命周期的关键障碍,而针对于女性健康,属乳腺癌是影响女性发病率和死亡率最高的健康问题。据统计,2012年,全球新诊断乳腺癌病例超过160万例,乳腺癌死亡人数达521 907人[1],已超过宫颈癌,严重危害女性健康。虽然包括外科手术、放射线、激素疗法或化学疗法在内的积极的治疗方法提高了乳腺癌患者的生存率,但副作用强、治愈率低、复发快[2],可用的治疗方法还不够,乳腺癌患者的预后仍然很差[3]。迄今为止,还尚未发现有效的乳腺癌医治手段。因而研发有效的抗乳腺癌药物迫在眉睫。
天然产物是新药研发的重要来源。猪肚菇(Panusgiganteus),别名“大杯蕈”、“大杯香菇”、“大角菌”等[4],是近年国内新开发的一种食用药真菌。目前的资料表明,国内外已有众多对于猪肚菇多糖提取的文献报道,唐青等[5]以猪肚菇为原料探索其水溶性多糖的最佳提取工艺。Lee等[6]的研究表明从NaCl溶液中提取的猪肚菇粗多糖能延长S180肉瘤小鼠的生存期。但是,关于纯化的猪肚菇多糖的药理研究和抗肿瘤活性的报道很少。
本文选择猪肚菇为原料,分离纯化其多糖组份并进行纯度分析及结构表征;探究所得的猪肚菇多糖(panusgiganteuspolysaccharide,PGP)对MMTV-PyMT转基因乳腺癌小鼠肿瘤增殖、凋亡以及转移的作用机制,可为猪肚菇的未来药物开发提供科学依据。
1 材料
1.1 实验动物本实验中的小鼠为SPF级MMTV-PyMT转基因小鼠,小鼠背景为C57BL/6,购买自The Jackson Lab(与厦门大学实验动物中心签订科研合作,从其动物中心获取动物)。
1.2 药品与试剂猪肚菇干品,福建成发食用菌有限公司;DEAE sephadexA-50 葡聚糖凝胶购自瑞典Pharmacia公司(货号:S9130);氢氧化钠(货号:687)、乙二醇(货号:1)等均购自西陇化工股份有限公司;DextranT-10、T-40、T-70、T-500葡聚糖标准品均购自Seebio(货号:9004-54-0)。山羊抗鼠二抗(货号:S0002)、山羊抗兔二抗(货号:S0001)均购自Affinity公司;β-actin(货号:BF0198)、PARP(货号:DF7198)、PCNA(货号:AF0239)、MMP-9(货号:AF5228)、VEGF(货号:AF5131)、α-SMA(货号:AF1032)抗体均购于Affinity公司,IP 裂解液购自碧云天生物技术公司(货号:P0013C);超敏ECL化学发光试剂盒购自新赛美生物科技有限公司(货号:P10300)。
1.3 实验仪器高效液相色谱仪(1200,美国安捷伦);红外光谱扫描仪(iS10,美国Nicolet);气相色谱仪(7890B,美国安捷伦);电泳仪 (DYY-7C);转膜仪 (DYCZ- 40D,北京市六一仪器厂产品);化学发光凝胶成像系统(Omega Lum C,美国aplegen);石蜡切片机(RM2235,徕卡);倒置显微镜(OLYMPUS公司)。
2 方法
2.1 猪肚菇多糖的制备取100 g猪肚菇原料干品,在95 ℃下,按1 ∶20的料液比(kg·L-1)加入去离子水浸提3 h,过滤得滤液和滤渣。滤液离心(12 000 r·min-1,7 min)后经微孔滤膜过滤,Vivaflow 200超滤,再经旋转蒸发浓缩滤液,离心,冻干得猪肚菇粗多糖。将多糖样品溶液加到DEAE sephadexA-50葡聚糖凝胶层上方。利用0.02 mol·L-1pH 7.2 Tris-HCl溶液洗脱,收集洗脱液,此时洗脱下来的即猪肚菇中性糖。将收集的中性糖进行超滤、离心、冻干,得PGP。
2.2 HPLC测定纯度和相对分子质量标准曲线的制作:准确称取Dextran T-10、T-40、T-70、T-500系列多糖分子量标准物1 mg,配成2 g·L-1的多糖溶液,0.45 μm过滤,待上机。称取少量PGP,配成约2 g·L-1的溶液,0.45 μm过滤,待上机。液相条件:色谱柱7.8 mm×300 mm;柱温80.0 ℃,流动相为超纯水,流速0.6 mL·min-1,压力18.4 bar。
2.3 红外光谱分析取3~5 mg干燥至恒重的PGP,与干燥的40~50 mg溴化钾混合,玛瑙研钵中研磨,均匀混合后压片,上机测量。
2.4 单糖组成分析取120 mg PGP用5 mL的2 mol·L-1硫酸溶液移至安瓿瓶,酒精喷灯封口,水解(100 ℃,8 h)。冷却后用氢氧化钡固体调节溶液pH 7.00;离心(12 000 r·min-1,15 min)、冻干。将40 mg盐酸羟胺和2 mL吡啶加入到冻干后的PGP中,在90 ℃水浴锅中,30 min。室温冷却,再加入2 mL乙酸酐,在90 ℃水浴锅中,30 min。冷却至室温,0.45 μm过滤,待上机。称取标准单糖:葡萄糖、木糖、半乳糖、赤藓醇、甘油、甘露糖、阿拉伯糖、鼠李糖各40 mg,按上述进行乙酰化操作。0.45 μm过滤,待上机。单糖混标:取乙酰化的葡萄糖、木糖、半乳糖、甘露糖、阿拉伯糖、鼠李糖各200 μL混合,待上机。气相色谱(GC)条件:色谱柱Agilent 19091 J-413 LTM:HP-5,320.00 μm×30.0 m×0.25 μm;柱箱设定温度从120 ℃到270 ℃,在270 ℃下保持10 min;色谱柱温度120 ℃,压力(11.595 psi),流量(2 mL·min-1)。
2.5 动物模型给药实验本实验选取9周龄雌性的 MMTV-PyMT 转基因小鼠为实验对象,选取初始体质量及生长状态相近的小鼠,对照组与给药组小鼠各 6 只。称取PGP 75 mg,加入30 mL生理盐水,混合均匀后,过滤,配制成给药样品溶液终浓度为 2.5 g·L-1,按照 25 mg·kg-1的剂量尾静脉注射,给药周期为 25 d。对照组采用生理盐水代替。给药结束后,小鼠眼眶取血并脱臼处理,立即解剖小鼠获取肿瘤组织。将肿瘤组织样品集中拍照后按照实验目的取样,其中一部分用于蛋白水平的检测,另一部分加入 4%多聚甲醛固定用于石蜡组织包埋等,实验中选取同侧同部位的小鼠乳腺实体瘤组织保证取材的平行性,剩余的样品存放于-80 ℃超低温冰箱中。
2.6 蛋白质免疫印迹取瘤组织于1.5 mL离心管中加100 μL裂解液,30 min后,12 000 r·min-1离心15 min,取上清,测蛋白浓度。调整样品浓度,加入5×loading buffer,100 ℃煮样器中7 min,后4 ℃,12 000 r·min-1离心1 min后上样,调整电泳电压为60 V,150 min,随后电转,电流300~400 mA,90 min。电转后PVDF膜于5 %脱脂牛奶封闭液中摇1 h,弃去封闭液,加入一抗(浓度由 1 ∶500 到1 ∶2 000,视不同抗体而定)于4 ℃摇床上过夜。回收抗体,PBST清洗PVDF膜,放入二抗室温孵育1~1.5 h。ECL试剂盒显影,使用Omega LumC成像系统显影,后分析数据。
2.7 组织的石蜡包埋与切片制备采用石蜡包埋法包埋肿瘤组织样本,固定在4%的多聚甲醛中,经脱水、透明、浸蜡,于包埋机中进行包埋,而后进行切片(厚度 4 μm)、展片,烘片。
2.8 免疫组化及HE染色免疫组化:将切片脱蜡至水洗;经微波修复抗原后,将 3%H2O2滴到组织上,室温避光 30 min,用PBS洗4 min×5次;加羊血清封闭1 h,同上洗涤;敷一抗,4 ℃过夜;按照试剂盒的要求敷二抗,同上洗涤,进行 DAB 显色,自来水洗涤,苏木精染色,脱水,中性树脂封片。
HE染色:同样方法,将上述切片脱蜡至水洗,苏木精染色 5 min,自来水洗涤6 min,置于1%盐酸乙醇30 s,同上洗涤,伊红液染色 1~3 min,同上洗涤,脱水,中性树脂封片。
3 结果
3.1 PGP的结构表征利用凝胶色谱检测发现PGP为单峰组分,表明所提取的猪肚菇中性糖PGP为单组分物质(Fig 1A);建立多糖相对分子量测定标准曲线,得到线性回归方程为Y=-4.263 2X+34.206,R2=0.977 8,PGP的保留时间为8.877 min,代入回归方程得PGP的相对分子质量为871.331 ku。从红外光谱扫描结果分析(Fig 1B),PGP的官能团光谱与β-葡聚糖标准品的基本上一致,在846.22 cm-1处均有吸收峰,该特征峰为葡萄糖β端基差相异构C-H变角振动吸收峰,由此可推断PGP为β-糖苷键构型。
从GC图谱(Fig 1C)分析可知,PGP的GC柱前衍生化产物与多种标准单糖对比仅出现葡萄糖特征峰,因此,可推断PGP系由葡萄糖组成的均一多糖。根据PGP高碘酸氧化和Smith降解后产物的GC图谱结果(Fig 1D),结合标准品建立的标准曲线,可计算出PGP每种产物的百分含量,得到甘油、赤藓醇、甘露糖、葡萄糖占总组分物质的量的比例分别为32.55%、54.70%、5.66%和7.09%。从每摩尔己糖残基中推得,1-6键占比30.29%,1-2键占比2.25%,1-4键占比54.70%,1-3键占比12.75%。
综上实验结果,得出本研究所提取的PGP是由1-2键,1-3键,1-4键,1-6键构成的高纯度的β-葡聚糖。
3.2 PGP对MMTV-PyMT转基因乳腺癌小鼠肿瘤生长的影响以MMTV-PyMT转基因乳腺癌小鼠动物模型进行体内实验,在前期剂量有效性和安全性评价的基础上,选择适宜剂量25 mg·kg-1PGP进行尾静脉注射,对照组尾静脉注射生理盐水。给药25 d后,处死小鼠,取出乳腺肿瘤组织观察并称体质量。发现给药组的瘤重低于模型组的瘤重(如Fig 2B、C)(P<0.01)。综上,说明PGP能明显抑制乳腺癌的生长。该结果为PGP抗乳腺癌作用机制的研究奠定基础。
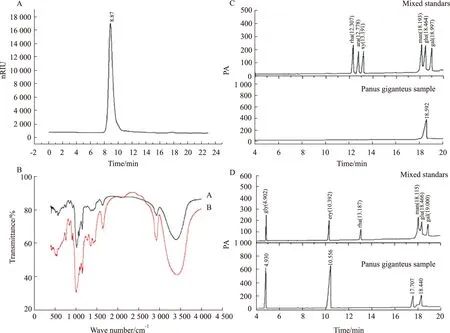
Fig 1 Structure analysis of Panus giganteus polysaccharideA: High performance liquid chromatography of Panus giganteus polysaccharide; B:Infrared spectrum of Panus giganteus polysaccharide; C: Monosaccharide gas chromatogram of Panus giganteus polysaccharide; D: GC analysis of Smith degradation products of Panus giganteus polysaccharide
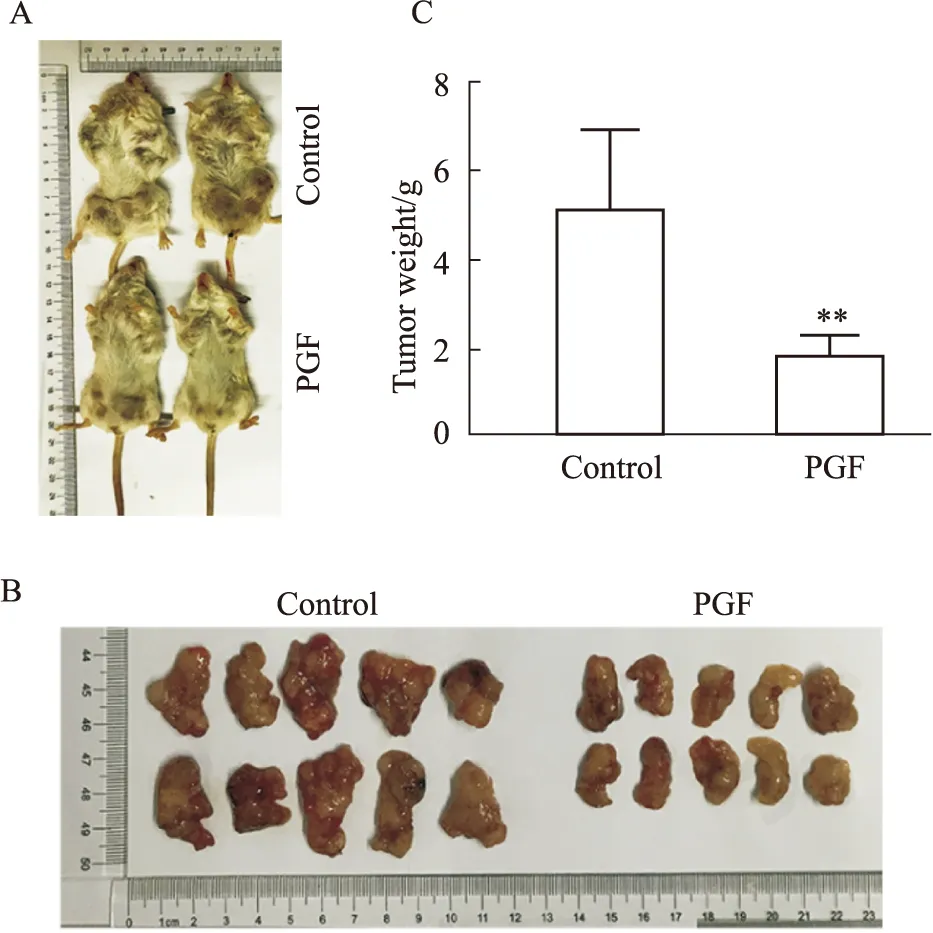
Fig 2 Tumor growth inhibited by PGP in mice with breast cancerA: Breast cancer mice in administration group and control group; B: Comparison of tumor tissue size between the administration group and the control group;C: Statistical results of tumor weight in vs vehicle.
3.3 PGP对MMTV-PyMT乳腺癌小鼠肿瘤细胞增殖及凋亡的影响对肿瘤组织进行切片病理分析和相关蛋白表达水平检测。从Fig 3A可以看出,模型组HE染色和增殖性细胞核抗原(PCNA)免疫组化明显均比PGP组密集、颜色加深,说明PGP明显抑制乳腺肿瘤细胞增殖;PGP组可见TUNEL染色绿色荧光强度明显比模型组增强,表明PGP具有促进乳腺肿瘤细胞凋亡作用。Western blot 检测(Fig 3B)也发现,PGP下调PCNA的表达,同时还下调聚腺苷酸二磷酸核糖转移酶(PARP)的表达(P<0.01)。实验结果从蛋白表达水平提示,PGP可抑制乳腺肿瘤细胞增殖和促进凋亡。
3.4 PGP对MMTV-PyMT转基因乳腺癌小鼠肺转移的影响为进一步探究PGP是否对乳腺癌小鼠的肿瘤细胞肺转移存在影响。通过HE染色检测,结果显示,PGP给药组能明显的减少转移灶的数目(Fig 4B),表观上说明PGP能抑制小鼠的乳腺肿瘤细胞肺转移。采用免疫组化来检测肺组织中α-SMA的表达水平,发现PGP能明显的抑制α-SMA的表达(Fig 4A);同时,Western blot检测发现,PGP给药后,明显下调MMP-9、VEGF及α-SMA等肿瘤转移相关蛋白的表达(P<0.01)(Fig 4C)。综上,提示PGP可通过调控MMP-9、VEGF及α-SMA表达从而抑制乳腺癌小鼠肿瘤细胞肺转移。

Fig 4 Lung metastasis inhibited by PGP in mice with breast cancerA:Immunohistochemical staining results of lung tissue samples of mice with breast cancer,and the brown markwas α-SMA level. The scale corresponding to the group drawing was 50 μm;B:Statistical chart of the number of metastases;C: Western blot results and gray value statistical vs vehicle.

Fig 3 Tumor cell proliferation inhibited and apoptosis promoted by PGP in mice with breast cancerA: HE staining, immunohistochemistry and TUNEL staining to detect the proliferation and apoptosis of breast cancer in mice;B:Western blot vs control.
4 讨论
多糖是一类非特异性免疫增强剂,它具有复杂多样的生物活性,对肿瘤、心血管疾病等有一定疗效[7]。且科学研究表明,食用真菌多糖对于调节免疫功能,治疗癌症,延缓衰老和缓解疲劳等方面起着重要的作用。研究结果表明,多糖的抗肿瘤效果与其结构存在关系,且认为多糖起活性效果或者是抗肿瘤效果的主要是1-3和1-6糖苷键[8-9],云芝多糖以β -(1-4)、β -(1-6)糖苷键为主链,对吉田氏肉瘤细胞、AH -130 细胞和艾利氏腹水癌细胞等有明显的抑制效果[10]。本研究通过HPLC、红外以及气相光谱分析得到PGP具有1-2,1-3,1-4,1-6糖苷键,且是以1-4,1-6糖苷键为主,经体外实验研究表明,PGP能有效的抑制乳腺肿瘤细胞增殖,促进凋亡,抑制肺转移,表明猪肚菇多糖与其他真菌多糖一样具有抗肿瘤功效,且是一种未见报道的新型结构猪肚菇β-葡聚糖。
大多数癌症的发生是由于其本身体细胞的癌症特异性DNA突变积累引起的(乳腺癌也不例外),而引起基因突变的因素多种多样,其中就包括DNA修复机制的失活,导致肿瘤细胞不受控制的生长和转移。PARP,PCNA作为评价细胞增殖状态的指标,在DNA的损伤修复、DNA复制、细胞扩散控制方面发挥着重要作用。早在2017年有报道,某些药物可以靶向同源重组DNA修复功能缺陷,如PARP抑制剂可以靶向治疗遗传性BRCA1和BRCA2乳腺癌。本研究结果发现,PGP给药组明显下调PCNA的表达,同时下调PARP蛋白的表达,提示PGP抑制乳腺肿瘤增殖的机制可能和DNA修复机制有关。
另外,乳腺癌症患者临床预后往往表现不佳,而肿瘤转移就是其中一个重要的因素。目前有研究表明,基质金属蛋白酶(MMP)能够降解细胞外基质的许多成分,致使恶性肿瘤细胞发生侵袭、转移和血管生成[11],而VEGF在肿瘤新生血管生长中起到重要的作用[12]。其能诱导基质降解过程的许多种酶和蛋白,包括基质降解金属蛋白酶,通过激活这些不同的复合物可降解周围环境从而利于内皮细胞迁移和萌芽[13]。本研究结果发现,与对照组相比,PGP能明显抑制MMP-9、VEGF等肿瘤转移相关蛋白的表达,表明PGP能够抑制肺转移可能与血管生成存在关联。并且目前研究资料表明,α-SMA表达增高的癌细胞具有间充质细胞的特征,侵袭能力增强[14]。而本研究中,免疫组化结果发现,PGP能明显的抑制α-SMA的表达,进一步提示PGP可抑制肿瘤转移相关蛋白的表达进而抑制肺转移。
综上,PGP能够有效的抑制乳腺癌肿瘤细胞增殖,促进凋亡和抑制转移,并从分子水平揭示PGP具有调控多种相关蛋白的表达实现抗癌作用,但乳腺癌的发生发展是一个多基因参与、影响的复杂过程,其具体作用机制仍需进一步研究与探索。

