建立及超声评估血友病性关节炎动物模型
刘 昊,马 菲,张亚如,高 扬,易 梅,冯晓勤,孙 竞,李颖嘉*
(1.南方医科大学南方医院超声医学科,2.儿科,3.血液科,广东 广州 510515)
血友病是一种遗传性凝血因子缺乏性疾病,患者常出现自发性出血或创伤后出血不止,关节腔是最常见出血部位,关节腔长期反复出血会导致以慢性滑膜炎、软骨及骨质破坏为特征的血友病性关节炎(hemophilic arthritis, HA)。通过反复向兔膝关节腔内注射血液建立血液诱导型关节炎(blood-induced arthritis, BIA)模型可模拟血友病患者关节频繁出血,所致病理改变与HA类似,但随注射血液剂量和频率不同,成模效果有所差异[1-2]。此外,向兔膝关节腔内注射右旋糖酐铁,短期内也可引起含铁血黄素沉积、滑膜充血、水肿等类似HA病理表现。既往研究[1-2]多通过测定关节活动度及病理结果判断造模效果。本研究建立兔HA模型,以超声进行监测,观察不同方法的造模效果,并评价超声监测模型关节病变的价值。
1 资料与方法
1.1 实验动物分组及造模 将25只清洁级雄性健康3~4月龄新西兰大白兔(南方医科大学实验动物中心提供,体质量2 000~2 500 g)分为A、B组(各5只)及C组(15只),于肌内注射速眠新和阿托品混合液麻醉后造模。自兔耳中动脉抽取1 ml血液注射到兔膝关节腔内,A组每周3次,持续12周,共36次,B组每周2次,持续12周,共24次;C组:向兔膝关节腔内注射1 ml右旋糖酐铁注射液(铁含量50 mg/ml)后,根据造模时间分为C1组(诱导4周)、C2组(诱导8周)及C3组(诱导12周),每组各5只。
1.2 行为学观察 开始造模后,参考Lequesne MG行为学评分量表(LM评分,内容包括疼痛刺激反应、步态、膝关节屈伸角度及关节肿胀程度,总分11分)评估兔膝关节运动功能,总评分越高代表关节运动功能越差[3]。
1.3 超声检查 将动物麻醉后以平卧位保定于操作台上,使其膝关节伸直,备皮后在髌腱前方涂抹耦合剂并放置导声垫。以Toshiba Aplio500超声诊断仪、18L7高频线阵探头平行于髌腱长轴进行扫查,显示膝关节矢状切面,观察滑膜并测量其厚度;切换到彩色多普勒模式,按照Newman标准[4]选取血流信号最丰富切面进行半定量评分:0级,滑膜内未见明显彩色血流信号;1级,滑膜内见点状彩色血流信号;2级:滑膜内见条状彩色血流信号,血流充盈面积小于滑膜总面积的50%;3级,滑膜内见丰富条状彩色血流信号,血流充盈面积≥滑膜总面积的50%。参考Disler标准对软骨损伤进行超声评估[5]:0分,软骨表面光滑完整;1分,软骨表面不光滑,但无明显缺损;2分,软骨表面局部凹陷,无全层缺失;3分,软骨全层缺失。
1.4 病理检查 造模结束后处死动物,自髌上囊处切开膝关节腔,暴露滑膜组织,肉眼观察滑膜和软骨大体表现。完整剥除滑膜组织,固定、石蜡包埋后行HE染色,光镜下观察滑膜组织。截取股骨远端,固定、脱钙、脱水、石蜡包埋后行HE染色,观察潮线完整程度、软骨细胞数量及基质染色深浅。
1.5 统计学分析 采用SPSS 22.0统计分析软件。计量资料以±s表示,以t检验或t'检验比较组间关节运动评分及超声参数评分。P<0.05为差异有统计学意义。
2 结果
造模过程中A、B组各1只兔死亡,C组全部存活。造模期间各组LM评分均逐渐升高。造模结束时,C3组LM评分最高(8.80±0.75)(表1)。造模结束时,各组左侧膝关节均出现肿胀变形、活动度减退等类似HA关节功能障碍表现。
表1 各组HA模型兔Lequesne MG评分(±s)
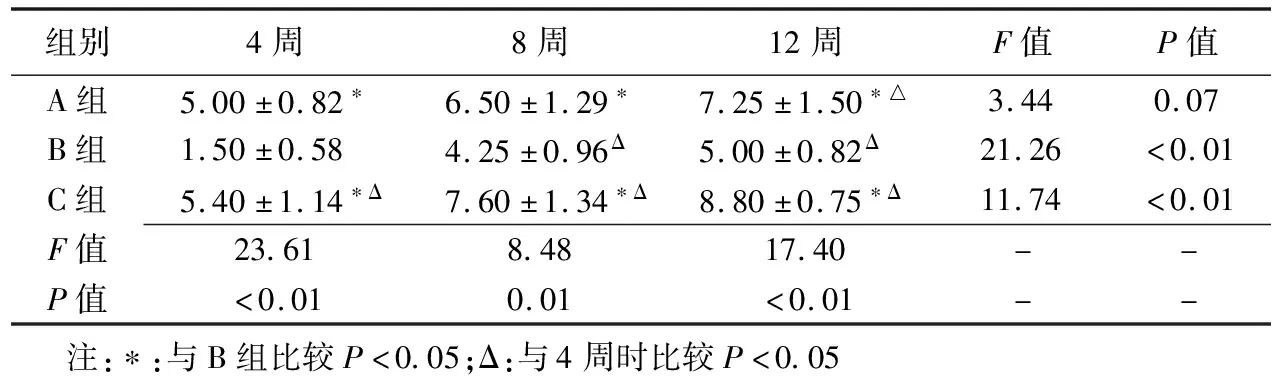
表1 各组HA模型兔Lequesne MG评分(±s)
组别4周8周12周F值P值A组5.00±0.82∗6.50±1.29∗7.25±1.50∗△3.440.07B组1.50±0.584.25±0.96Δ5.00±0.82Δ21.26<0.01C组5.40±1.14∗Δ7.60±1.34∗Δ8.80±0.75∗Δ11.74<0.01F值23.618.4817.40--P值<0.010.01<0.01-- 注:∗:与B组比较P<0.05;Δ:与4周时比较P<0.05
2.1 超声评估滑膜及软骨 造模结束时各组兔膝关节腔内均可探及滑膜增生,超声测得A组[(4.46±0.47)mm]及C组[(4.08±0.44)mm]滑膜厚度均大于B组[(2.43±0.39)mm](P均<0.05)。造模过程中,A组及B组滑膜厚度及血流信号分级逐渐增加(表2);C组造模初期滑膜厚度及血流信号逐渐增加,4周后(C1组)滑膜最厚、血流信号最丰富(图1),随造模时间延长,诱导8周(C2组)及12周时(C3组)滑膜厚度略微变薄,但差异均无统计学意义(P均>0.05)。见表2。造模结束时,超声显示A组及C组股骨远端软骨均出现损伤,B组造模过程中始终未见软骨及骨质破坏征象。
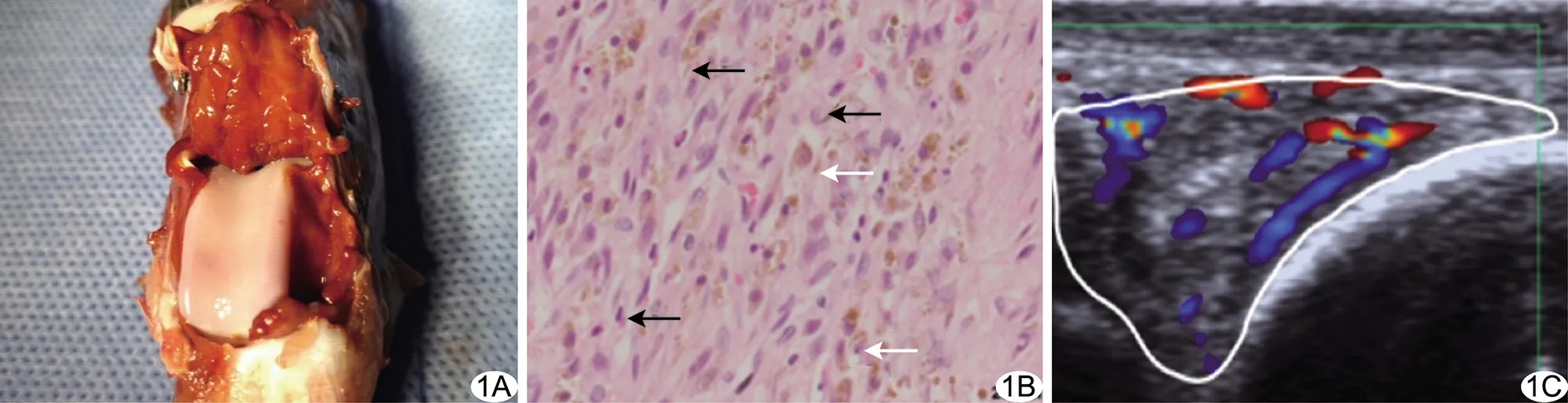
图1 C1组滑膜病理及超声表现 A.滑膜大体表现呈红褐色绒毛状;B.光镜下见滑膜组织内大量炎症细胞浸润(黑箭),含铁血黄素颗粒散布在滑膜中及巨噬细胞内(白箭);C.超声观察滑膜呈低回声,其内可见较丰富彩色血流信号(白圈内)
表2 各组HA模型兔滑膜厚度及血流信号分级(±s)

表2 各组HA模型兔滑膜厚度及血流信号分级(±s)
组别滑膜厚度(cm)4周8周12周F值P值滑膜CDFI分级4周8周12周F值P值A组3.01±0.49∗3.96±0.68∗△4.46±0.47∗△5.360.032.00±0.71∗2.50±0.502.75±0.431.400.29B组1.67±0.462.28±0.362.43±0.392.280.110.50±0.502.00±0.71△2.25±0.43△8.600.01C组4.42±0.63∗4.32±0.70∗4.08±0.44∗0.340.722.60±0.49∗1.00±0.89△0.60±0.49∗△10.50<0.01F值22.0910.5019.08--12.033.7821.49--P值<0.01<0.01<0.01--<0.010.06<0.01--
注:*:与B组比较,P<0.05;Δ:与4周时比较,P<0.05
2.2 滑膜及软骨病理改变 大体观察各组滑膜均呈红褐色;B组股骨远端软骨表面光滑,色泽苍白;A组、C1及C2组软骨色泽欠均匀,局部呈淡红色;C3组软骨呈淡红色,表面毛糙欠光滑,可见凹陷缺损(图2)。各组滑膜组织光镜下均表现为衬里层细胞重度增生、炎细胞浸润及含铁血黄素沉积;C2、C3组可见滑膜衬里下层胶原纤维增生。各组软骨组织光镜下均表现为局部细胞增多及基质染色缺失,以C2组及C3组为著。
图2 C3组模型软骨的病理及超声表现 A.软骨大体观察呈淡红色,毛糙欠光滑,可见凹陷缺损(箭);B.光镜下软骨基质着色减少,软骨内可见裂隙(箭);C.超声声像图显示关节软骨表面毛糙,局部可见凹陷缺损(箭)
3 讨论
本研究尝试采用3种方式建立兔HA模型,其中A、B组(BIA模型)向关节腔内反复注射血液,现似HA的临床表现和病理改变。既往文献[1-2]针对注射血液建立BIA模型的频率和剂量的报道不一,单次注射量为0.1~1.5 ml不等。相比微量出血及隐匿性出血,频繁大量出血更易刺激滑膜增生[6-7],造模时应尽可能模拟急性大量出血,即注射血液的量应以可充填整个关节腔为宜,注射频率从每周3次到每2周1次不等。本研究所用3~4月龄兔膝关节腔容积约1 ml,故注射血液剂量设定为1 ml。注射过于频繁会增加关节腔感染风险,频繁抽血也可能造成兔贫血,增加造模过程中动物死亡风险;而如果2次注射间隔太长,腔内积血被滑膜完全吸收,难以达到刺激滑膜增生的效果,故本研究采用每周3次(A组)及每周2次(B组)的注射频率,B组造模时超声未监测到关节腔内液性暗区,即前次注射血液已基本吸收,而A组尚能观测到少许积血存留。造模结束时A组滑膜更厚、血流信号更丰富,且具有软骨损伤征象,更类似于临床超声所见HA表现,且A组模型滑膜增生及软骨损伤病理改变更显著[8]。
既往研究[1-2]常根据关节活动度及病理检查评估HA模型关节病变。关节活动度只能间接反映关节病变。病理检查虽然是评估关节病变的“金标准”,但需要处死实验动物,无法动态监测病变进展。超声可显示关节腔积液、滑膜增生、软骨及骨质破坏等病变,已广泛用于评估关节炎及监测动物模型[9-10]。本研究中超声在3组模型中均能观察到滑膜增生及滑膜内血流信号。A组及B组滑膜厚度及血流信号随造模时间延长逐渐增加;C组铁剂诱导4周时(C1组)已出现典型HA病理改变,8周及12周时滑膜衬里下层胶原纤维增生、滑膜纤维化,超声表现为滑膜厚度减低,彩色血流信号逐渐消退,原因可能是C组仅注射1次右旋糖酐铁,随着时间延长,铁剂被逐渐清除,无法持续刺激滑膜增生及炎症反应。
关节腔出血后,滑膜衬里细胞及巨噬细胞可将积血清除,如果反复或持续出血,超过滑膜的清除能力,红细胞内的铁被巨噬细胞吞噬降解,最终以含铁血黄素形式沉积在滑膜中[6,11]。铁不仅能调控原癌基因c-myc及抑癌基因p53表达、促进滑膜细胞增殖,还可参与活性氧的生成过程,加重炎症反应,并可直接破坏软骨基质。既往研究[12-13]证实,铁沉积是血友病关节损伤的重要因素之一。本研究采用右旋糖酐铁建立HA动物模型,右旋糖酐铁可被滑膜内的巨噬细胞吞噬降解为含铁血黄素,向关节腔内注射右旋糖酐铁可模拟长期反复出血后的大量含铁血黄素沉积,刺激滑膜增生,造成软骨破坏等类似HA表现。与血液诱导型关节炎模型相比,铁剂诱导型关节炎模型仅需4周即可模拟HA特征性表现,造模周期短,操作简单,动物死亡风险更低,且诱导的关节炎病理改变更显著,便于超声监测及评估。
本实验通过血液诱导和铁剂诱导两种方法建立HA兔模型,其症状、影像学表现及病理改变能模拟HA特征性表现,后者造模更为快速、简便;超声可作为动态监测模型病变进展的较理想的影像学手段。

