葛根素激活Sirt1抑制炎症和纤维化减轻压力负荷诱导小鼠心肌肥厚的研究
王子宽,李菁华,李 炜,杨竞霄
心肌肥厚是心脏在遭受慢性机械或容量超负荷和神经体液因素激活等心血管疾病如高血压、心肌梗死和瓣膜功能障碍等做出的适应性反应,心肌负荷增大会引起心室壁代偿性肥厚以维持稳定的心输出量[1-4]。而这种病理性的心肌重塑常伴有心肌纤维化并会导致心脏功能障碍和心肌细胞凋亡,最终演变为心力衰竭[5-7]。因此,有效防治病理性心肌肥厚对于降低或延缓心力衰竭的发生、发展非常重要。然而,临床还未见能有效抑制心肌肥厚的药物,因此,探讨心肌肥厚的发生机制并寻找安全、可靠、有效的治疗药物成为临床和基础研究中亟待解决的问题。葛根素(puerarin, Pue)是传统中药葛根和粉葛的主要有效成分,是从豆科植物野葛、甘葛藤的干燥根中提取的黄酮苷[8-9],化学名为8-β-D葡萄吡喃糖-4',7-二羟基异黄酮。由于其具有明显的雌激素样作用,可在心血管疾病中发挥重要保护作用[10-13]。然而,Pue发挥心血管保护作用机制不清楚,且受限于临床试验的设计和样本量偏少的局限性,成为其在心血管疾病临床治疗中面临的巨大挑战。有研究表明,Pue在心肌肥厚中发挥保护作用,但是否能通过抑制炎症反应和心肌纤维化减轻压力负荷诱导的心肌肥厚还不清楚。本实验采用C57/bl小鼠胸主动脉弓缩窄术(TAC)制备心肌肥厚模型,探讨Pue在压力负荷诱导的心肌肥厚中的保护作用和机制。
1 材料与方法
1.1实验动物与试剂 于空军军医大学实验动物中心购买48只8周龄成年雄性C57/bl小鼠;Pue和EX527购于美国Sigma公司;RNA提取试剂盒和反转录试剂盒购于天根生化科技(北京)有限公司;肿瘤坏死因子-α(TNF-α)和白介素-1β(IL-1β)含量检测试剂盒购于南京建成生物公司;Collagen Ⅰ、α-SMA、沉默信息转录调节因子1(Sirt1)和Ac-FOXO1抗体购自Cell Siginal Technology公司,β-actin、辣根过氧化物酶标记的山羊抗鼠和山羊抗兔二抗购自北京中杉金桥生物技术有限公司。
1.2实验分组及心肌肥厚模型的制备 48只小鼠随机分成假手术组(Sham组)、TAC组、Pue干预TAC组(Pue+TAC组)、Pue联合EX527干预TAC组(Pue+EX527+TAC组),每组12只。根据文献[14]方法,采用常规的TAC制备心肌肥厚模型,用异氟烷将雄性C57/bl小鼠麻醉,将小鼠固定于操作台上,行气管插管并连接呼吸机,由第二肋间行开胸术,钝性分离胸腺和脂肪组织,暴露主动脉弓并游离,在左侧颈总动脉和无名动脉之间垫27G针并用7-0丝线结扎主动脉弓,然后取下针头,形成缩窄区,手术结束后,逐层关胸缝皮。Sham组小鼠手术操作与模型组相同,但不结扎主动脉弓。
1.3干预方法 Pue+TAC组术后给予65 mg/kg Pue饮用,Pue+EX527+TAC组在Pue+TAC组基础上给予腹腔注射2 mg/kg EX527,持续4周。Sham组和TAC组术后正常饮水,同时腹腔注射相同体积的生理盐水,持续4周。
1.4观察指标
1.4.1超声检测心脏功能:术后4周,用脱毛膏去除小鼠胸前被毛,用VEVO 770小动物超声仪检测左心室射血分数(left ventricular ejection fraction, LVEF)与左心室短轴缩短率(left ventricular fractional shortening, LVFS)。
1.4.2血清中TNF-α和IL-1β含量测定:术后4周,根据南京建成生物公司提供的ELISA试剂盒说明书采用酶标仪检测4组小鼠血清中TNF-α和IL-1β的含量,并按照说明书中的方法将测量的TNF-α或IL-1β吸光值转换为含量来表示。
1.4.3实时荧光定量PCR检测钠尿肽(ANP)、脑钠肽(BNP)和β-肌球蛋白重链(β-MHC)mRNA水平:按照RNA提取试剂盒操作方法提取4组心脏组织总RNA,分光光度仪定量RNA浓度,并反转录成cDNA;配制20 μl总体积的PCR反应体系,其成分包括:cDNA 2 μl、超纯水7.4 μl、引物0.8 μl和SYBR Green Mix 9 μl。扩增反应按照:95℃预变性10 min,95℃变性10 s,60℃退火15 s,72℃延伸10 s,共40个循环。计算Ct值、2-ΔΔCt值。以GAPDH作为内参,引物序列见表1。
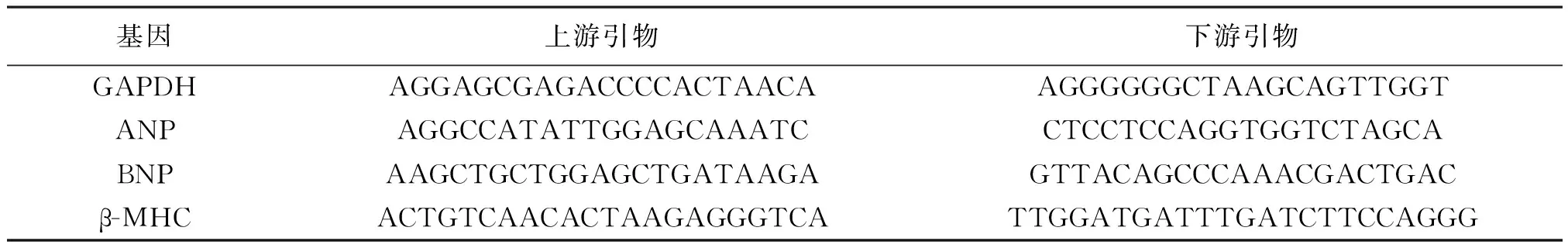
表1 ANP、BNP、β-MHC实时荧光定量PCR扩增引物序列
1.4.4心肌肥厚程度检测:心脏功能检测结束后,称重并记录每只小鼠体质量(body weight, BW),然后将小鼠过量麻醉处死,快速取下心脏并称重(heart weight, HW),计算心脏质量/体质量比值(HW/BW),评估心肌肥厚程度。
1.4.5HE染色和Masson三色染色:用4%多聚甲醛将4组心脏固定,行常规脱水和石蜡包埋,并切成3 μm的切片。分别按照常规HE染色和Masson三色染色的方法操作,染好后用中性树脂封片。
1.4.6Western blot测定蛋白表达情况:用RIPA裂解液提取组织蛋白,采用BCA法测定各组蛋白浓度,蛋白样品用沸水浴煮10 min;配制10%或12% SDS-PAGE分离胶,控制每孔蛋白样品上样量为35 μg,恒压80 V在电泳缓冲液中电泳,恒流240 mA转膜120 min,将目的蛋白转移至PVDF膜上。用5%脱脂奶粉室温封闭2 h,将脱脂奶粉洗去,然后将目的条带切下分别放入Collage I、α-SMA、Sirt1、Ac-FOXO1(1∶1000)和β-actin(1∶5000)抗体管中4℃静置过夜;第2天,TBST洗膜,3次,每次10 min,用辣根过氧化物酶标记的山羊抗兔和山羊抗鼠二抗(1∶5000)室温摇床孵育2 h,TBST洗膜,3次,每次10 min,ECL显色,用Image J图像分析软件进行灰度值分析,以β-actin作为内参。
2 结果
2.1小鼠存活情况 Sham组小鼠全部存活,行TAC的小鼠术后有2只死亡。
2.2心肌肥厚程度比较 与Sham组比较,术后4周,TAC组HW/BW均显著增加,心肌细胞横截面积明显增大(P<0.01);与TAC组比较,Pue+TAC组HW/BW明显降低,心肌细胞横截面积明显减小(P<0.01);而与Pue+TAC组比较,Pue+EX527+TAC组HW/BW显著增加,心肌细胞横截面积明显增大(P<0.01)。见图1、2。
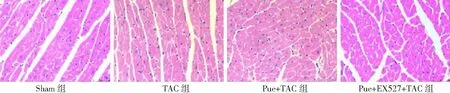
图1 4组小鼠术后4周心肌组织病理学表现(HE×400)Sham组为假手术组,TAC为主动脉弓缩窄术,Pue为葛根素

图2 4组小鼠术后4周心脏心肌肥厚程度比较Sham组为假手术组,TAC为主动脉弓缩窄术,Pue为葛根素;与Sham组比较,bP<0.01;与TAC组比较,dP<0.01;与Pue+TAC组比较,fP<0.01
2.3心脏纤维化比较 与Sham组比较,术后4周,TAC组心肌组织胶原纤维含量、Collagen Ⅰ和α-SMA蛋白表达水平显著增加(P<0.01);与TAC组比较,Pue+TAC组胶原纤维含量、Collagen Ⅰ和α-SMA蛋白表达水平显著降低(P<0.01);与Pue+TAC组比较,Pue+EX527+TAC组胶原纤维含量、Collagen Ⅰ和α-SMA蛋白表达水平明显增加(P<0.01)。见图3、4。

图3 4组小鼠术后4周心脏纤维化病理学表现(Masson×400)Sham组为假手术组,TAC为主动脉弓缩窄术,Pue为葛根素
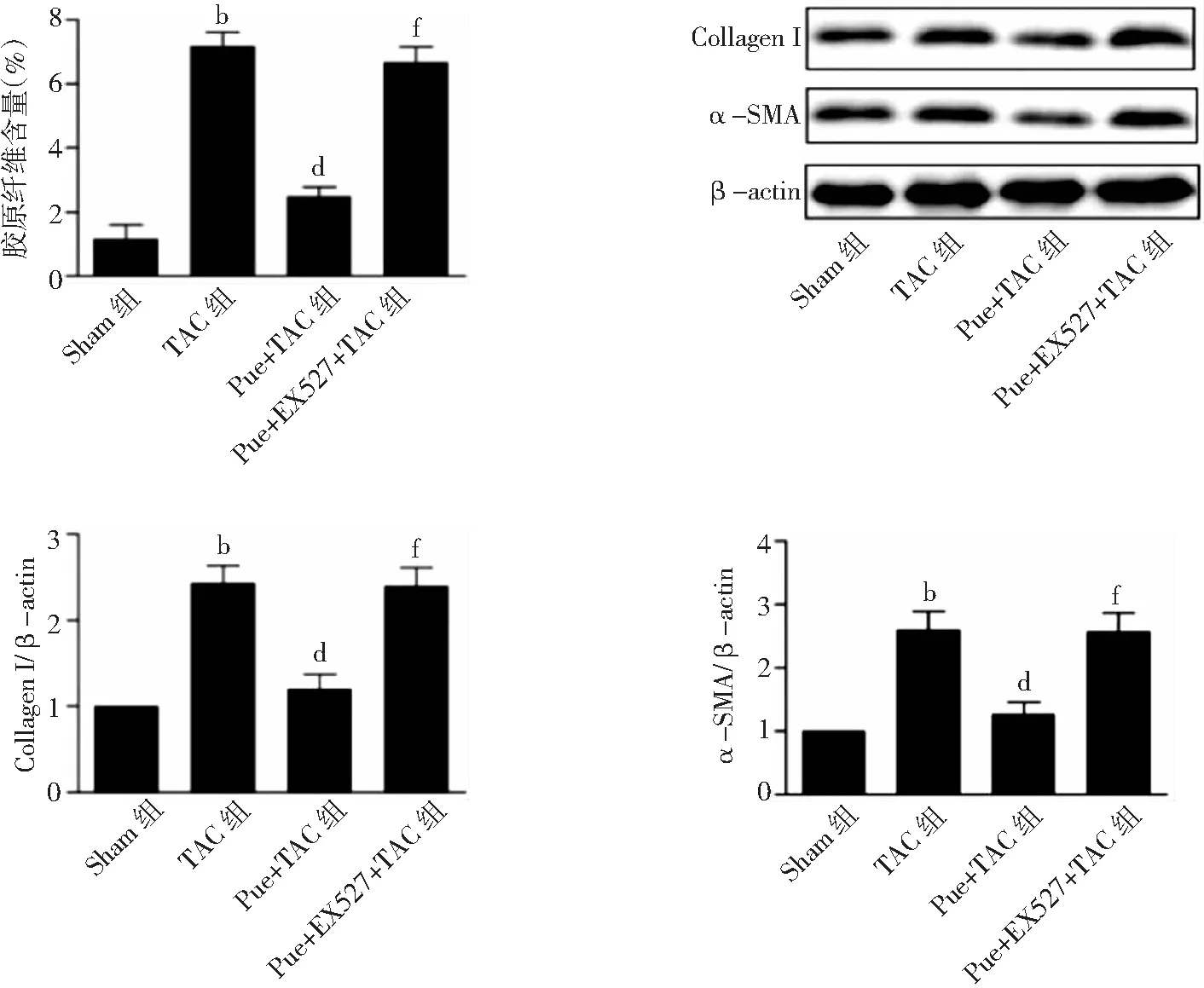
图4 4组小鼠术后4周心肌组织胶原纤维含量、Collagen Ⅰ和α-SMA蛋白表达水平Sham组为假手术组,TAC为主动脉弓缩窄术,Pue为葛根素;与Sham组比较,bP<0.01;与TAC组比较,dP<0.01;与Pue+TAC组比较,fP<0.01
2.4心脏功能比较 与Sham组比较,术后4周,TAC组LVEF和LVFS均明显降低(P<0.01);与TAC组比较,Pue+TAC组LVEF和LVFS显著增加(P<0.01);而与Pue+TAC组比较,Pue+EX527+TAC组LVEF和LVFS显著降低(P<0.01)。见图5。
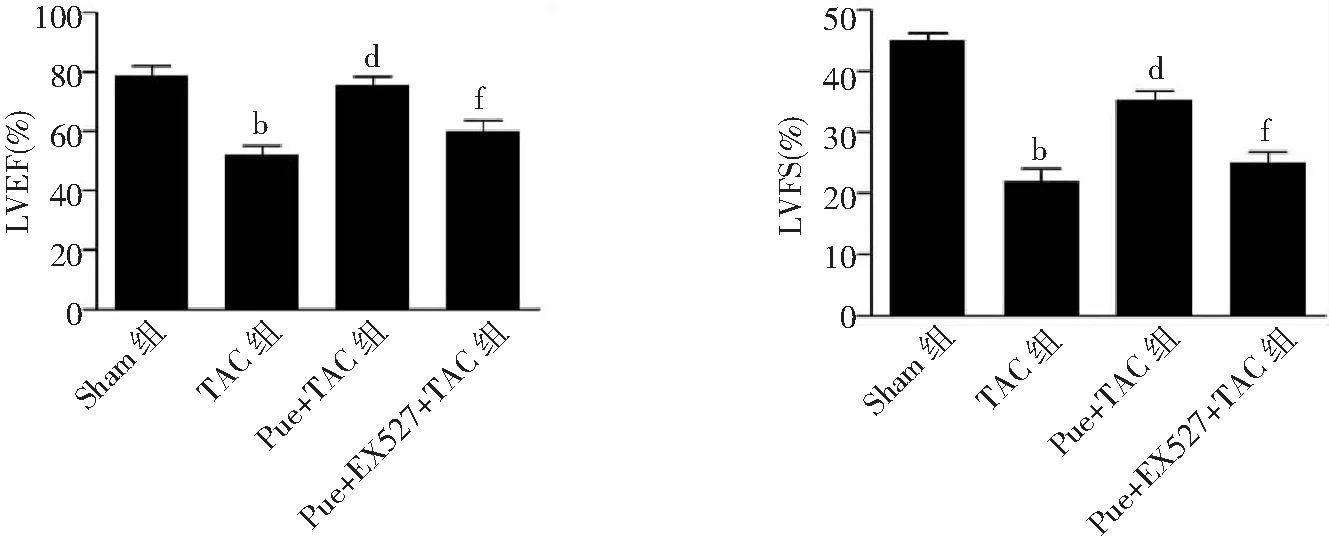
图5 4组小鼠术后4周心脏LVEF和LVFS值比较Sham组为假手术组,TAC为主动脉弓缩窄术,Pue为葛根素,LVEF为左心室射血分数,LVFS为左心室短轴缩短率;与Sham组比较,bP<0.01;与TAC组比较,dP<0.01;与Pue+TAC组比较,fP<0.01
2.5心肌肥厚相关基因表达情况 与Sham组比较,术后4周,TAC组ANP、BNP和β-MHC mRNA水平均明显增加(P<0.01);与TAC组比较,Pue+TAC组ANP、BNP和β-MHC mRNA水平显著降低(P<0.01);而与Pue+TAC组比较,Pue+EX527+TAC组ANP、BNP和β-MHC mRNA水平均明显增加(P<0.01)。见图6。
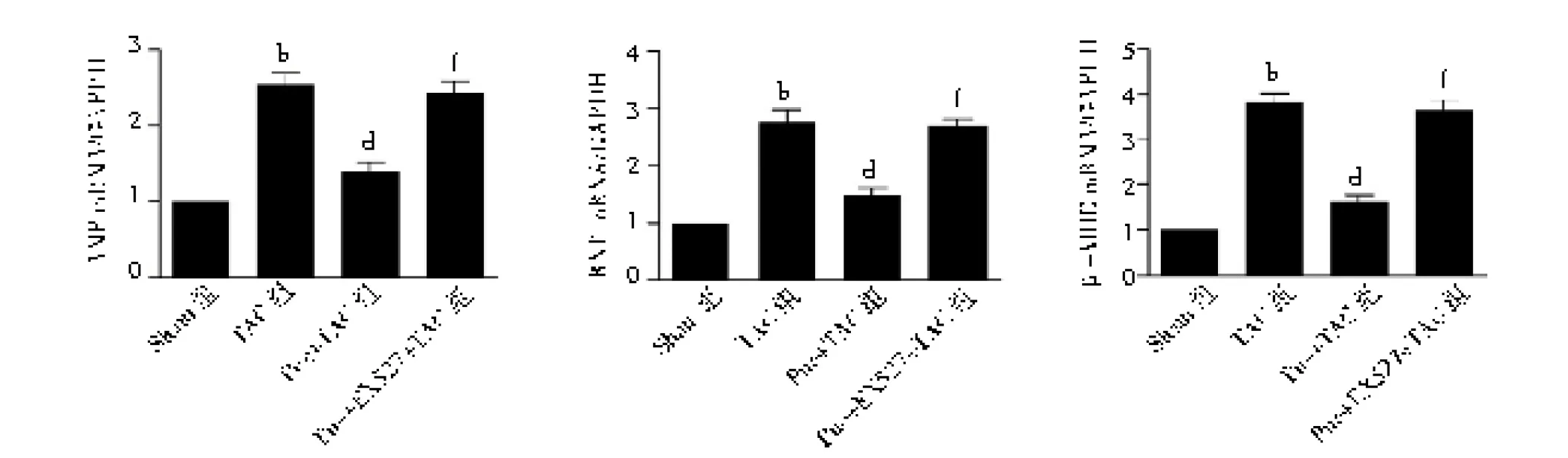
图6 4组小鼠术后4周心脏肥厚相关基因表达情况Sham组为假手术组,TAC为主动脉弓缩窄术,Pue为葛根素,ANP为钠尿肽,BNP为脑钠肽,β-MHC为β-肌球蛋白重链;与Sham组比较,bP<0.01;与TAC组比较,dP<0.01;与Pue+TAC组比较,fP<0.01
2.6血清中TNF-α和IL-1β含量比较 与Sham组比较,术后4周,TAC组血清中TNF-α和IL-1β含量显著增加(P<0.01);与TAC组比较,Pue+TAC组血清中TNF-α和IL-1β含量明显降低(P<0.01);而与Pue+TAC组比较,Pue+EX527+TAC组血清中TNF-α和IL-1β含量显著增加(P<0.01)。见图7。
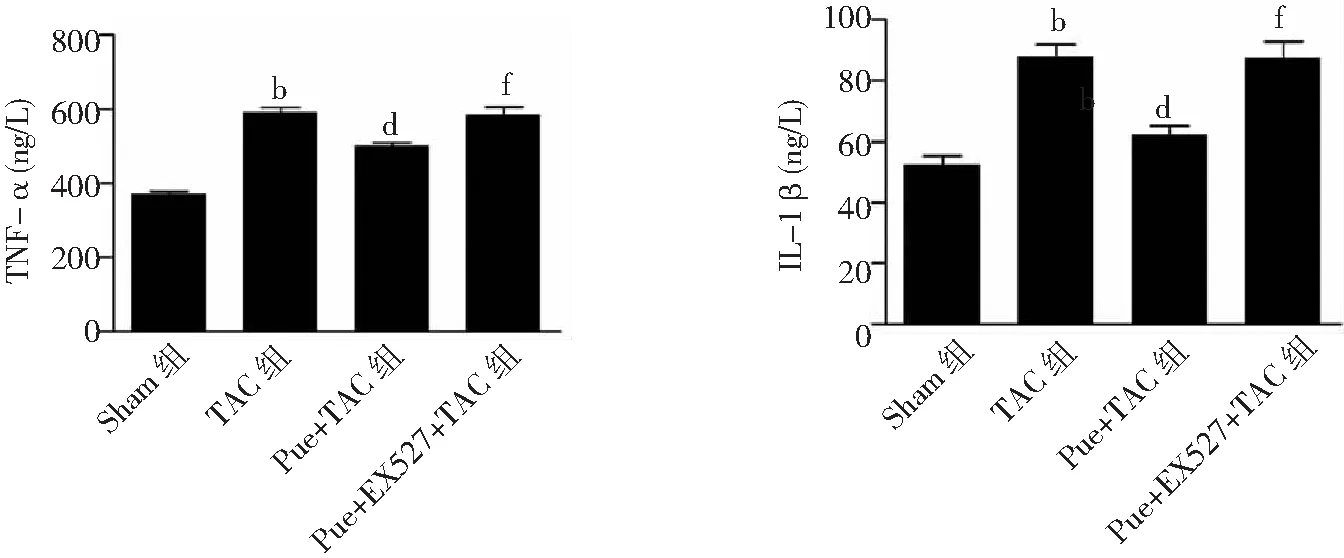
图7 4组小鼠血清中TNF-α和IL-1β含量比较Sham组为假手术组,TAC为主动脉弓缩窄术,Pue为葛根素,TNF-α为肿瘤坏死因子-α,IL-1β为白介素-1β;与Sham组比较,bP<0.01;与TAC组比较,dP<0.01;与Pue+TAC组比较,fP<0.01
2.7心脏Sirt1信号的变化 与Sham组比较,TAC组Sirt1蛋白表达量明显降低,Ac-FOXO1的蛋白表达量显著增加(P<0.01);与TAC组比较,Pue+TAC组Sirt1蛋白表达量增加,Ac-FOXO1的蛋白表达量降低(P<0.01);与Pue+TAC组比较,Pue+EX527+TAC组Sirt1蛋白表达量明显降低,Ac-FOXO1的蛋白表达量显著增加(P<0.01)。见图8。
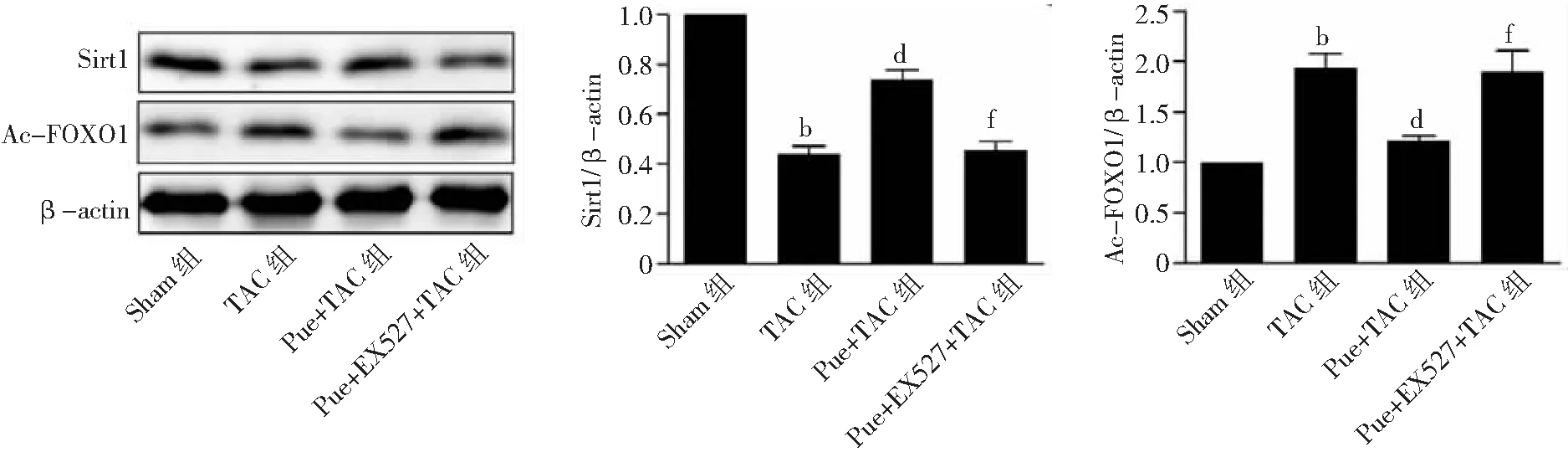
图8 4组小鼠心脏Sirt1信号变化情况Sham组为假手术组,TAC为主动脉弓缩窄术,Pue为葛根素,Sirt1为沉默信息转录调节因子1;与Sham组比较,bP<0.01;与TAC组比较,dP<0.01;与Pue+TAC组比较,fP<0.01
3 讨论
心肌肥厚是心肌缺血、心律失常和心源性猝死的独立危险因素,参与多种心血管疾病的病理进程[15]。除了少部分基因突变或生长因子异常因素外,心肌肥厚主要是由于心肌长时间负荷过重,导致心室壁增厚,心肌收缩力增强,以维持心脏的正常收缩功能所形成的一种代偿性反应。长期慢性刺激所导致的病理性肥厚在失代偿期会出现心脏收缩功能障碍、心室扩张,最后演变为心力衰竭。目前,临床常用治疗心力衰竭的药物有钙离子通道阻滞剂、血管紧张素Ⅱ受体拮抗剂和血管紧张素转换酶抑制剂(ACEI)[16],然而,这三种药物在减轻心肌肥厚的同时会产生较大的不良反应,限制了其临床应用。
Pue作为传统中药成分,具有雌激素样作用,在抗心肌缺血、抗炎、抗氧化、抗动脉粥样硬化等方面均具有较好的治疗效果,已被广泛用于治疗心血管疾病、肝脏疾病和糖尿病等,其作用机制与抗细胞凋亡和抗氧化应激有关[17-18]。然而Pue在压力导致的心肌肥厚中的作用及其机制还不十分清楚。众所周知,心肌肥厚时会出现心肌细胞肥大,肥厚相关基因表达的增加,并伴有心脏功能降低。本研究发现,与Sham组比较,TAC组HW/BW、心肌细胞横截面积、Collagen Ⅰ和α-SMA蛋白表达均明显增加,并出现ANP、BNP和β-MHC mRNA水平的增加,而心脏功能明显降低;Pue处理后可明显减小HW/BW和心肌细胞横截面积,降低Collagen Ⅰ和α-SMA蛋白表达,改善心脏功能,同时,明显降低TAC导致的ANP、BNP和β-MHC mRNA水平的增加。值得注意的是,EX527能够阻断Pue减小HW/BW和心肌细胞横截面积、Collagen Ⅰ和α-SMA蛋白表达以及改善心脏功能的作用,也能明显增加ANP、BNP和β-MHC mRNA水平。提示Pue可减轻TAC诱发的心肌肥厚,而EX527能够阻断这一作用。因此,有必要进一步阐明Pue减轻TAC诱发心肌肥厚的机制以及EX527在其中的作用。
Sirt1是一类高度保守的烟酰胺腺嘌呤二核苷酸(NAD+)依赖性去乙酰化酶,可通过使底物FOXO1去乙酰化调节不同转录因子的活性[19]。Sirt1参与细胞内多种生理及病理过程,并在多种心血管疾病中发挥重要作用。研究表明,Sirt1信号可参与调控细胞凋亡、增殖、炎症、氧化应激、线粒体功能等过程,在多种疾病模型的预防和治疗中发挥作用[20-21]。EX527是Sirt1的选择性抑制剂,在基础研究中常被用来阻断Sirt1分子的作用以探讨Sirt1的作用。本研究发现,与Sham组比较,TAC组心肌纤维化程度、TNF-α和IL-1β含量增加,而Pue处理后,可明显降低心肌纤维化和炎性因子水平;EX527能够阻断Pue降低TAC引起的心肌纤维化程度和炎症反应的作用,提示EX527能够阻断Pue对心肌肥厚的保护作用。本研究结果还显示,与Sham组比较,TAC组Sirt1蛋白水平降低而其底物FOXO1乙酰化水平明显增加,用EX527干预后能够抑制Pue引起的Sirt1蛋白水平的上调和其底物FOXO1乙酰化水平的降低,提示EX527具有阻断心肌肥厚中Pue激活Sirt1,降低FOXO1乙酰化水平的作用,这也证实在TAC诱导的心肌肥厚中,Pue通过激活Sirt1/FOXO1信号通路降低心肌纤维化和炎症反应而发挥保护作用。
综上所述,本研究证实了Pue具有减轻压力负荷导致的心肌肥厚的作用,并阐明其机制是通过增加Sirt1活性,降低FOXO1乙酰化水平,减轻心肌纤维化和炎症反应,改善心脏功能发挥保护作用。本实验结果进一步完善和阐明了Pue在压力负荷诱导的心肌肥厚中的保护作用及机制,并为临床应用Pue防治心肌肥厚提供了新的实验依据和理论支持。

