恶性胸膜间皮瘤中EFEMP1基因mRNA的表达及其临床病理学意义
杨娜,李彬,李素芬,王唯斯,自加吉,熊伟,2
1.大理大学 基础医学院 a.生物化学与分子生物学教研室;b.病理学教研室;云南 大理 671000;
2.云南省高校临床生物化学检验重点实验室,云南 大理 671000
恶性胸膜间皮瘤(malignant pleural mesothelioma,MPM)是一种来源于胸膜间皮细胞的原发肿瘤,占胸膜肿瘤的5%,临床少见[1]。胸膜间皮瘤可发生于脏层胸膜和壁层胸膜的任何部分,80%发生于脏层胸膜,20%发生于壁层胸膜;可发生于任何年龄,常见于40~60岁[1]。胸膜间皮瘤是由环境、生物和遗传因素引起的肿瘤。石棉已被国际癌症研究中心(IARC)确定为致癌物[2],在美国和西方国家石棉被认为是导致恶性间皮瘤的主要原因。在不同国家,MPM的发病率差异较大,国外以澳大利亚最高,发病率约为3.54/10万,国内每年发病率为0.3/10万~0.5/10万,以云南省最高,约为8.5/10万~17.75/10万[3-4]。目前对该病的诊断及治疗较棘手,早期诊断可以提高MPM患者的生存率,一些用于早期诊断的分子标志物如间皮素(mesothelin),癌胚抗原(CEA),糖类抗原CA125、CA153、CA199和细胞表明标志物CD90等的敏感性和特异性均有限[5]。目前,MPM的诊断金标准仍为胸腔镜活检,缺乏较为便捷有效且低痛苦的诊断方法,发掘新的MPM诊断方法能够为患者的早期诊断和治疗提供依据。
人表皮生长因子含纤蛋白样胞外基质蛋白1(epidermal growth factor containing fibulin like extracellular matrix protein 1,EFEMP1)基因定位于染色体2p16.1,含有12个外显子,编码产物为纤蛋白3(fibulin 3)[6]。纤蛋白家族共7个成员,纤蛋白3含有493个氨基酸残基,在不同物种中高度保守,在人类、大鼠和小鼠中92%~94%的氨基酸序列同源。纤蛋白3是一种细胞外糖蛋白,广泛分布于发育中的组织与成熟组织中,在生理条件下通常以单体形式存在。研究发现,纤蛋白3在MPM患者的血浆和胸水中水平显著升高,且敏感性和特异性较高[7-8]。目前,EFEMP1基因表达与MPM发生发展的关系尚不明确。因此,本研究旨在阐明EFEMP1基因mRNA在MPM组织中的表达情况,并进一步探讨其与临床病理参数及患者预后的相关性。
1 材料与方法
1.1 利用Oncomine数据库分析EFEMP1基因mRNA在MPM组织与非肿瘤组织中的表达
Oncomine数据库是目前最大的肿瘤基因芯片整合平台和分析平台,可用于对目标基因的筛选及该基因在不同组织中的表达分析。本研究在Oncomine数据库中设置条件为:①“Gene:EFEMP1”;②“Analysis Type:Cancer vs.Normal Analysis”;③“Cancer Type:Other Cancer-Mesothelioma-Pleural Malignant Mesothelioma”;④“Simple Type:Clinical Specimen”。对纤蛋白3在MPM组织与非肿瘤组织中的表达差异进行分析。
1.2 下载TCGA数据库中MPM数据集的病理资料与患者预后资料
使用R3.6.3软件,利用Epicalc函数包,从美国公共癌症基因数据库(The Cancer Genome Atlas,TCGA)(http://tcga-adtaa.nci.nih.gov/tcga/)中 下载并预处理MPM数据集中EFEMP1基因mRNA表达量的数据集,同时下载MPM患者的临床病理参数和预后资料,将2个数据集根据对应的TCGA病例编号进行合并。
1.3 对TCGA数据库中MPM数据集进行筛选及病理相关性分析
通过R3.6.3下载合并得到的数据集meso_tcga中包含87例MPM病例样本。通过对临床数据进行筛选比对,删除缺失数据及无效数据,仅保留完整有效的数据82例。根据RNA测序结果分析,MPM样本中EFEMP1基因表达量为1646.753~115 390.589,中位表达量为28 250.071。以中位表达量为截断值,样本中EFEMP1表达量高于中位数的定义为高表达(high),反之为低表达(low),2组均为41例。
1.4 MPM组织的病理学分型
TCGA数据库中MPM数据集将MPM组织的病理学分型分为3种,即肉瘤样型(Sarcomatoid Type)、上皮样型(Epithelioid Type)和双向混合型(Biphasic Type),依次分别包括2例、57例、23例。
1.5 EFEMP1基因mRNA表达水平对MPM患者预后的影响
采用基因表达谱动态分析(Gene Expression Profiling Interactive Analysis,GEPIA)(http://gepia.cancer-pku.cn)数据库对数据构建Kaplan-Meier模型,探究EFEMP1基因mRNA表达水平与MPM患者预后之间的关系。
1.6 EFEMP1基因mRNA表达水平与其他基因表达的相关性分析
cBioportal(http://www.cbioportal.org/)是基于公共数据库研究分析癌症基因数据的可视化工具,通过自定义数据探求基因改变和临床之间的联系,并使其可视化。选择MPM组织和EFEMP1基因,可得出MPM中EFEMP1基因与其他基因表达的相关性可视化分析图。
1.7 统计学分析
建立MPM患者的临床病理数据集,将患者年龄、性别、AJCC病理分期、T分期、M分期、N分期、病理类型、组织学诊断和EFEMP1基因mRNA表达量进行量化赋值。采用R3.6.3和Graphpad Prism 8.0进行统计学分析及绘图,使用Shapiro-Wilk方法检测MPM组织中EFEMP1基因mRNA表达量的正态分布情况,结果显示EFEMP1基因mRNA表达量不符合正态分布(P<0.05)。因此,MPM组织的EFEMP1基因mRNA表达量比较采用Mann-Whitney U非参数检验。组间比较采用χ2检验及Fisher精确概率法进行临床病理参数相关性分析。患者预后分析采用Kaplan-Meier法绘制生存曲线并进行Logrank检验。采用Pearson或Spearman法进行基因表达的相关性分析。P<0.05为差异有统计学意义,P<0.01为差异极显著。
2 结果
2.1 EFEMP1基因mRNA在MPM组织中的表达量显著高于正常组织
对Oncomine基因芯片数据库数据筛选分析,所得结果显示在正常组织以及有关MPM的共54个样本中,与正常肺组织和正常胸膜组织相比,EFEMP1基因在MPM组织中的表达量显著升高,且组间差异极显著(P<0.01),结果如图1。
2.2 MPM组织中EFEMP1基因mRNA表达量与临床病理参数的相关性
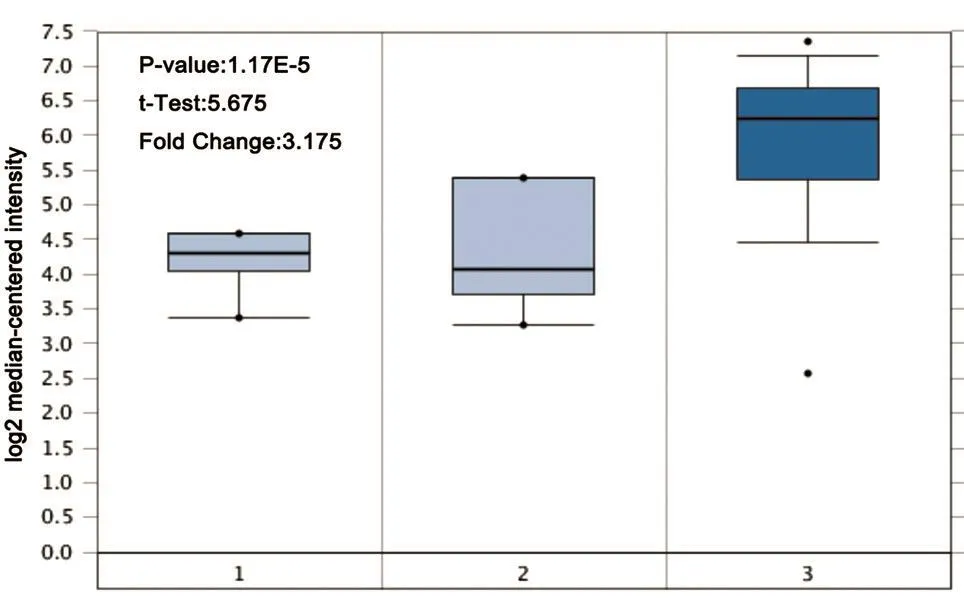
图1 正常组织与MPM组织中EFEMP1基因mRNA表达量差异
从TCGA数据库下载并整理得到临床病理参数完整的82例MPM病例资料,其中女性16例、男性66例,年龄28.0~81.0岁,中位年龄64.0岁。对该数据集中MPM患者预后的各影响因素进行赋值,通过统计学分析得知MPM组织中EFEMP1基因mRNA低表达41例、高表达41例。结果表明,EFEMP1基因mRNA表达量与MPM患者的T分期(P=0.046)、病理类型(P=0.031)及组织学诊断类型(P=0.031)存在显著相关性,而与患者的年龄、性别、N分期、M分期、AJCC病理分期均无显著相关性(均P>0.05)。结果见表1。
2.3 EFEMP1基因mRNA表达量与MPM患者的预后无显著相关性
用GEPIA数据库构建Kaplan-Meier生存曲线并进行Logrank法检验,结果表明EFEMP1基因的表达对MPM患者的总生存率(overall survive,OS)及无疾病进展生存率(disease free survive,DFS)均无显著影响(LogrankP>0.05)。结果如图2。
2.4 MPM组织中EFEMP1基因与其他基因mRNA表达量的相关性
通过cBioportal工具对MPM组织中EFEMP1基因表达相关性进行可视化分析。选取在MPM组织中EFEMP1基因表达相关性最高的9个基因,分别为UDP-葡萄糖焦磷酸化酶2(UDP-glucosepyrophosphorylase2,UGP2)、转 录 因 子 4(transcription factor 4,TCF4)、活化的T细胞核因子 4(nuclear factor of activated T cells 4,NFATC4)、RAS 相 关 基 因 2(rasrelated 2,RRAS2)、膜联蛋白 A3(annexin A3,ANXA3)、柔滑素(smoothelin,SMTN)、尿蛋白 1B(uroplakin 1B,UPK1B)、醇脱氢酶 6(alcohol dehydrogenase 6,ADH6)和DNA损伤识别和修复因子XPC复合体(XPC complex subunit,XPC)基因。其中,UGP2、RRAS2、ANXA3、UPK1B、ADH6、XPC与EFEMP1基因表达量呈显著正相关(P<0.05),TCF4、NFATC4、SMTN与EFEMP1基因表达量呈显著负相关(P<0.05)。结果见图3。
3 讨论

表1 EFEMP1基因mRNA表达量与MPM患者临床病理特征的相关性

图2 EFEMP1基因mRNA表达量与总生存率的关系
MPM是一种罕见的胸腔恶性肿瘤,起源于胸膜腔的间皮细胞[9]。MPM总体预后较差,上皮型MPM预后相对较好,肉瘤型预后最差,未经治疗的MPM中位生存期为12个月,6个月、1年和5年的生存率分别为55%、33%和5%[10]。MPM是一种致死性极强的肿瘤,其恶性程度高,潜伏期长,早期临床表现无特异性,多数患者被发现时已是晚期[11]。MPM在早发现、早诊断和早治疗等环节的检查技术薄弱,缺乏特异性诊断和预后的肿瘤生物学标记物。纤蛋白3可以单独表现出与组织特异性表达有关的抑癌或致癌行为[12-13]。研究显示,纤蛋白3在MPM患者中的表达水平普遍升高,且纤蛋白3不仅在肿瘤组织中过表达,在胸腔积液和血浆中也有较高水平的表达[14]。由此提出,纤蛋白3可能在MPM中起致癌作用。对MPM细胞系的体外研究及体内移植瘤研究进一步表明MPM细胞表达和分泌纤蛋白3,并且是患者血浆样本中纤蛋白3的来源。在生理情况下,纤蛋白3以单体形式存在,在正常组织中低表达,而在内皮细胞和上皮细胞的基膜中高表达,可介导细胞与细胞、细胞与间质之间的信号传导[15]。近年来许多实验也证明,纤蛋白3可正向调控多种肿瘤细胞的生长及分化增殖,并参与肿瘤细胞抗凋亡作用[16-18]。关于纤蛋白3在各种类型肿瘤中的研究,特别是在MPM中的表达及意义也越来越受到人们的关注。
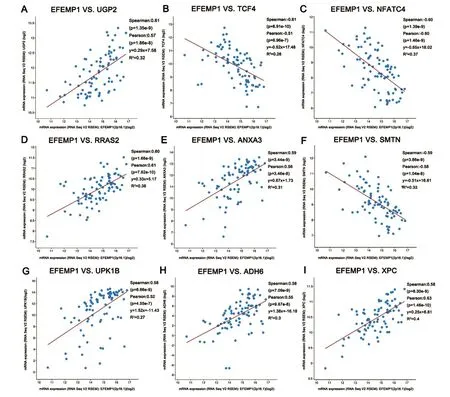
图3 MPM组织中EFEMP1基因与其他基因mRNA表达量的相关性
在本研究中,我们首先通过数据挖掘分析了EFEMP1基因mRNA的表达与MPM发生之间的相关性,发现EFEMP1基因在正常肺组织或正常胸膜组织中均低表达,在MPM组织中显著高表达,并且EFEMP1基因mRNA的表达量与肿瘤的T分期、病理类型及组织学诊断类型有显著相关性。莫世贤采用随机效应模型,发现试验组(MPM组)患者血液及胸腔积液的纤蛋白3水平高于对照组(非MPM组)[19]。因此,纤蛋白3对于诊断MPM具有较高程度的敏感性和特异性,可作为MPM临床早期诊断的辅助方法。为了比较纤蛋白3与间皮素作为MPM相关生物标志物的价值,Creaney等采用ELISA测定了153例胸腔积液患者血浆和胸水中的纤蛋白3及间皮素水平,发现间皮素在诊断MPM方面优于纤蛋白3,而在判断患者预后方面则是纤蛋白3更优[20]。然而,本研究的预后生存分析结果显示,EFEMP1基因mRNA表达量与MPM患者的总体生存率和无疾病进展生存率之间并无显著关联。基因表达相关性分析表明,UGP2、RRAS2、ANXA3、UPK1B、ADH6、XPC与EFEMP1基因表达量呈显著正相关,TCF4、NFATC4、SMTN与EFEMP1基因表达量呈显著负相关,提示EFEMP1基因在MPM发生过程中可能需要与其他基因相互协同才能发挥作用。
MPM发病机制复杂,临床病例较为少见。本研究使用TCGA中MPM数据集的病例数据及预后资料,临床数据样本量更大,所得结果的可信度较高。综上研究表明,EFEMP1基因mRNA在MPM组织中过表达,它可以作为该疾病诊断的潜在生物标志物,这可为MPM的临床诊疗提供一定的参考。

