反向PCR法构建TRAF6蛋白截短体质粒
周晨辰,陆琤,何园,查玉华,张硌
解放军总医院 第五医学中心南院区医学工程科,北京 100071
肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor associated factor 6,TRAF6)属于肿瘤坏死因子受体相关因子(TRAFs)家族,是一个重要的细胞内多功能泛素连接酶[1-4]。TRAF6蛋白结构主要分为C端和N端。N端含有1个保守的RING环指结构域和5个锌指结构域,其中RING环指结构域及第1个锌指结构域是TRAF6蛋白的主要功能区域,行使其作为E3泛素连接酶的主要功能。TRAF6的C端结构域呈三聚蘑菇头状结构,含有卷曲螺管样结构域(茎)和TRAF-C(头)两部分[5-6]。
作为一种重要的细胞内多功能信号分子,TRAF6交织于一系列信号传导网络中,从而影响细胞的生存、增殖、分化和死亡[7-10]。为进一步探讨TRAF6在细胞功能调控中发挥的作用,我们利用反向PCR技术[11]构建了TRAF6截短体TRAF6 N和TRAF6 C的表达质粒,为TRAF6分子的后续研究奠定了一定的基础。
1 材料和方法
1.1 材料
293FT细胞、真核质粒pCMV-Myc-TRAF6和pCMV-Myc-X为本实验室保存;感受态大肠杆菌DH5α、质粒提取试剂盒及DNA电泳凝胶回收试剂盒购自天根生化科技(北京)有限公司;KODPlus-Mutagenesis试剂盒购自TOYOBO公司;脂质体LipofectAMINE 2000购自Invitrogen公司;Myc抗体购自MBL公司;抗鼠IgG-HRP购自Jackson公司;DMEM培养基、胎牛血清、蛋白marker及ECL发光试剂盒购自Thermo Fisher Scientific公司;Glutathione Sepharose4B购自GE Healthcare公司;其他试剂均为国产分析纯产品。
1.2 PCR引物的设计与合成
采用反向PCR法构建TRAF6截短体质粒。目标截短体为TRAF6 N和TRAF6 C。根据Gen-Bank公布的人源TRAF6 cDNA编码区序列和对应的氨基酸序列,TRAF6 N为TRAF6氨基酸序列的前288位残基,TRAF6 C为后234位残基(图1)。PCR引物由北京生工生物技术有限责任公司合成。
反向PCR法是以环状DNA为模板,以反方向设计的2条引物对质粒进行完整的PCR。因此,反向PCR引物应在缺失序列的外侧开始设计,并考虑载体序列和相应的内切酶识别序列[11]。真核质粒pCMV-Myc-TRAF6序列内TRAF6两端内切酶位点分别为EcoRⅠ和XhoⅠ。用于TRAF6 N截短体的正向引物为5′TCTCGAGGTACCGCGGC CGCGGGGATC3′,反向引物 为 5′ATACCCAGAGT CGGGTATAACGCTCAA3′;用于 TRAF6 C 截短体的正向引物为5′ATCTCAGAGGTCCGGAATTTCC AGGAA3′,反向引 物为 5′CCGAATTCGGGCCTCC ATGGCCATAAG3′。
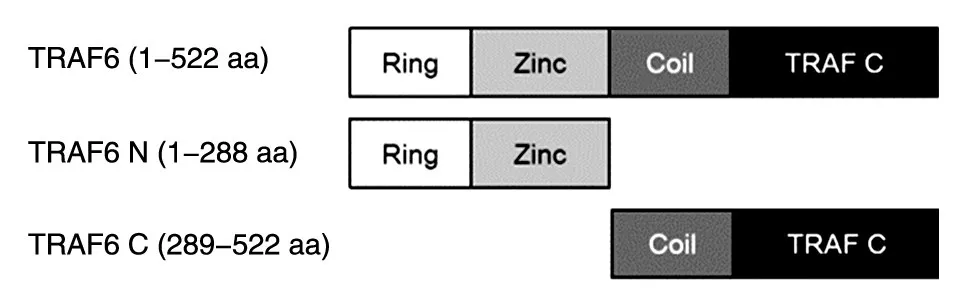
图1 TRAF6蛋白结构示意图
1.3 截短体质粒的构建
反向PCR法整个过程不需要琼脂糖凝胶电泳的参与,仅包括“反向PCR→消化模板→PCR产物自身环化”[11]三步。
50 μL反向PCR反应体系包括蒸馏水35 μL,10×缓冲液 5 μL,2 mmol/L dNTP 5 μL,10 μmol/L 正向引物 1.5 μL,10 μmol/L 反向引物1.5 μL,50 ng/μL 模板 DNA Myc-TRAF6 1 μL,KOD-Plus酶 1 μL。PCR 反应条件:94℃ 2 min,98℃ 10 s,60℃ 30 s,68℃退火 6 min,10 个循环。PCR反应结束后,在50 μL PCR反应液中加入2 μLDpnⅠ,37℃反应1 h,消化模板。PCR产物自身环化体系:DpnⅠ处理后PCR产物2 μL,蒸馏水 7 μL,Ligation high 5 μL,T4DNA聚合酶 1 μL,16℃反应1 h。
1.4 转化及提取
取感受态大肠杆菌DH5α 100 μL,将上述自身环化后的产物全部转化至其中,涂布在含氨苄青霉素的LB琼脂平板上,于37℃恒温箱中培养过夜,次日观察平板,挑取5个阳性菌落移至5 mL含氨苄青霉素的LB培养液中,37℃振荡过夜。扩增培养后用质粒提取试剂盒提取质粒DNA。
1.5 病毒包装和转染
293FT细胞按1×106/孔接种于12孔板中,37℃、5% CO2条件下培养,次日将目的质粒用脂质体LipofectAMINE 2000转染293FT细胞,8 h后换液。
1.6 免疫印迹法检测目的基因的表达
转染48 h后,用RIPA裂解液[50 mmol/L Tris(pH7.4),150 mmol/L NaCl,1%NP-40,0.1%SDS,加入蛋白酶和磷酸酶抑制剂]裂解细胞,SDS-PAGE分离蛋白后电转移至NC膜,脱脂牛奶封闭液封闭1 h;加入一抗,室温温育2 h或4℃温育过夜;TBST洗膜3次,每次10 min;加入相应的二抗,室温温育1 h;TBST洗膜3次,每次10 min;将ECL显色液加到膜上,用保鲜膜把膜包起来,放入Tanon 5200化学发光成像分析系统中曝光、显影,保存数据。
2 结果
2.1 TRAF6截短体基因克隆的转化
转化过夜后,观察LB琼脂平板上菌落生长情况。由图2可见,转化对照组pCMV-Myc-TRAF6质粒后菌落密集,说明转化体系无异常情况;反向PCR法获得的pCMV-Myc-TRAF6 N和pCMVMyc-TRAF6 C质粒均有少量菌落产生,可进一步对其进行鉴定。
2.2 pCMV-Myc-TRAF6 N和pCMV-Myc-TRAF6 C质粒的鉴定
pCMV-Myc-TRAF6 N和pCMV-Myc-TRAF6 C质粒经EcoRⅠ和XhoⅠ双酶切后分别得到约900和750 bp的条带,与TRAF6 N和TRAF6 C的长度相符,说明目的质粒构建成功(图3)。
2.3 转染后TRAF6 N和TRAF6 C蛋白的表达
以转染pCMV-Myc-TRAF6为对照组,pCMVMyc-TRAF6 N和pCMV-Myc-TRAF6 C为实验组,并以GAPDH为内参。结果见图4,转染后TRAF6 N和TRAF6 C蛋白能在293FT细胞中正常表达,与TRAF6蛋白的表达无明显差异。说明pCMV-Myc-TRAF6 N和pCMV-Myc-TRAF6 C构建成功。
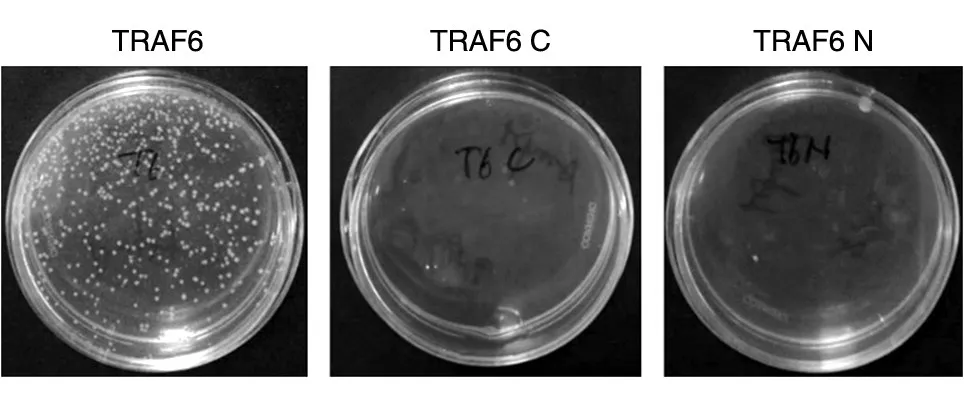
图2 转化后TRAF6截短体基因克隆菌落生长情况

图3 pCMV-Myc-TRAF6 N和pCMV-Myc-TRAF6 C质粒的双酶切产物电泳图谱

图4 Western印迹检测TRAF6 N和TRAF6 C蛋白在293FT细胞中的表达
3 讨论
蛋白质截短体和点突变体在研究蛋白质本身结构和功能中具有重要作用,如借助蛋白质截短体和点突变体研究蛋白质磷酸化、泛素化、甲基化,蛋白与蛋白之间的相互作用等,有助于对蛋白分子所发挥的生物学功能进行排除和确认。为快速推进实验进程,本研究采用反向PCR技术构建了TRAF6蛋白截短体质粒pCMV-Myc-TRAF6 N和pCMV-Myc-TRAF6 C,并经酶切、转染和Western印迹证实其融合蛋白的正确性,为深入探讨TRAF6生物功能特性提供了便利。

