体外诱导小鼠胚胎干细胞产生T谱系潜能造血祖细胞的关键步骤
于波,洪平山,胡房晓,夏成祥,兰雨
暨南大学 基础医学院,广东 广州 510632
利用T淋巴细胞构建的嵌合抗原受体T细胞(chimeric antigen receptor T-Cell,CAR-T)和基因修饰的T细胞受体T细胞(T cell receptor T-cell,TCR-T)是临床肿瘤免疫疗法的重点方向。胚胎干细胞(embryonic stem cell,ESC)及诱导性多能干细胞(induced pluripotent stem cell,iPSC)具有无限增殖和分化为成体所有类型细胞的能力,其来源广泛,可操作性强。利用ESC和iPSC分化产生功能性T细胞,是解决目前临床治疗中所面临的T细胞来源紧缺难题的理想途径。
近年来,随着人们对造血发育过程中的细胞和分子事件的认识不断深入,越来越多的研究团队运用形态发生素介导的定向分化、转录因子介导的细胞表型转变、畸胎瘤模型等一种或多种相结合的方法,分别从人和小鼠胚胎干细胞中诱导分化出具有定向谱系潜能的造血祖细胞[1-5],并且从体外分化7~9 d的生血内皮细胞(hemogenic endothelial cell,HEC)中以Notch依赖的方式从人iPSC和ESC产生了T细胞[3,6-7],但其在可重复性、移植效率、细胞功能性和自我更新能力等方面仍有待提高。
转录因子Runx1和Hoxa9可以促进生血内皮细胞生成,本课题组[8]在小鼠胚胎干细胞体外诱导造血分化的过程中,在内皮向造血细胞诱导阶段同时过表达Runx1和Hoxa9,构建iR9-mESC重组细胞,体外诱导分化为iHEC。iHEC与发育中的胚胎D11主动脉-性腺-中肾区内皮细胞和造血干细胞前体具有相似的分子表型[9],并能产生具有T谱系潜能的诱导性造血祖细胞,重要的是,移植到体内产生具有丰富的TCRαβ重排的功能性诱导T细胞。为了进一步提高试验成功率和诱导T细胞的得率,本研究对ESC培养、拟胚体(embryoid body,EB)形成、HEC诱导分化及分选、细胞移植等关键步骤的条件参数进行比较分析,明确该诱导分化过程的操作技巧和关键注意事项,以促进该诱导体系的推广及应用。
1 材料和方法
1.1 材料
CD45.1+B-NDG小鼠购于百奥赛图公司[动物质量合格证号:SCXK(苏)2016-0004],在中国科学院生物医药与健康研究院无特异性病原(SPF)级动物房饲养[实验动物饲养设施合格证号:SYXK(粤)2015-0063];小鼠ESC购于百奥赛公司;AFT024基质细胞来源于美国模式培养物集存库(ATCC)。
DMEM高糖培养基、α-MEM购自美国通用电器公司;IMDM、胎牛血清、非必需氨基酸、Gluta-Max、丙酮酸钠、β巯基乙醇、青链霉素、潮霉素B、嘌呤霉素等购自美国英杰生命技术有限公司;PD0325901、Chir99021、白血病抑制因子购自美国Selleck生物科技有限公司;铁饱和转铁蛋白、单硫甘油、抗坏血酸、强力霉素(doxycycline,dox)等购自 美 国 Sigma公司 ;CD31、CD41、CD45、Kit、CD201、CD2、CD3、CD4、CD8、Gr1、Ter119、CD19、NK1.1、TCRγδ、DAPI等购 自 美 国 eBioscience公司;BMP4、VEGF购自美国Peprotech公司;胰酶替代物购自美国热电公司;细胞核转染仪(德国Lonza公司);BDfortessa流式细胞分析仪(美国BD公司);倒置荧光显微镜(日本奥林巴斯公司);RS2000 X线辐照仪(美国Rad Source公司)。
胚胎干细胞培养基:胎牛血清(15%),非必需氨基酸(1%),GlutaMax(1%),丙酮酸钠(1%),β巯基乙醇(0.1 mmol/L),PD0325901(1 μmol/L),Chir99021(3 μmol/L),白血病抑制因子(1000 U/mL),DMEM高糖培养基。
小鼠胚胎成纤维细胞培养基:胎牛血清(10%),非必需氨基酸(1%),DMEM高糖培养基。
OP9-DL1培养基:胎牛血清(20%),α-MEM。
AFT024细胞系培养基:胎牛血清(10%),β巯基乙醇(0.1 mmol/L),丙酮酸钠(1%),DMEM高糖培养基。
基础分化培养基(basic differentiation medium,BDM):胎牛血清(15%),铁饱和转铁蛋白(200 μg/mL),单硫甘油(0.45 mmol/L),GlutaMax(1%),抗坏血酸(50 μg/mL),青链霉素(1%),IMDM。
BDM+B培养基:在BDM培养基基础上加5 ng/mL BMP4。
BDM+BV培养基:在BDM培养基基础上加5 ng/mL BMP4和5 ng/mL VEGF。
BDM+CM+dox培养基:在BDM培养基基础上加 AFT024-mIL3、AFT024-mIL6、AFT024-mSCF、AFT024-hFlt3L的培养液上清各2%及1 μg/mL dox。
EM培养基:在BDM+CM+dox培养基基础上去掉AFT024-mIL6培养液上清,并将IMDM换成α-MEM。
1.2 mESC体外诱导分化步骤
复苏重组了Runx1和Hoxa9基因的iR9-mESC并传代2~3次,待细胞长至约80%培养皿时收集细胞,以1×105/mL的细胞密度,每20 μL为1滴,接种至15 cm培养皿盖中,颠倒皿盖,在培养皿底部加适量无菌水保持湿润的培养环境,于37℃、5% CO2培养箱中用BDM+B培养基培养2.5 d诱导形成EB,收集EB接种至6或12孔培养板(6孔板 20~30个/孔,12孔板 15~20个/孔),用BDM+BV培养基继续培养至第6 d,换为BDM+CM+dox培养基诱导基因表达,11 d时收集细胞,流式分选 iHEC(CD31+CD41lowCD45-Kit+CD201high),以 5×103/孔接种至铺有 2×104/孔的 OP9-DL1 培养皿,EM培养基中培养10 d诱导分化为特定祖细胞,移植入CD45.1+B-NDG小鼠,4周后检测T谱系分布和T细胞表型(图1)。
1.3 流式细胞术分析体外不同培养条件下诱导性生血内皮细胞的含量
以往研究证明具备淋巴谱系分化潜能的造血祖细胞,其发育潜能在生血内皮细胞阶段就已经决定,因此在多能干细胞分化产生淋系细胞的过程中,诱导生成具有淋巴谱系分化潜能的iHEC尤为关键。体外不同条件下诱导培养的第11 d细胞用胰酶消化成单细胞悬液,用含2%胎牛血清的磷酸盐缓冲液清洗,经生物素标记的CD31抗体冰上孵育15 min,抗生物素磁珠4℃避光孵育25 min富集(对照组未经富集步骤),荧光偶联流式抗体染色15 min,用含2%胎牛血清的磷酸盐缓冲液清洗后,流式细胞仪分选目的细胞。
1.4 统计学分析
用GraphPad Prism 7软件分析实验组和对照组差异的统计学意义。用Flowjo 10.0.7和Adobe Illustrator CS 6软件处理流式检测数据。P<0.05示差异有统计学意义。
2 结果
2.1 提高mESC转染效率及同源重组iR9-mESC得率技巧
在早期研究中,通过定点打靶方式将外源基因导入Rosa26位点。首先利用同源重组方法将CAG-Pr-rtTA-3×Stop-TRE-Runx1-p2a-Hoxa9-pAPGK Pr-HygroR诱导表达单元定点插入mESCs的Rosa26位点,然后通过在培养基中加入潮霉素B筛选出阳性克隆,构建诱导型Runx1-p2a-Hoxa9小鼠胚胎干细胞株iR9-mESC。在筛选并挑取iR9-mESC克隆后,在培养基中加入dox,qPCR检测外源性基因Runx1和Hoxa9在mESC内是否可以被诱导表达(图1)。
在构建iR9-mESC过程中,每一个步骤都可能影响克隆株的成功获取。我们对该过程中出现的影响因素进行了探索分析,从而提高mESC的转染效率及同源重组iR9-mESC的得率。
对于电转时的质粒和细胞浓度,由于同源重组效率低,因此选择用于电转的细胞要尽量多一些,以提高重组效率,而为了避免电转后细胞培养过程中多个克隆长在一起影响胚胎干细胞单克隆的纯度,用于电转的细胞浓度要适宜;另外,线性化质粒的使用量也会影响电转结果。实验证明,选择形态较好、处于对数生长期的约1.2×106mESC作为电转目标,加入核转染试剂和2~4 μg线性化质粒,电转后在小鼠胚胎成纤维细胞上培养并经潮霉素B药筛后,能获得数目较多且独立存在的iR9-mESC克隆株。
在电转后得到的iR9-mESC培养方面,电转后的1.2×106mESC铺在小鼠胚胎成纤维细胞上生长,24 h后加入终浓度为150 μg/mL的潮霉素B筛选阳性细胞克隆7~10 d。电转后的细胞状态较差会导致部分细胞贴壁能力差,以至于24 h后仍有一定量的可能成功构建的iR9-mESC悬浮于细胞培养基中,因此换液时一定要收集上清,离心后重新放进来继续培养,否则将会导致目的细胞的丢失。另外,为避免影响细胞生长状态,要减少换液次数,而长时间不换液会导致白血病抑制因子失活,研究得出每2 d换1次培养液既能保证细胞良好生长状态又能提供足够营养。
对于培养iR9-mESC所用的介质选择,由于mESC只有在饲养层细胞或明胶上才能生长,电转前的mESC若是培养在小鼠胚胎成纤维细胞上,则电转前须用0.1%明胶去除小鼠胚胎成纤维细胞,导致处理步骤多,操作时间长,细胞活性不好,但细胞多能性维持较好;而如果将mESC直接培养在明胶上,电转前不需要进行去除成纤维细胞的步骤,一定程度上提高了细胞活性,但在明胶上生长的mESC容易分化,导致细胞多能性较差。综合分析,得出电转前mESC在小鼠胚胎成纤维细胞上培养比在明胶上培养更能保证细胞的多能性状态,有利于之后的诱导分化步骤。在提高iR9-mESC活性方面,获得iR9-mESC之后,需要在小鼠胚胎成纤维细胞上传代培养2~3次,得到大量对数生长期的细胞,进行拟胚体诱导培养。而在iR9-mESC培养过程中,对于状态不好的细胞可以通过类似去饲养层细胞的方式改善细胞生长状态:将含有小鼠胚胎成纤维细胞的iR9-mESC铺在0.1%明胶上30~40 min(根据细胞黏附至明胶上的情况而定)后,大部分成纤维细胞和一些抓力强、活性好的iR9-mESC黏附在明胶上,此时可以收集贴壁细胞,离心后继续培养即可活跃增殖。此方式虽然大大减少了iR9-mESC数目,但也去掉了很多生长状态差的细胞,继续培养时到达相同细胞数目和相同时期(对数期)所需的培养天数与未经历此步骤培养的iR9-mESC相比明显缩短。另外,细胞克隆密度对细胞生长状态也有一定的影响,iR9-mESC培养时要保证适当的细胞克隆的密度,密度过高会使得克隆之间连成一片导致分化现象。
图1 iR9-mESC细胞系构建步骤

图2 T谱系潜能造血祖细胞诱导流程图
2.2 诱导EB生成过程中的关键因素和技巧
得到一定量的iR9-mESC之后,首先需要诱导成具有内、中、外三胚层结构的EB,在此基础上继续向造血方向诱导分化(图2)。胰酶消化iR9-mESC,利用差速贴壁法将细胞加入0.1%明胶包被过的孔板中,40 min后收集上清中的细胞离心,即可去掉成纤维细胞,分离出iR9-mESC。离心后加入BDM+B培养基重悬细胞沉淀,并将细胞浓度调整为 1×105/mL,按照 20 μL/滴的细胞量将细胞悬液均匀滴在15 cm培养皿盖的反面,然后颠倒皿盖进行悬浮培养,此时记作第0 d(D0)。须在培养皿底部加一些无菌水保持湿度,于37℃、5% CO2培养箱中培养2.5 d后收集拟胚体离心,用BDM+BV培养基重悬即可为下一步分化做好准备。
诱导过程中,用来诱导形成EB的单个液滴形状和体积的精确性是关键。在悬EB时,液滴一定要呈圆形,垂直滴到培养皿中,液滴形状不规则会影响D2.5时EB小球的形状以及之后的诱导分化过程。并且悬EB时,若移液枪枪头中有液体残留,使得液滴体积小于20 μL,会导致得到的EB小球大小不均匀或较小,影响后续分化过程(图3)。需要注意的是,在收集iR9-mESC进行EB培养前,需要用DPBS洗涤iR9-mESC以去除iR9-mESC培养液中的小分子抑制剂(如PD、CHIR及Lif等),避免小分子抑制剂对EB后续分化的抑制。

图3 拟胚体形态(白光,5×物镜)

图4 拟胚体破碎情况下体外诱导iR9-mESC分化第11 d的诱导性生血内皮细胞分选流式图
收集EB时,工具使用不当及操作不当也会大大降低之后iHEC的得率。由于得到的EB呈球形,体积较大且内部结构不是特别致密,因而需要使用孔径较大的巴氏吸管收集EB,如用移液枪收集会导致EB破裂,最终极大地降低后续iHEC的比例(图4、5A)。同时,收集EB时离心力要温和,90×g或自然沉降均可。离心后弃上清过程中动作要轻柔,以免将EB弃掉。
2.3 EB诱导分化以及生血内皮细胞分选过程的技巧
在诱导EB生成生血内皮细胞及生血内皮细胞收集和分选过程中,离心收集好的D2.5 EB须用BDM+BV培养基重悬,种在0.1%明胶包被过的6孔板中诱导分化,在EB培养的D6~D11期间用BDM+CM+dox培养基诱导外源基因Runx1和Hoxa9表达促进生血内皮细胞生成,其间每2 d换1次液。D11时,用0.05% Trypsin-EDTA胶原酶消化拟胚体,充分吹散后收集于50 mL离心管中,用美天旎免疫磁珠试剂盒富集CD31+细胞,染色后流式细胞仪分选iHEC(CD31+CD41lowCD45-Kit+CD201high)。此步操作过程中在以下几个方面设置了对照实验。
EB诱导分化过程中,未加dox会降低诱导分化效率,导致iHEC得率低。此步骤添加dox的作用是诱导Runx1和Hoxa9表达,从而促进产生T谱系潜能的iHEC。由于Runx1在产生生血内皮细胞和EHT阶段的促进作用,所以Runx1不仅影响iHEC谱系特异性,也影响EB向iHEC的分化。该阶段缺少Runx1表达会影响EB分化形成的iHEC得率(图5)。另外,诱导分化生血内皮细胞的EB铺板密度要均匀适中,一个15 cm培养皿培养的约200个EB小球均匀铺到1块六孔板中即可,每孔20~30个拟胚体小球,12孔板则每孔10~15个,保证每个EB小球是独立的,小球间距均匀。D2.5~D6期间对培养基进行半换液或补液500 μL,注意不要大幅度晃动培养皿,否则会导致EB漂浮而停止分化。
收集生血内皮细胞时,0.05%Trypsin-EDTA胶原酶消化时间和操作过程直接影响其得率。消化培养D11的EB时,Trypsin-EDTA胶原酶的作用时间和收集时的耗时是关键。酶消化时间过长会导致细胞状态变差,收集时反复吹打细胞次数过多虽然可以减少未吹散细胞团块而导致的细胞的损失,但吹打产生的气泡会损失大量细胞,并且处理时间过长也会在很大程度上降低细胞活性,最终降低生血内皮细胞分选时的得率,从正常情况下的16.1%降低至0.1%(图6、5A)。实验得出,在收集胰酶消化后的产物时,用移液枪吹打8~10下可较好地实现二者的平衡。另外,收集消化好的细胞离心前需要来回剧烈颠倒离心管,以分散诱导培养过程中产生的黏稠状的细胞分泌物团块,利于之后进一步过滤,在后续用免疫磁珠富集时避免堵塞柱子。
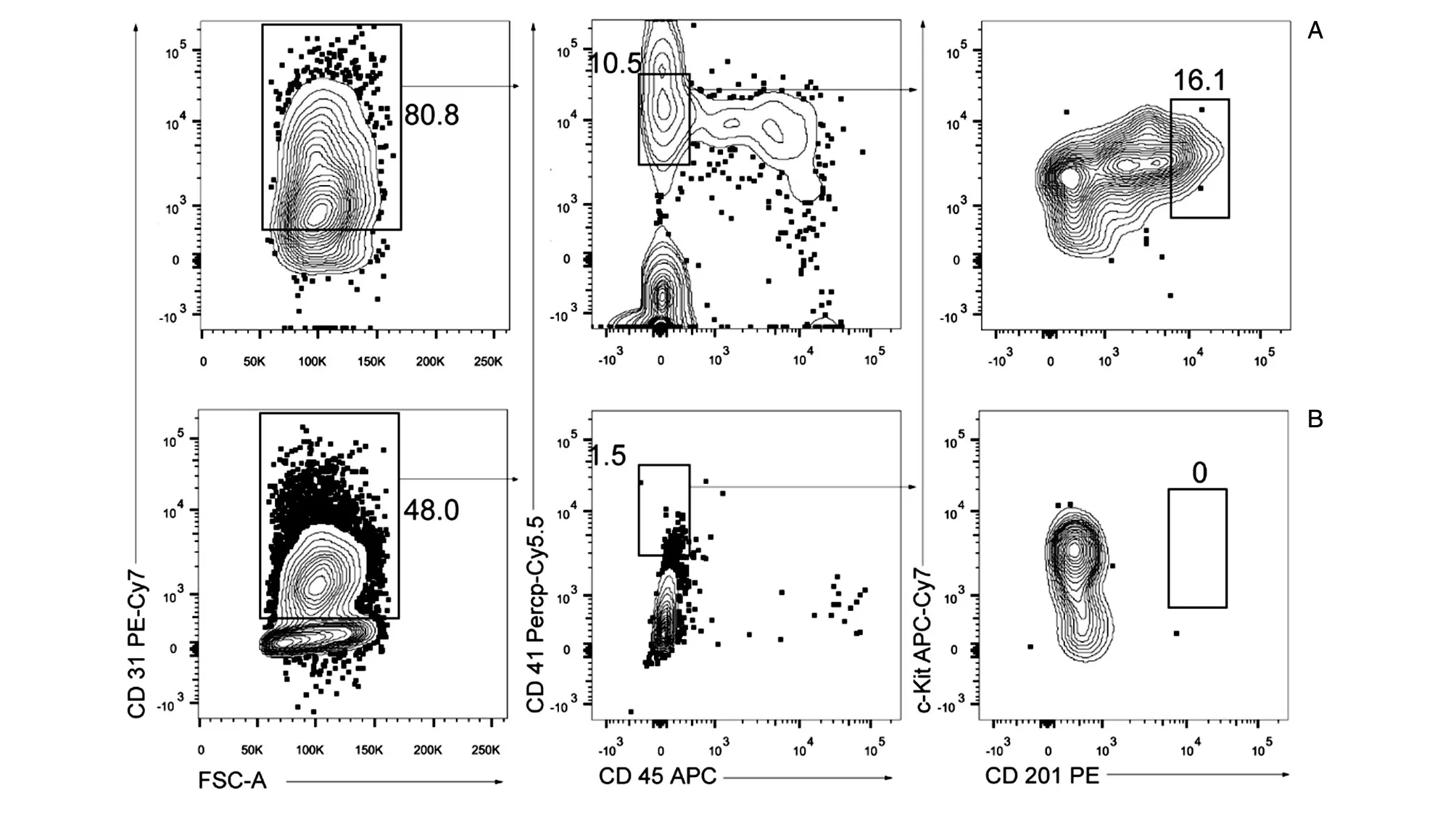
图5 正常条件下和未加dox条件下体外分化获得诱导性生血内皮细胞比例的流式图

图6 细胞消化过度情况下体外诱导iR9-mESC分化第11 d分选的诱导性生血内皮细胞流式图
正确的免疫磁珠富集方法可增加生血内皮细胞得率。为了满足移植所需的造血祖细胞数量,通常会准备尽可能多的细胞用于产生EB,进而能够分选得到较多的iHEC,因而D11收集用来分选的细胞量一般较大。在分选前,先进行生物素标记的CD31抗体和抗生物素的磁珠对细胞进行富集,可以避免分选时间过长导致的细胞活性降低,又能减少流式仪器上机成本。需要注意的是,在用微珠之前,须在涡旋器上振荡混匀,以免使用时微珠浓度和数量不准确影响吸附效果。并且由于微珠较重,使用时须加大细胞浓度,控制反应液的量,否则会导致微珠沉在底部而不能充分标记细胞。同时,在细胞与微珠孵育过程中,定时多次混匀可增加二者的接触,其目的是提高富集效果,从而增加生血内皮细胞得率。实验得出,采用富集后再分选的方式,分选耗时少且细胞活性好,富集后CD31+内皮细胞比例显著高于未富集时,分别为70.5%和13.2%(图7)。分选时间过长会导致细胞活性差且与OP9-DL1共培养后细胞增殖较慢,并且流式分选上机成本高。上述不同的培养和操作条件下,iHEC的比例与对照组相比的统计学分析如图8所示。
2.4 共培养诱导T谱系潜能造血祖细胞的技巧
共培养诱导T谱系潜能造血祖细胞时,细胞密度及与基质细胞的比例是关键。分选出的D11的诱导性生血内皮细胞需要与OP9-DL1细胞共培养,从而诱导产生具有谱系特异性的造血祖细胞。共培养过程中需要注意,至少提前1 d(D10时)复苏OP9-DL1细胞,细胞计数后,以12孔板的每孔种板2×104OP9-DL1细胞为佳,由于分选出的细胞存在状态稍差以及分选时错读的可能性,实验发现培养时将分选出的诱导性生血内皮细胞与OP9-DL1细胞以1∶10的比例在EM培养基中共培养,可保证目的细胞营养获取充足又有足够的基质细胞提供分化所需的相关因子,10 d后可获得较多的造血祖细胞。

图7 CD31生物素标签富集前后内皮细胞的比例
2.5 细胞移植方法选择
体外诱导分化获得免疫表型的造血祖细胞后须移植到重度免疫缺陷小鼠(NOD-PrkdcscidIL2rgtm1/Bcgen,CD45.1+,B-NDG)体内,于无特异性病原(specefic pathogen free,SPF)环境中饲养4~8周,流式分析检测受体胸腺、淋巴结、血液等免疫器官中诱导性T细胞(CD4+/CD8+)的生成情况。该实验过程中细胞移植是产生有功能的诱导性T细胞成败的关键。其中,在细胞移植方法上一般有尾静脉移植和眼眶静脉移植2种选择。眼眶静脉移植时,由于操作经验不同,对注射针头进入位置和角度把握不准确,以及实验过程中小鼠受刺激后剧烈运动等突发情况,会导致部分已注射至眼眶静脉的珍贵的目的细胞从眼角渗出,降低移植成功率和移植细胞数目的准确性,并且由于经验和针头进入的深度不同,会导致小鼠眼睛不同程度的损伤而逐步失明,极大地影响小鼠身体健康、运动状态及移植后受体小鼠的存活率。而通过尾静脉注射移植时,因尾静脉易明显观察,方便进行准确注射,并且可看到注射后细胞的流向,很少出现大量供体细胞液从尾静脉流出的现象,增加了移植成功率和移植细胞数目的准确性,并且对操作难度和经验性要求较低。
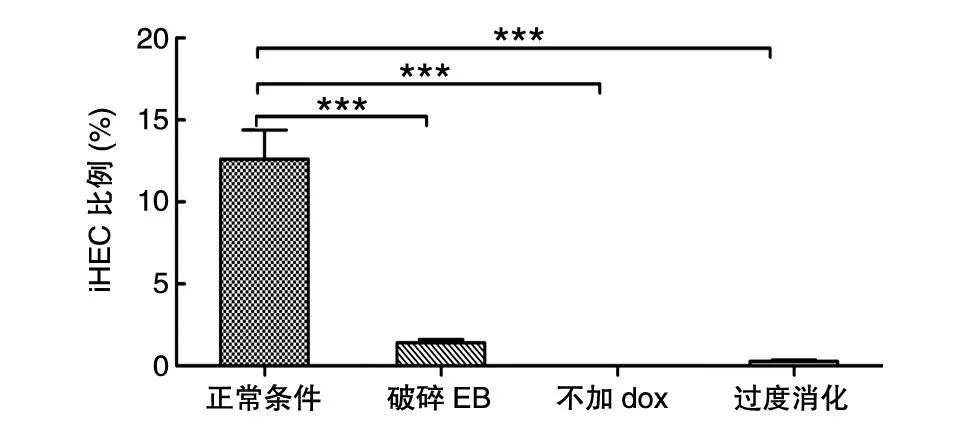
图8 不同培养条件下实验组和对照组数据差异的统计学分析
3 讨论
造血发育系统内皮起源和中胚层起源学说的兴起,体外诱导多能干细胞产生定向谱系的造血干祖细胞大多通过诱导生成具有内、中、外三胚层结构的拟胚体,经历内皮样中间体阶段,再利用共培养的方法定向诱导驯化为谱系特异的造血干祖细胞,最后通过移植到体内或在体外鉴定代表集落形成能力的集落形成单位,最终确定形成的成熟血液细胞种类及其功能[3,8,10-13]。
研究显示,生血内皮细胞具有异质性,并且红-髓祖细胞和造血干细胞来源于不同的生血内皮群体,重要的是,造血谱系潜能在生血内皮细胞阶段就已经预先确定[14-15]。最近的研究通过建立胚胎发育过程中主动脉-性腺-中肾区从内皮细胞到造血干细胞整个过程的单细胞转录组图谱,追踪第一波造血干细胞的生成,并鉴定捕获了具有造血干祖细胞命运和潜能的生血内皮细胞群体[16-17],说明特定类型iHEC的产生是体外诱导多能干细胞产生造血祖细胞的关键,可通过体外诱导多能干细胞产生谱系特异的iHEC从而产生特定潜能的造血祖细胞。本研究中,我们以在诱导过程中细胞培养浓度、操作方法细节、工具的使用、分选时间、细胞移植等方面设置对照组的方法,分析了影响该诱导体系中mESC活性、iHEC和造血祖细胞的含量以及谱系特异性的关键因素,针对各分化步骤和时间节点精准操作,从而提高实验过程中iHEC的活性和得率,提高移植效率,最终增加诱导性T细胞的得率。这些针对功能性T细胞再生的策略研究最终将帮助减轻血液系统疾病患者细胞治疗过程中T淋巴细胞再生的困难。
志谢:感谢中国科学院生物医药与健康研究院王金勇研究员及其团队给予本实验的支持与帮助。

