代谢重编程
——SIRS二次打击的枢纽
蒋柳,许才明,罗亚岚,李兆霞,陈海龙
(大连医科大学附属第一医院腹部急症外科,辽宁 大连 116011)
20世纪初奥托·瓦博格首先在肿瘤细胞代谢中发现Warburg效应,表现为有氧条件下细胞代谢从氧化磷酸化产能转向高效率的糖酵解代谢产能,其本质为糖酵解代谢增强,氧化磷酸化代谢减弱,又称为肿瘤“代谢重编程”[1]。近年来有学者发现,激活的炎症细胞亦可发生代谢方式的改变,这一现象与Warburg效应极为相似。静息状态下,巨噬细胞、中性粒细胞等主要采用氧化磷酸化的方式产能,而激活的炎症细胞会出现能量代谢方式的转换,表现出高糖酵解通量,线粒体氧化磷酸化受到抑制,导致大量乳酸、ATP、柠檬酸盐和琥珀酸盐积累[2-3]。全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)是由各种损伤如严重感染、创伤/烧伤、重症急性胰腺炎等引起的难以控制的急性病理生理反应。20世纪末Deitch[4]提出了多器官功能衰竭的“二次打击”学说,认为一部分多器官功能衰竭患者表现为“二次打击型”,即经历第一次原发性打击(如创伤/烧伤、胰腺炎)后患者病情会进入一个相对稳定时期,但仍伴有胃肠道缺血、轻中度SIRS,更重要的是机体内的免疫系统激活。若患者未能痊愈,而在数天或数周后经历第二次打击(外源性感染、肠源性感染),导致机体内已被激活的免疫系统发生过度激惹反应,进而引起SIRS向多器官功能衰竭转变[5]。SIRS时炎症细胞的代谢重编引起的代谢产物积累可反馈性促进炎症细胞的激活及炎症因子释放,推动SIRS向多器官功能障碍转化。现以炎症细胞代谢重编程为切入点,探讨异常代谢产物在炎症反应中的作用,以期为有效控制SIRS的过度炎症反应状态提供新策略。
1 代谢重编程概述
静息状态下,葡萄糖进入细胞经糖酵解途径产生的绝大部分丙酮酸在丙酮酸脱氢酶复合体的作用下氧化脱羧生成乙酰辅酶A,然后进入线粒体参与三羧酸循环,1分子葡萄糖经三羧酸循环彻底氧化可产生32个ATP,这是大部分正常细胞获取能量的主要方式。激活的炎症细胞中大部分丙酮酸不进入线粒体,而是在乳酸脱氢酶的作用下在胞质被还原成乳酸,1分子葡萄糖可生成2分子ATP。这就是炎症细胞的代谢重编程,在这一过程中炎症细胞通过快速高通量的葡萄糖代谢,摄取大量葡萄糖,中间产物及关键酶(葡萄糖转运蛋白、己糖激酶、6-磷酸果糖激酶、丙酮酸激酶)大量增加并高度活跃以满足炎症细胞激活及功能发挥的能量需求。相应地,由于丙酮酸生成的乙酰辅酶A减少,三羧酸循环受到抑制,循环出现两个断点,其中两个重要的中间体琥珀酸盐和柠檬酸盐得以积累[6]。Infantino等[7]发现,脂多糖刺激引起的谷氨酰胺衍生的琥珀酸盐生成增加14倍。琥珀酸盐的积累主要有两个途径:谷氨酰胺可通过谷氨酰胺酶代谢为谷氨酸和NH4+,其进一步转化为三羧酸循环中间体α-酮戊二酸,一种用于琥珀酸生产的上游代谢物。因此,当三羧酸循环活动受抑制时,增加的谷氨酰胺可提供琥珀酸生成的必要来源。增加的谷氨酰胺是由于脂多糖激活了巨噬细胞中谷氨酰胺转运蛋白之一——溶质载体家族3成员2的表达[7]。其次,通过γ-氨基丁酸分流也可产生琥珀酸。另一方面,在M1型巨噬细胞极化过程中,同位素标记发现了三羧酸循环中异柠檬酸脱氢酶(将异柠檬酸转化为α-酮戊二酸的酶)的代谢断裂,这一效应的特征是柠檬酸盐显著增加[6]。见图1。
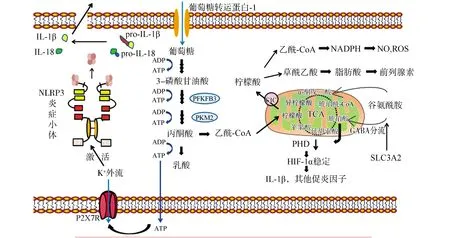
IL-1β:白细胞介素-1β; Pro-IL-1β:白细胞介素-1β前体; IL-18:白细胞介素-18;Pro-IL-18:白细胞介素-18前体;NLRP3 炎症小体:核苷酸结合寡聚化结构域样受体蛋白3;P2X7R:嘌呤能离子通道型7受体;ATP:腺苷三磷酸;ADP:腺苷二磷酸;乙酰-CoA:乙酰辅酶A;PFKFB-3:6-磷酸果糖-2-激酶/果糖-2,6-二磷酸酶3;PKM2:丙酮酸激酶同工酶M2;CIC:柠檬酸盐载体;NADPH:还原型烟酰胺腺嘌呤二核苷酸;NO:一氧化氮;ROS:活性氧类;GABA:γ-氨基丁酸;TCA:三羧酸;PHD:脯氨酰羟化酶;HIF-1α:缺氧诱导因子-1α;SLC3A2:溶质载体家族3成员2;琥珀酰Co-A:琥珀酰辅酶A
2 代谢重编程与炎症反应
代谢重编程过程中诸多代谢中间体和关键酶表达异常,这些代谢物不仅参与代谢,又具有非代谢信号作用,可反馈性影响炎症细胞的激活。
2.1乳酸 在炎症反应中,细胞由于高通量的糖酵解而导致乳酸大量堆积。乳酸不仅可预测脓毒血症的组织缺氧状态,还可在炎症反应中发挥信号调控作用,促进炎症介质释放。研究发现,乳酸在脂多糖刺激的巨噬细胞中积累,且具有促进高迁移率族蛋白B1(high-mobility group box 1 protein,HMGB1)乙酰化和释放的作用[8-9]。HMGB1是一种与脓毒血症相关的重要致炎介质,在炎症反应中起着损伤相关分子模式的作用,通过激活巨噬细胞、影响中性粒细胞功能等方式,在先天免疫应答中起关键作用[9-10]。有研究称,释放细胞外的HMGB1与肝损伤、急性胰腺炎、休克性肺损伤、肠道损伤等多器官功能障碍及全身炎症反应相关[11]。研究显示,释放细胞外的HMGB1可刺激白细胞募集,并促进肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-6(interleukin-6,IL-6)的释放,进而促进SIRS的发生发展[12-13]。
乳酸是脓毒症患者预后及死亡的独立预测指标。胞质中堆积的乳酸经胞膜弥散入血,这种乳酸生成的增加是早期预测炎症反应程度的指标之一。有研究表明,乳酸水平升高与脓毒血症死亡率增加呈正相关,乳酸水平越高,预后越差[14]。不同乳酸阈值已经在一些研究中建议用于早期积极复苏预测。基于此,血清乳酸水平升高有利于早期预测SIRS向多器官功能障碍综合征发展的倾向,有助于从临床治疗方面做出相应的调整。第三次脓毒症和脓毒性休克定义推荐血清乳酸>2 mmol/L作为临床鉴别脓毒性休克的主要标准[15-16]。Aduen等[17]认为,乳酸>4 mmol/L在预测非低血压患者住院死亡率方面的特异度为96%。Nichol等[18]对7 155例重症监护病房患者进行的回顾性研究显示,乳酸水平与住院死亡率独立相关,这种显著的关联在乳酸>0.75 mmol/L时可检测到,也可用于指导复苏。由此,血液乳酸水平升高与脓毒血症病情进展程度、预后紧密相关,可作为判断病情、评估预后的指标之一。
2.2外源性ATP 代谢产生的ATP大部分位于细胞内,但在过度炎症反应状态下,ATP从炎症细胞和实质细胞中释放,导致细胞外ATP水平升高,通过自分泌或旁分泌调控炎症细胞的活化[19]。在细胞外,ATP作为危险相关分子模式可以与免疫细胞广泛表达的膜结合的嘌呤能受体(P2受体)结合,并启动级联信号以诱导炎症反应[20]。这种P2受体相关的信号转导途径可介导炎症细胞的活化、迁移、增殖、分化以及释放多种炎症介质。Kukulski等[21]发现,胞外ATP与P2受体结合可介导IL-8诱导的嗜中性粒细胞迁移。P2Y2受体(P2受体亚型)除对中性粒细胞有直接影响外,还可以将幼稚的中性粒细胞转化为激活状态,继而通过产生超氧化物对ATP产生反应[22]。Mariathasan等[23]报道,脂多糖激活的巨噬细胞中ATP可通过P2X7介导核苷酸结合寡聚化结构域样受体蛋白3炎症小体的活化,进一步促进IL-1β成熟和分泌。在盲肠结扎穿刺术脓毒症小鼠中,P2X7受体有助于炎症细胞因子的产生并加剧炎症反应,P2X7敲除小鼠在盲肠结扎穿刺术后7 d 表现出存活率显著提高,用A438079(P2X7拮抗剂)治疗或P2X7敲除小鼠的死亡率显著降低,同时炎症反应总体减弱,细胞向腹膜的募集减少,NO和促炎细胞因子(IL-1β、IL-6、IL-12、IL-17、IL-4)未或有限增加,减少了腹膜细胞凋亡,并降低了肺部浸润和形态学变化[24]。使用P2X7受体抑制剂可改善盲肠结扎穿刺术导致的小鼠脓毒血症肝脏损伤,减少巨噬细胞炎症因子释放,改善脓毒血症预后和存活率[25]。因此,靶向ATP-P2受体通路有可能成为治疗脓毒症的一种有效策略。
2.3琥珀酸盐 琥珀酸盐在胞内的积累作为炎症级联反应的又一信号,涉及的机制较为复杂,包括:①诱导缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)的稳定化。琥珀酸盐从线粒体转运到细胞质中,抑制脯氨酰羟化酶的活性。在常氧条件下,HIF-1α迅速被脯氨酰羟化酶诱导降解,琥珀酸盐的积累使脯氨酰羟化酶受抑制时,HIF-1α得以稳定表达[26-27]。HIF-1α作用颇多,包括诱导炎症介质TNF-α、IL-1、IL-4、IL-12、IL-6表达;促进缺氧条件下糖酵解中间体及关键酶基因的表达,为炎症细胞成熟、分化提供必需的能量供应,亦维持线粒体膜电位,防止细胞凋亡等[28]。②琥珀酸盐的增加有利于蛋白质的琥珀酰化。研究显示,琥珀酰化通过负调节修饰调节乙酰辅酶A合成酶的活性,进而限制丙酮酸生成乙酰辅酶A进入线粒体[29-30]。③琥珀酸盐累积促进促炎受体GPR91激活。研究表明,巨噬细胞在激活过程将琥珀酸释放到细胞外环境中,同时上调GPR91的表达,GPR91作为细胞外琥珀酸自分泌和旁分泌传感器,增强IL-1β的产生[31-32]。关于靶向琥珀酸盐的炎症反应治疗研究已崭露头角:琥珀酸盐积累伴随着琥珀酸脱氢酶活性增强。衣康酸作为三羧酸循环的衍生物,其能降低经脂多糖处理的巨噬细胞中促炎介质(IL-1β-HIF-1α轴)的产生[13],改善脓毒症动物模型的死亡率,可能通过抑制琥珀酸脱氢酶发挥作用[33]。
2.4柠檬酸盐 在线粒体呼吸受抑制时,柠檬酸盐积累并释放进入胞质。柠檬酸盐通过线粒体柠檬酸盐载体(citrate carrier,CIC)进入胞质后,在柠檬酸裂解酶的作用下裂解为乙酰辅酶A和草酰乙酸。草酰乙酸产生还原型烟酰胺腺嘌呤二核苷酸,其是生成NO和活性氧类的重要辅助因子;而乙酰辅酶A可直接用于脂肪酸的生物合成,为前列腺素合成提供前体[34]。在一项脂多糖激活巨噬细胞的研究中,脂多糖能诱导免疫细胞CIC信使RNA和蛋白质显著增加。CIC基因沉默和活性抑制可显著减少NO、活性氧类和前列腺素的产生[35]。此外,CIC的编码基因SLC25A1已被证明在转录水平被两种关键的促炎细胞因子即TNF-α和γ干扰素诱导,并且这种诱导涉及核因子κB和信号转导及转录激活因子1的转录活性[7]。这些因子通过引起血管舒张以及中性粒细胞、淋巴细胞和单核细胞聚集促进炎症反应:NO通常是由一氧化氮合酶在内皮细胞中诱导产生,而脓毒症与NO的产生增加相关,NO与超氧离子相互作用产生的活性氧类直接导致宿主细胞毒性[36];诱导型一氧化氮合酶过量产生NO可能会导致败血性休克的低血压、心脏降压和血管反应性降低,用NO抑制剂治疗可改善血流动力学变化和患者的生存率[37],而TNF-α和γ干扰素等细胞因子可诱导巨噬细胞中诱导型一氧化氮合酶的表达[38]。故抑制柠檬酸盐积累从而抑制其下游促炎因子的产生可能是SIRS的治疗方向之一。
3 代谢重编程与SIRS的治疗前景
目前炎症性疾病的代谢治疗思路主要是逆转代谢重编程,减少炎症因子产生,抑制炎症细胞过度激活和炎症瀑布反应的进一步扩大。如前所述,激活的炎症细胞主要采用有氧糖酵解的代谢方式,而有氧糖酵解受多种糖酵解关键酶的控制,靶向这些代谢关键酶可为全身炎症反应的治疗带来新希望:①丙酮酸激酶同工酶M2(pyruvate kinase isozyme type M2,PKM2)是有氧糖酵解的中间介导物,在调控HMGB1释放中发挥作用。在脂多糖激活的巨噬细胞中,PKM2通过与HIF-1α相互作用,介导有氧糖酵解所需酶的HIF-1α依赖性转录。Yang等[9]的研究显示,在脂多糖激活的巨噬细胞中,敲除PKM2使HIF-1α依赖的糖酵解相关基因表达降低,乳酸生成和HMGB1释放也相应减少。另外,在小鼠脓毒症模型中,PKM2抑制剂紫草素可降低小鼠血清乳酸和HMGB1的水平,缓解小鼠脓毒症的死亡率[9]。②逆转炎症性疾病中高活性糖酵解的另一靶标——己糖激酶2(糖酵解过程的起始酶和限速酶)。2-脱氧-D-葡萄糖(2-deoxy-D-glucose,2-DG)是己糖激酶2的竞争性抑制剂。己糖激酶2可将2-DG转化为磷酸化的2-DG(2-DG-6p),2-DG-6p无法代谢,通过抑制己糖激酶2的活性抑制糖酵解。在体外实验中,2-DG抑制脂多糖激活的巨噬细胞中HIF-1α及其靶标IL-1β和HMGB1的表达[39]。在体内实验中,2-DG通过下调乳酸和炎症细胞因子的产生,显著提高脂多糖诱导的脓毒症小鼠的存活率[40]。Zheng等[41]的研究还证实,2-DG可减轻脓毒症引起的心脏功能障碍。③6-磷酸果糖-2-激酶/果糖-2,6-二磷酸酶3是一种糖酵解限速酶,调控糖酵解速率。3PO是6-磷酸果糖-2-激酶/果糖-2,6-二磷酸酶3的小分子拮抗剂,能抑制糖酵解,减少葡萄糖的摄取和乳酸产生。在盲肠结扎穿刺术诱导的小鼠脓毒症模型中,3PO治疗能改善脓毒症小鼠的存活率,减轻组织病理学改变和肺部炎症反应,减少乳酸水平升高和肺细胞凋亡[42]。脂多糖可诱导人肺泡上皮细胞A549糖酵解通量增加,细胞凋亡,炎症因子产生,活性氧类增加,而3PO处理则减弱了这些病理变化[42]。Wang等[43]的研究也证明,在脂多糖刺激的野生型小鼠模型中,6-磷酸果糖-2-激酶/果糖-2,6-二磷酸酶3特异性基因敲除小鼠表现出内皮通透性降低,肺水肿减轻,存活率升高,并伴随着中性粒细胞和巨噬细胞向肺部浸润的减少。
代谢重编程在炎症反应中除了为炎症细胞供能外,还参与了错综复杂的炎症信号调控,逆转有氧糖酵解在细胞层面可有效控制炎症反应,目前动物研究证实有效,但临床试验尚未报道。以上研究结果一定程度上可为今后SIRS的临床治疗和药物开发提供新的方向。
4 小 结
SIRS的发病机制涉及多种因素,总的来说是以机体免疫机制触发,代偿机制失控为核心的自我持续放大和自我破坏的过程。目前SIRS患者临床表现个体差异大,诊断标准缺乏特异性,缺乏有效的干预措施。了解免疫细胞代谢重编程在炎症反应中的作用、部分代谢中间体和代谢产物在炎症反应发生发展过程中的关系,寻找免疫与代谢的连接点,可能是SIRS诊治的新方向。尽管目前关于全身炎症反应模型中直接调控以上靶点的研究还少之又少,但是随着SIRS相关代谢重编程研究的不断深入,相信其能够为研究者们提供有效参考。此外,除了已发现的糖酵解通路中炎症的调控激酶外,该通路上还存在一些其他潜在靶点可作为研究方向,如烯醇化酶,其作为糖酵解通路上催化2-磷酸甘油酸形成高能化合物磷酸烯醇式丙酮酸的酶,可能也具有通过调控糖酵解通量进而影响其下游代谢物(乳酸、ATP等)的产生,进而调控SIRS促炎通路的作用。寻找代谢重编程的关键调控靶点,通过逆转炎症细胞的代谢方式,改善这种过度炎症反应状态,可能为SIRS的临床诊断及治疗提供新的思路。

