病毒诱导的基因沉默防控烟草马铃薯Y 病毒病研究
刘天波 ,蔡海林,滕凯,曾维爱,毛辉,魏润洁 ,周志成,周向平,戴良英 ,唐前君*
1 湖南农业大学植物保护学院,长沙 410128;
2 植
物病虫害生物学与防控湖南省重点实验室,长沙 410128;
3 长沙市烟草公司,长沙 410010;
4 湘西州烟草公司,吉首 416002;
5 湖南省烟草科学研究所,长沙 410004;
6 永州市烟草公司,永州 425000
由马铃薯Y 病毒Potato virus Y(PVY)引起的病毒病是烟草上的重要病害,在全世界普遍发生,且呈日益严重的趋势[1-3]。PVY 是马铃薯Y 病毒科(Potyviridae)马铃薯Y 病毒属(Potyvirus)的典型成员,为单链正义RNA 病毒,外面包被外壳蛋白(coat protein,CP)。CP 除对病毒起保护作用外,还与病毒组装、蚜虫传毒、调控病毒RNA 复制等有关[4-5]。目前,生产上防治马铃薯Y 病毒病主要以化学防治为主[6],防治效果不佳,也易造成农药残留和环境污染。抗病品种的培育是防治病毒病有效的方式之一,刘勇等[7-9]通过种质资源筛选、EMS 诱变、基因编辑技术,抗病定向改良品种云烟87 获得抗PVY 的新品种云烟121。但育种周期较长,抗病新品种审定推广缓慢,烟叶种植者对新品种栽培、烘烤特性难以把握。
20 世纪20—30 年代,人们发现感染了病毒温和株系的植株可以抵御与其亲源关系相近的强毒株系病毒的侵染,即交叉保护现象。进一步研究发现,交叉保护是一种病毒诱导的基因沉默(virus induced gene silencing,VIGS),使植株产生了对该病毒的抗性。VIGS 是植物抗病毒侵染的一种自然机制[10],已被广泛应用于烟草、拟南芥、马铃薯、大豆、玉米等植物基因功能鉴定研究[11-12]。在VIGS 体系中,需要病毒载体介导基因沉默。常见的RNA 病毒载体有烟草花叶病毒(Tobacco mosaic virus,TMV)、马铃薯X 病毒(Potato virus X,PVX)、烟草脆裂病毒(Tobacco rattle virus,TRV)等[13]。TRV 作为诱导基因沉默的载体是目前应用最广的载体之一,具有寄主范围广、沉默效率高、持续时间长、引起的病毒症状轻等优点[14],已被广泛应用于烟草、番茄、辣椒等多种茄科植物[15-18]。TRV 为二元RNA 病毒,Ratcliff等[19]将TRV 改造成RNA2(pTRV2)和RNA1(pBINTRA6)cDNA 的双元表达载体,并利用TRV 载体成功使转基因烟草的绿色荧光蛋白基因沉默。以TRV 为载体的VIGS 技术可以使携带目标基因片段的TRV 侵染植物,导致后续侵入病毒的靶向同源基因降解,达到抑制靶病毒侵染的目的,为病毒病防治提供利用病毒诱导的基因沉默技术,本文介绍了构建靶向PVY CP基因片段的烟草脆裂病毒TRV 载体,转化农杆菌后处理烟苗,人工接种PVY,通过RT-qPCR 检测、表型观察和小区试验评价VIGS 处理烟株的效果,旨在建立TRV 介导的VIGS 体系防治PVY,为PVY 的防治提供了新思路。
1 材料与方法
1.1 试验材料
供试植物:烟草品种为‘K326’,其种子由湖南省烟草公司长沙市公司提供。
菌株和病毒:根癌农杆菌GV3101、TRV 载体pTRV2(GenBank 登 录 号:NC-003811.1) 和pBINTRA6(pTRV1)均由湖南省植物保护研究所张德咏研究员馈赠。所用PVY 为脉坏死株系(PVYN),从湖南烟区烟草上分离保存。
1.2 引物设计
根据已测定的P V YN(G e n B a n k 登录号:HQ631374)序列,使用Primer 5.0设计特异性引物(表1)。

表1 本研究使用的引物序列1)Tab.1 Primers used in this study
1.3 VIGS 载体的构建
利用生工生物工程 (上海)股份有限公司的UNIQ-10 柱式TRIzol 总RNA 抽提试剂盒提取感染PVY 的‘K326’烟株叶片总RNA,具体操作方法依据产品说明书。参照TransGen Biotech 公司TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix说明书反转成cDNA。以获得的cDNA 为模板,按照表1 中相应的引物进行PCR 扩增,扩增体系:10× Top Taq Buffer 2 μL,10 mmol/L dNTPs 1.6 μL,20 μmol/L CPF/CPR 引物各0.8 μL,10 μmol/L cDNA 模板1 μL,TaqDNA 聚合酶0.4 μL,加ddH2O 补至20 μL。反应条件为95℃ 5 min;94℃ 45 s,55℃ 30 s,72℃ 1 min,30 个循环;72℃ 10 min。琼脂糖凝胶电泳检测、回收目的片段。将回收片段与载体T1 Cloning Vector(TransGen Biotech 公司)连接,转化大肠杆菌感受态细胞TransT1 Chemically Competent Cell(TransGen Biotech 公司)。提取质粒T-CP 和pTRV2 质粒,对质粒进行BamHI/KpnI 双酶切,回收酶切产物后进行连接后转化大肠杆菌DH5α,用CPF/CPR 引物筛选阳性克隆,提取pTRV2-CP 质粒,用BamHI/KpnI 酶切验证,筛选获得的阳性克隆送上海生物工程有限公司测序。pTRV1 和pTRV2-CP 的具体构建参照Chung 等[18]的方法(构建方法见图1)。
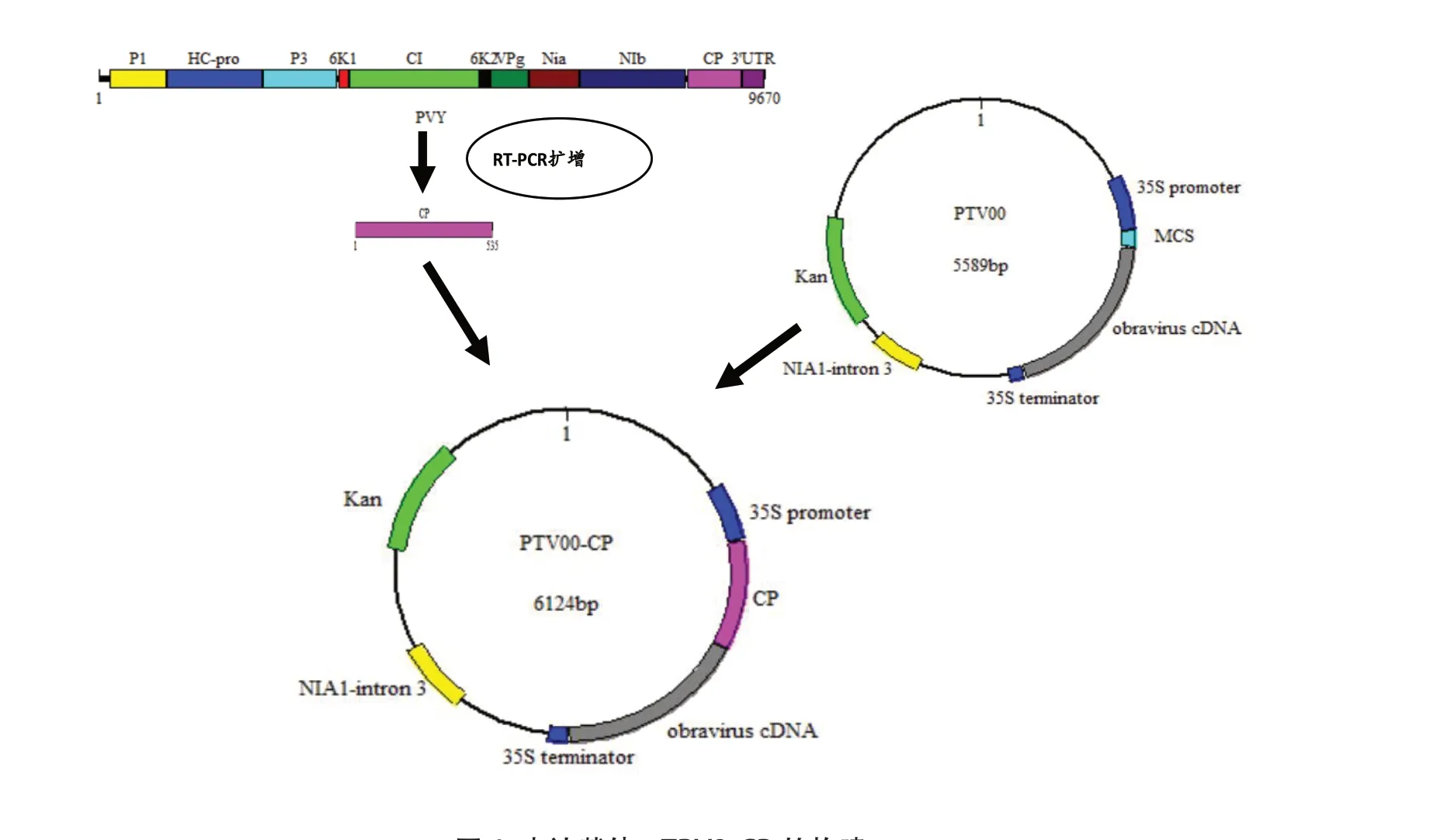
图1 表达载体pTRV2-CP 的构建Fig. 1 The construction of expression vector of pTRV2-CP
1.4 重组表达载体转化
参照Ratcliff等[19]方法进行重组表达载体pTRV2-CP 转化农杆菌GV3101。将菌液均匀涂抹在YEP (含有浓度为50 mg/mL 利福平和卡那霉素)固体培养基上,28℃下倒置培养2 d;挑取单菌落进行PCR 验证,1%凝胶电泳、回收、测序。
1.5 VIGS 表达载体侵染率的测定
将pTRV2-CP-GV3101、pTRV1-GV3101 和pTRV2-GV3101 分 别 于YEP 培 养 基 中30 ℃,180 r/min 恒温培养24 h,制成发酵原液,调整OD600至0.4~0.6, 然 后 将pTRV2-CP-GV3101 和pTRV1-GV3101 发酵液等比混合,制备成发酵混合液TRV::CP。在烟草出苗后40 d(4 叶1 心)在苗盘剪叶时用喷壶喷施发酵液TRV::CP 于烟草正反叶片,每株喷施0.1 mL,发酵液处理7 株,设3 株对照(YEP培养基处理),3 次重复,共30 株。每隔7 d 剪叶时处理1 次,共处理3 次。最后1 次剪叶3 d 后移栽,移栽后10 d 取新生长出的最顶端心叶,充分表面消毒后提取总RNA,按照表1 中相应的引物CPF/CPR进行RT-PCR 检测。
1.6 PVY 和TRV RT-qPCR 检测
按照1.5 的方法获得TRV::CP 处理烟苗,同时将pTRV2-GV3101 和pTRV1-GV3101 发酵液等比混合制备成发酵混合液TRV::00;发酵液浓度为OD6000.4~0.6。试验设3 个处理,每个处理3 个重复,每个重复处理20 株烟。处理A:喷施发酵混合液TRV::CP;处理B:喷施发酵混合液TRV::00(空载体对照);处理C:喷施YEP 液体培养基 (CK)。烟苗处理后按照常规方法管理,3 d 后移栽入营养钵。
取-80℃冷冻保存含PVYN烟叶,按1:100 加磷酸缓冲液,捣碎过滤制备成悬浮液。上述3 个处理过的烟苗(移栽后7 d)每株选取中上部叶3 片,表面均匀撒碳化硅(600 目),毛笔蘸取悬浮液,叶面轻度摩擦接种,25℃左右温室中正常栽培管理。接种后7 d 开始取烟株上部新生长出的最顶端心叶样品,每隔7 d 取一次,共取5 次,充分表面消毒后,提取总RNA,参照TransGen Biotech 公司TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix 说明书反转成cDNA,以烟草NtEF1 基因(GenBank登录号AF120093.1)[20]为内参基因对不同样品的cDNA 含量进行调节,以PVYF/PVYR 引物进行荧光定量PCR 扩增检测沉默后处理烟株中PVY 累积量。
按照前述试验方法设置TRV::CP 和TRV::00 2个处理,发酵混合液最后一次处理后10 d 人工接种PVY,接种后7 d 开始取新生长出的最顶端心叶,每隔7 d 取一次,共取5 次,提取RNA,反转成cDNA,以烟草NtEF1 基因为内参基因,应用TRVF/TRVR 引物进行RT-qPCR 扩增,检测不同处理烟株中TRV 表达量。
1.7 盆栽试验防治PVY 效果
按照1.6 方法处理和接种PVY,温室接种15 d后开始病情调查,每隔10 d 调查1 次,共调查3 次,病情指数调查与分级,根据《烟草病虫害分级及调查方法》(GB/T 23222—2008)。按下列公式计算防治效果:
发病率=(发病株数/调查总株数)×100%;
病情指数=(Σ 各级病株数×病级)/(调查总株数×最高病级)×100;
防治效果=(对照病指-处理病指)/对照病指×100%。
1.8 田间小区试验防治PVY 效果
选取湖南省龙山县毛坪乡烟草试验基地的土壤肥力中等、排灌方便、历年PVY 发病较重的1200 m2试验地进行小区试验,试验地与其他地块隔离,覆地膜移栽,行株距1.2 m×0.5 m,田间管理参照当地优质烟叶生产规范。
按1.6 方法设3 个处理,于4 月25 日剪叶后立即喷施发酵混合液TRV::CP、TRV::00 和YEP 培养基处理烟苗。于5月4日移栽,田间每个处理3个重复 (小区),每个小区50 m2。于5 月25 日(移栽后20 d)按1.6 方法摩擦接种PVY,6 月10 日)接种PVY 后15 d)开始病情调查,每隔10 d 调查1 次,共调查3 次,按1.7 方法调查病情和计算防治效果。
2 结果与分析
2.1 含PVY CP 基因片段VIGS 表达载体构建

图2 VIGS 表达载体pTRV2-CP 的酶切鉴定Fig. 2 Identification of VIGS expression vector pTRV2-CP by restriction enzyme digestion
以PVY cDNA 为模板,PCR 扩增得到535 bp CP基因片段,连接到T 载体,再使用BamHI/KpnI 酶切后连接到pTRV2,获得pTRV2-CP 表达载体。PCR检测后提取重组质粒,进行测序和BamHI/KpnI 双酶切验证(图2)。将pTRV2-CP 表达载体转化农杆菌GV3101,经PCR 检测、测序验证,结果与CP 基因相应片段序列完全一致。
2.2 VIGS 表达载体侵染率的测定
将含发酵混合液TRV::CP 喷施处理烟株3 次,最后1 次喷施15 d 后观察烟株外观性状无异常,VIGS表达载体对烟草生长无明显影响。为防止原处理菌液的污染,侵染率检测取烟株上部新生长出的最顶端心叶,并充分洗净消毒,提取RNA,反转成cDNA,以CPF/CPR 为引物,RT-PCR 产物大小约为535 bp,测序结果与目标基因片段完全一致,说明VIGS 表达载体成功导入烟株。PCR 检测结果显示,TRV::CP 处理烟株21 株,其中20 株检测为阳性,1 株为阴性,侵染率达到95.24%,对照处理烟株全部为阴性(图3)。

图3 TRV::CP 处理烟株后pTRV2-CP PCR 检测结果(部分)Fig. 3 pTRV2-CP PCR detection results of tobacco plant treated by TRV::CP
2.3 PVY 和TRV 定量 RT-PCR 检测
以烟草NtEF1a 为内参基因进行定量RT-PCR 检测,验证烟草中pTRV2-CP VIGS 载体对PVY 的沉默程度。结果显示,人工接种PVY7 d 后,随着时间的推移,发酵混合液TRV::00 和对照处理的PVY 含量逐渐增加,发酵混合液TRV::CP 处理的PVY 含量在接种后28 d 达到最高,随后开始减少。接种PVY后14 d 开始,TRV::CP 处理的烟株PVY 的含量低于TRV::00 和对照处理的烟株,在接种PVY 后35 d,与TRV::00 相比,TRV::CP 处理的烟株PVY 累积量相对减少了72.8%(图4)。

图4 接种PVY 后不同时间烟草中的PVY 含量Fig. 4 PVY cumulative quantity in tobacco at different time after PVY inoculation
RT-qPCR 检测分析pTRV2-CP VIGS 载体在烟草中不同时期表达量的变化。结果显示,随着处理的时间推移,TRV 累积量上下波动,TRV::CP 处理在24 d 时最高,在31 d 时降至最低,然后逐渐上调;TRV::00处理在17 d时最高,在38 d时最低,然后上调。总体来看,VIGS 表达载体45 d 内能有效表达(图5)。

图5 表达载体处理不同时间烟草中的TRV 含量Fig. 5 TRV cumulative quantity in tobacco at different time after treated by fermentation broth
2.4 表型观察
在接种PVY 后15 d,发酵混合液TRV::00 处理烟株新叶出现脉明症状,逐渐可见轻微花叶,30 d 后叶片枯黄萎蔫,叶脉变为深棕色,45 d 后下部叶片枯黄、叶脉坏死;发酵混合液TRV::CP 处理烟株有明显脉明,上部叶有花叶症状,但叶脉不出现坏死(图6)。

图6 VIGS 表达载体处理30 天后烟草表型观察Fig. 6 Symptoms of tobacco plant treated by VIGS expression vector fermentation broth after PVY inoculation for 30d
2.5 VIGS 表达载体防治PVY 效果
在温室接种PVY 15 d 后开始病情调查,结果表明,随着处理时间延长,喷施发酵混合液TRV::CP、发酵混合液TRV::00 和对照(CK)的3 个处理发病率和病情指数逐渐升高,发酵混合液TRV::00 和对照(CK)处理发病较重,最高发病率达到100%,发酵混合液TRV::CP 相比TRV::00 和对照(CK)处理烟株发病率和病情指数显著较低,对PVY 的防效最高为85.12% (表2)。
2.6 VIGS 表达载体田间防治PVY 效果
田间病情调查结果表明,自第一次调查开始,发病率和病情指数逐渐升高,第三次调查时达到最高。喷施发酵混合液TRV::CP、TRV::00 和对照小区发病率分别为22.36%、86.67%和88.33%,发酵混合液TRV::CP 处理较TRV::00 和对照处理发病率和病情指数明显较低,发酵混合液TRV::CP 对PVY 田间小区防治效果达到73.08%(图7 和表3)。
3 讨论
培育抗性品种及采用基因克隆技术进行品种改良是防治PVY 病毒病有效方式之一。刘勇等[21-22]利用母本来源的单倍体技术获得抗PVY 的烟草株系,从烟草EMS 突变体库中筛选抗PVY 新资源。王贵等[23]进行了烟草PVY 抗性的遗传分析与分子标记筛选,郭兴启等[24]克隆了PVYN的CP 基因,获得7 株对PVYN高抗的转基因烟草,江彤等[24]利用dsRNA介导的抗病性获得抗PVY 的转基因烟草。近期研究者们基于烟草行业“基因组计划”,在克隆抗PVY基因、挖掘创制优异新种质和定向改良云烟87 品种PVY 抗性等方面取得了较好的进展,获得了多个抗PVY 新品种(系)。以上研究对防治PVY 提供了有效途径,也为本研究提供了较好的借鉴,但培育抗性品种一般需要5~8 年时间,烟草种植者掌握这些新品种栽培、烘烤特性还需要较长时间,新品种风格特征和感官质量如何满足工业企业原料配方需求也是一个难题,新品种应用到烟叶生产中仍是一个漫长的过程。本研究建立的防控烟草PVY 病毒病的VIGS 体系,周期短、成本低、操作简便,对烟草马铃薯Y 病毒病有较好的防治作用,是一种具有较好应用前景防治PVY 的方法。
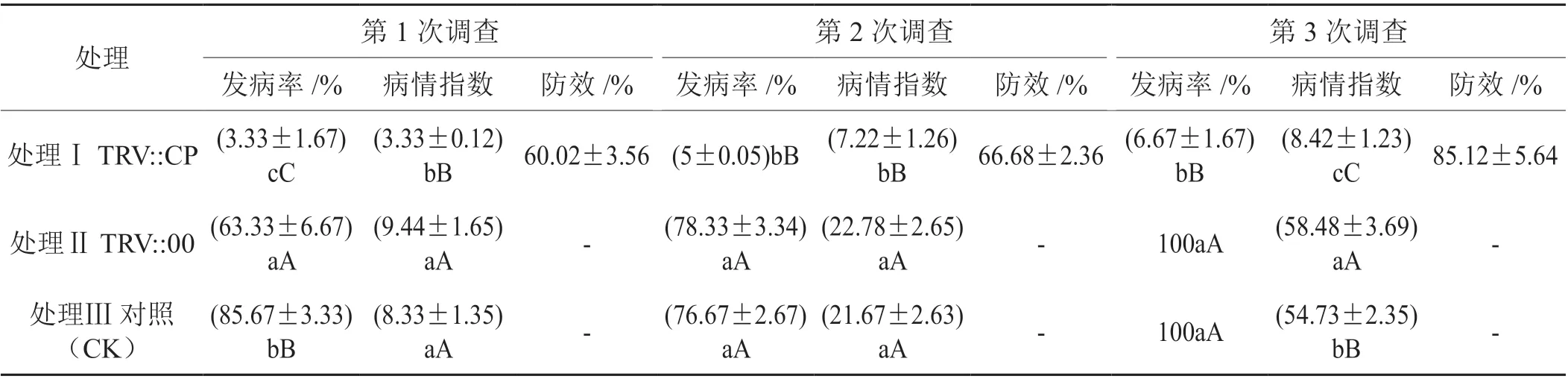
表2 发酵混合液TRV::CP 处理对PVY 的防效Tab. 2 Control effect of fermentation broth TRV::CP

表3 VIGS 表达载体田间防治PVY 的效果Tab. 3 Control effect of fermentation broth of VIGS expression vector in field

图7 VIGS 表达载体田间防治PVY 的效果(接种PVY 后45 d)Fig. 7 Control effect of fermentation broth of VIGS expression vector in field (45 d after PVY inoculation)
目前,应用于VIGS 的病毒载体达到40 种以上[26],相比TMV、PVX 等其他病毒载体,携带目标基因的TRV 衍生载体可以稳定迅速地侵染植物,且不产生TRV 病毒症状,已被广泛应用于马铃薯、大豆、小麦等植物VIGS 病毒载体构建[27]。VIGS 有效的沉默期是该技术应用的关键影响因素,有效的沉默期一般为30 d 左右[28-29],本研究45 d 左右不同处理烟株中TRV 的含量仍旧能够检测出,表明构建的VIGS 体系能够较长时间稳定表达。采用低温和低湿的方法可适当延长基因沉默的时间[30],在合适的条件下,VIGS 的作用能够持续几年甚至一直持续到植物死亡[32]。不同株龄的植株对农杆菌具有不同的敏感性。株龄过低,植株对农杆菌的抵抗力弱,操作难度大;株龄过高,植株对农杆菌敏感性低[32]。因此,适宜的接种时期对侵染效果有重要影响。本研究在剪叶时喷施农杆菌发酵液,此时烟叶幼嫩,且剪叶造成伤口利于侵染,因此可以获得较理想的沉默效率。生产上通常在烟苗4-5 叶期进行剪叶以促进生长平衡和生根,这与VIGS 技术的应用相契合,也为技术推广提供了便利。农杆菌菌体不易保存,操作环境复杂,货架期短,是VIGS 技术应用到实际生产中的主要瓶颈,建立并优化发酵技术和工艺,是今后努力的方向。
4 结论
建立的VIGS 体系能够有效沉默外源侵入的PVY CP 基因的表达,对烟草的侵染效率达到95.24%,沉默有效期达到45 d,对PVY 有良好的防治效果,温室盆栽和田间小区试验对PVY 防治效果分别为85.12%和73.08%。本研究结果为PVY 的防治提供了新的思路和方法,具有较好的应用前景。

