TPCK-胰蛋白酶酶解缢蛏工艺条件优化
张惠婷
(福建省产品质量检验研究院,福建 福州 350002)
多肽是具有特定氨基酸序列的生物活性物质[1],其消化吸收率及营养价值均优于蛋白质或氨基酸,且其所具有的生理功能氨基酸无法比拟[2],因此其也被称作为生物活性肽。生物活性肽的种类较多、分布较广[3]、食用安全性极高[4],它不但能够提供机体生长发育所需的营养物质,还具有抗高血压、调节免疫、抗细菌等多种功能[5]。将大分子的蛋白质酶解成小分子的多肽,不但能够提高蛋白质的消化利用率,而且还能得到不同功能的生物活性肽。
目前,生物活性肽常用的制备方法为酶解法[6]。在选择利用酶解法制备生物活性肽时,挑选富含蛋白质的原料进行酶解十分关键。缢蛏在福建又称蛏子,其资源丰富[7],分布广泛,富含蛋白质[8],在生物活性肽的研究方面具有极大的潜力。以资源丰富、富含蛋白质的缢蛏为原料制备生物活性肽,不但能够充分地利用缢蛏蛋白,有效地发挥缢蛏存在的营养价值,还能够充分利用缢蛏资源,具有极大的市场发展空间。
利用酶解法制备生物活性肽时,不同种类酶的选择可以得到不同的多肽。TPCK-胰蛋白酶是一种特异性的肽链内切酶,能够专一性地切割蛋白分子中精氨酸(Arg)、赖氨酸(Lys)位点[9]。采用具有专一性酶切位点的TPCK-胰蛋白酶对缢蛏蛋白进行酶解,可得到具有特定C末端残基的肽段。在酶解过程中对酶解工艺条件的控制,很大程度上影响酶解的效果。因此,本试验采用TPCK-胰蛋白酶对鲜缢蛏肉进行酶解,在单因素试验基础上,通过正交试验优选TPCK-胰蛋白酶的酶解工艺条件,为今后进一步研究制备缢蛏多肽提供数据参考。
1 材料与设备
1.1 材料
鲜活缢蛏:购于福建福州永辉超市;
TPCK-胰蛋白酶:购于上海国源生物技术有限公司,酶活性为1.1万U/mg(反应温度:37 ℃);
Gly-Gly-Tyr-Arg四肽标准品:购于美国Sigma公司;
其他试剂均为分析纯。
1.2 设备
PB-10型pH计:赛多利斯科学仪器(北京)有限公司;
TGL-16C台式离心机:上海安亭科学仪器厂;
BS 224S型电子分析天平:赛多利斯科学仪器(北京)有限公司;
T6新世纪紫外可见分光光度计:北京普析通用仪器有限责任公司。
2 试验方法
2.1 技术路线
鲜活缢蛏→去壳取鲜肉绞碎→酶解→灭酶→酶解液离心→取上清液→测定多肽含量
2.2 多肽提取量测定
凡具有两个直接连接的肽键都有双缩脲反应[10]。因此,本文酶解液中多肽提取量的测定方法参照文献[11,12]中的双缩脲测定法,并作适当修改。具体测定方法如下:
2.2.1 四肽(Gly-Gly-Tyr-Arg)标准曲线的制作
用5%(W/V)的三氯乙酸分别配制浓度梯度为0.0~1.0 mg/mL的四肽标准溶液,将不同浓度的四肽标准溶液与双缩脲试剂按体积比3∶2加入试管中,摇匀静置离心,取上清液测定OD值(540 nm)。
2.2.2 提取量测定
称取去壳的鲜缢蛏肉进行酶解,经灭酶、冷却后,将酶解产物全部转移至100 mL容量瓶中,定容离心获得上清液Ⅰ。取上清液Ⅰ与等体积的10%(W/V)三氯乙酸水溶液混合均匀,静置离心获得上清液Ⅱ。取上清液Ⅱ,用5%(W/V)的三氯乙酸水溶液定容于25 mL容量瓶中,获得样品溶液Ⅲ。将样品溶液Ⅲ与双缩脲试剂按体积比3∶2加入试管中,摇匀静置离心,取上清液测定OD值(540 nm)。通过所得的四肽回归方程,计算样品溶液Ⅲ中多肽的质量浓度C(mg/mL)。以下为多肽提取量的计算公式:
式中:
M表示多肽提取量,即每克新鲜缢蛏肉酶解得到的多肽毫克数,mg/g;
C为样品溶液Ⅲ中多肽的质量浓度,mg/mL;
V1为所吸取的上清液Ⅱ的体积,mL;
V2为样品溶液Ⅲ的体积,mL;
m为所称取新鲜缢蛏肉的质量,g;
2表示等体积的Ⅰ溶液与10%(W/V)的三氯乙酸水溶液混合后体积扩大的倍数。
2.3 TPCK-胰蛋白酶酶解工艺研究
2.3.1 TPCK-胰蛋白酶酶解工艺的单因素试验
准确称取一定质量新鲜的去壳缢蛏肉,以pH=7.8的缓冲溶液作为反应液,在水浴温度37 ℃条件下进行反应,分别考察酶解时间1.0、2.0、3.0、4.0、5.0、6.0 h、料液比1∶1.0、1∶2.0、1∶3.0、1∶4.0、1∶5.0、1∶6.0和酶添加量4500、9000、13500、18000、22500 U/g对多肽提取量的影响。按2.2.2的方法测定多肽提取量。
2.3.2 正交试验优选TPCK-胰蛋白酶的酶解工艺
在单因素试验的基础上,采用L9(34)正交试验设计,优选TPCK-胰蛋白酶的酶解工艺,试验因素及水平见表1。
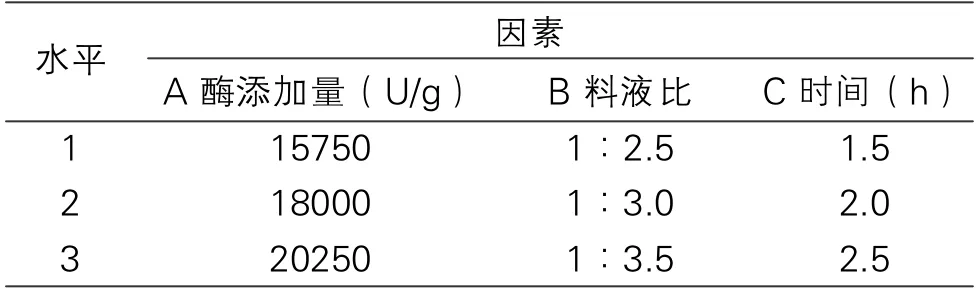
表1 TPCK-胰蛋白酶酶解正交试验因素及水平
3 结果与分析
3.1 四肽标准曲线的制作
按本文2.2.1方法,得四肽质量浓度(X)与其光密度(Y)之间的回归方程为:Y=0.1443X+0.0017,R2=0.9998,变量X的范围落在0~1 mg/mL之间。
3.2 TPCK-胰蛋白酶的酶解工艺研究及其优化
3.2.1 酶解时间对TPCK-胰蛋白酶酶解效果的影响
称取5 g新鲜去壳缢蛏肉,用pH值为7.8的缓冲溶液作为反应液,酶添加量为2250 U/g,料液比为1∶3.0,酶解温度为37℃条件下,分别酶解1.0、2.0、3.0、4.0、5.0、6.0 h,酶解结果如图1所示。由图1可知,酶解时间在1.0~5.0 h之间时,多肽提取量呈先上升后下降的变化趋势。当酶解时间为2.0 h左右时,多肽提取量达到单因素试验的最高水平。而当酶解时间大于5.0 h时,多肽提取量基本保持不变。这可能是由于TPCK-胰蛋白酶是一种特异性比较强的内切酶,随酶解时间的延长,酶解液中已没有适合TPCK-胰蛋白酶作用位点的肽段。因此多肽提取量最终趋于平衡不变的趋势。综上,酶解的时间选择为2.0 h左右较为适合。
3.2.2 料液比对TPCK-胰蛋白酶酶解效果的影响 称取5 g新鲜去壳的缢蛏肉,用pH值为7.8的缓冲溶液作为反应液,酶的添加量为2250 U/g,酶解温度为37 ℃条件下,分别按料液比1∶1.0、1∶2.0、1∶3.0、1∶4.0、1∶5.0、1∶6.0酶解2.0 h,酶解结果如图2所示。由图2可知,料液比从1∶1.0扩大至1∶6.0,多肽提取量呈先上升后下降的变化趋势。当料液比为1∶3.0时,多肽提取量达到单因素试验的最高水平。当料液比大于1∶3.0时,反应体系中溶液的增多,减少了TPCK-胰蛋白酶与底物蛋白碰撞接触的机会,导致多肽提取量下降。因此,料液比选取在1∶3.0左右。
3.2.3 酶添加量对TPCK-胰蛋白酶酶解效果的影响 称取5g新鲜的去壳缢蛏肉,用pH值为7.8的缓冲溶液作为反应液,酶解温度为37 ℃,料液比为1∶3.0,酶添加量为4500、9000、13500、18000、22500 U/g条件下,分别酶解2.0 h,酶解结果如图3所示。由图3可知,在一定范围内,随酶添加量的增加,多肽提取量也相应增加。当酶添加量为18000 U/g时,多肽提取量达到单因素试验的最高水平。当酶添加量大于18000 U/g时,多肽提取量反而开始降低。这可能是由于TPCK-胰蛋白酶将缢蛏蛋白反应完全后,酶解液中还有适合酶切位点的肽段,TPCK-胰蛋白酶对这些肽段进行酶解,使之降解成游离氨基酸,导致多肽提取量降低。综上,TPCK-胰蛋白酶的酶添加量选择为18000 U/g左右。
3.2.4 TPCK-胰蛋白酶酶解工艺的正交试验优化结果
通过对表2中极差R值进行比较可知,本试验的3个因素对多肽提取量影响的主次顺序为:A>B>C,即酶添加量的影响最大,酶解时间的影响最小。由K值比较得最优水平为:A2B3C2。
应用DPS数据处理系统对表2所得数据进行方差分析,分析的结果见表3。由表3可知,本试验所选取的3个因素对多肽提取量的影响顺序为:A>B>C,与表2极差分析的结果相一致。由方差分析结果可知,本试验3个因素对缢蛏多肽提取量都具有显著的影响。其中,A因素即酶的添加量的影响极显著。综合极差分析与方差分析的结果,选择A2B3C2为最优组合。
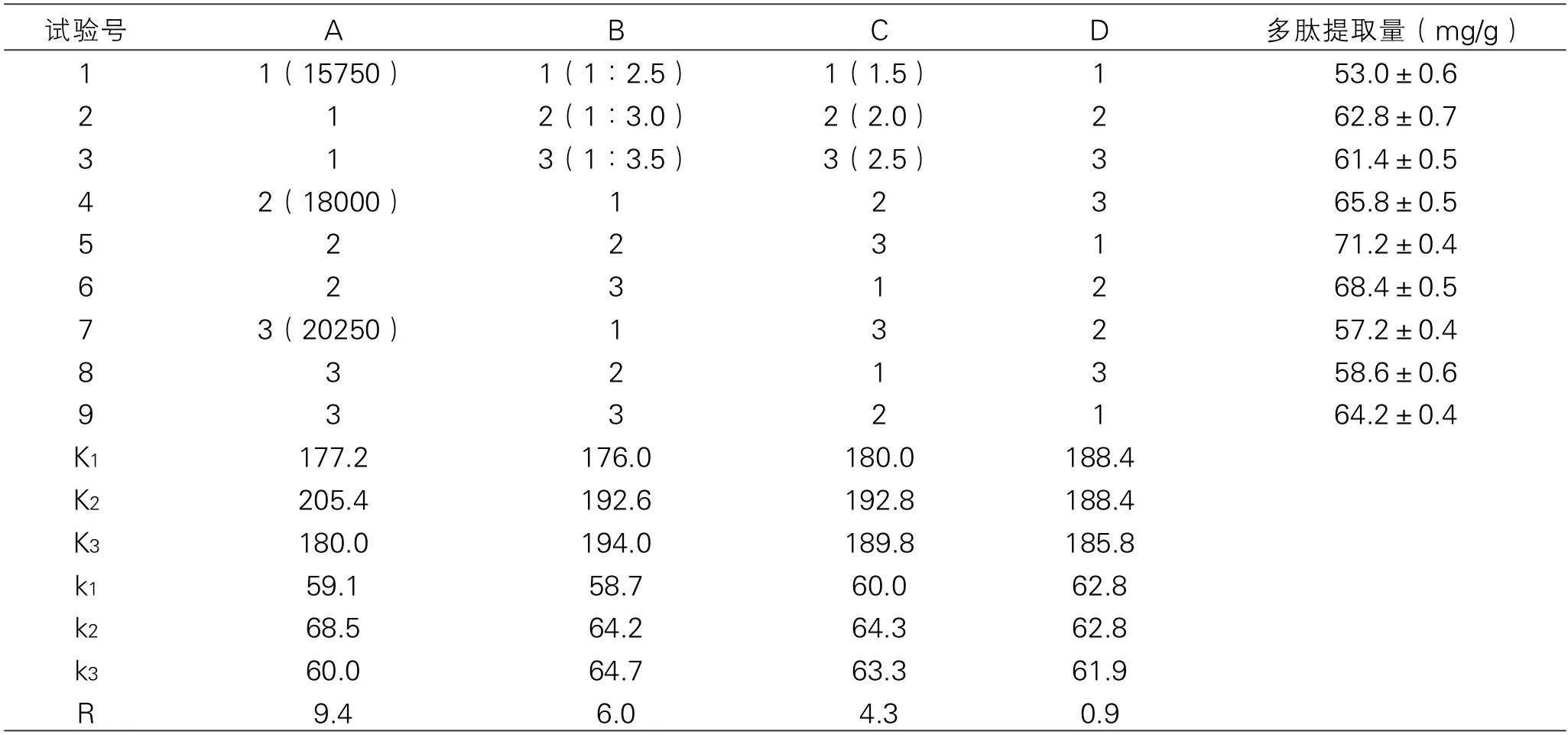
表2 TPCK-胰蛋白酶酶解正交试验结果
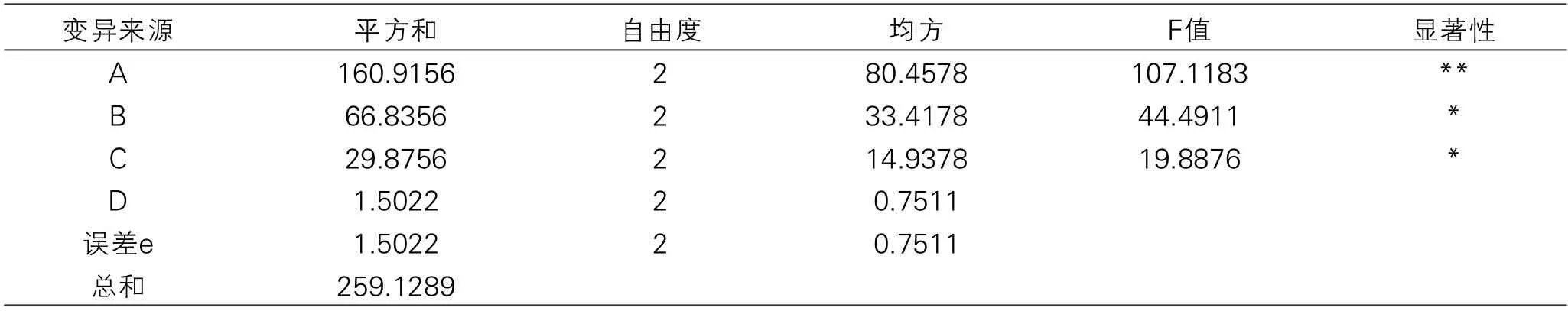
表3 TPCK-胰蛋白酶酶解正交试验方差分析
以优化所得的组合A2B3C2进行3组验证试验,试验结果表明,在最优组合下,缢蛏多肽的平均提取量可达(71.6±0.4)mg/g,表明该酶解工艺优化成功。
4 结论
本研究以多肽提取量为指标,在单因素试验的基础上,通过正交试验优选TPCK-胰蛋白酶酶解缢蛏的工艺条件,结果表明:
TPCK-胰蛋白酶酶解缢蛏的最佳酶解工艺为:pH=7.8、酶添加量18000 U/g、料液比(m∶V)为1∶3.5、酶解温度37 ℃、酶解时间2.0 h。在此最优酶解的工艺条件下,每克去壳鲜缢蛏肉可提取(71.6±0.4)mg多肽。在对TPCK-胰蛋白酶酶解缢蛏的工艺条件进行显著性分析时,发现酶添加量、料液比、酶解时间对TPCK-胰蛋白酶酶解缢蛏的效果都具有显著影响,因此在TPCK-胰蛋白酶酶解缢蛏的过程中,应注意酶添加量、料液比、酶解时间的控制。

