反映时代性 坚持科学性——新冠肺炎相关试题选登
本刊编辑部整理
一、有关消毒剂的试题
【例1】(改编)某化学兴趣小组的同学买来一瓶“84”消毒液,请与他们一同来研讨以下问题:
(1)此瓶“84”消毒液的说明书上这样写道:“本品为无色液体,呈碱性……”,请你推测它的有效成分________(填序号)。
A.Cl2B.H2O2C.NaClO D.KMnO4
(2)该小组的同学在瓷碗中盛放20 mL“84”消毒液,露置在阳光充足的室内,他们对“84”消毒液的消毒效果和组成成分的变化进行了研究。得出的数据如图所示:

图1
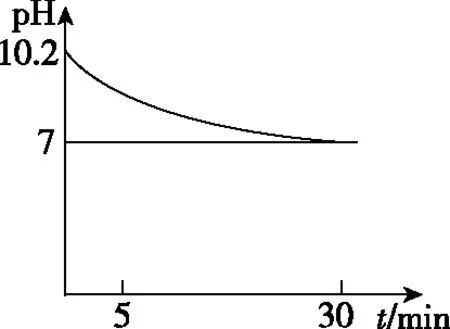
图2
从图1和图2可知暴露在空气中半小时后,“84”消毒液中的主要溶质是________,用化学方程式表示其中变化的主要原因:____________________________。
(3)该化学兴趣小组的同学备选了紫色石蕊试液对“84”消毒液的性质进行实验检验,请你帮助他们完成实验报告:

实验操作预期现象结论
(4)该化学实验小组同学上网查询有关“84”消毒液的信息时,发现这样一则消息:有一位家庭主妇把“84”消毒液和洁厕剂(主要成分是浓盐酸)都倒出一些混合在一起,进行刷洗。一会儿,她就晕倒在房间里,这几位同学感到迷惑不解。请你用离子方程式帮助他们解开这一悬念:________________________。
【答案】(1)C
(3)

实验操作预期现象结论取一干净试管,加入1~2毫升“84”消毒液,然后滴加几滴紫色石蕊试液先变蓝后褪色“84”消毒液具有碱性和氧化性(或漂白性)

【解析】(1)NaClO水解导致其溶液呈碱性;次氯酸盐有强氧化性,有消毒杀菌功能。
(2)从图1看,30 min后,溶液已无消毒效果,说明NaClO 已经反应完;从图2看,30 min后,溶液已经呈中性。HClO的酸性比碳酸酸性弱,NaClO的溶液在空气中能与CO2反应,生成Na2CO3和HClO,HClO见光分解生成的HCl与Na2CO3反应生成NaCl。
(3)“84”消毒液呈碱性,能使紫色石蕊试液变蓝;有强氧化性,又能使溶液褪色。
(4)在酸性条件下,ClO-能氧化Cl-,生成的Cl2使人中毒。
【例2】过氧乙酸是一种广泛用于医院、地面、门窗、汽车等方面的消毒液。下面是市售过氧乙酸商品的标签:

过氧乙酸甲、乙溶液各500 mL用法:把本品甲溶液1份,乙溶液1份,在玻璃或塑料容器内混合放24小时,即可稀释使用技术要求含量不少于10%,一般可以用50倍纯水稀释使用(浓度为0.2%)
(1)配制过氧乙酸消毒液的甲、乙溶液的主要成分各是什么?某校研究性学习小组为此进行了以下研究,请你完成下列相关内容:
①查阅资料:过氧乙酸消毒液是由H2O2、H2O、CH3COOH及少量H2SO4混合后,反应生成过氧乙酸(CH3COOOH)为主要消毒成分的溶液。CH3COOOH容易放出原子氧,它与空气中微生物机体作用,达到灭菌目的。H2O2在酸性介质中稳定,是一种强氧化剂。
②提出假设:______________。
③实验验证:

实验主要步骤实验主要现象
④得出结论:______________。
(2)某部门根据消毒要求,急需配制0.2%过氧乙酸消毒液1 m3,需要购进甲溶液________瓶,乙溶液________瓶。
【答案】(1)②甲溶液的主要成分是H2O2、H2O、H2SO4,乙溶液的主要成分是CH3COOH、H2O(甲和乙可对换)
③操作步骤:取少量甲、乙溶液,分别加入几滴紫色石蕊试剂,充分振荡
实验现象:甲溶液先变成红色,后又褪为无色;乙溶液由无色变成红色。
④甲溶液的主要成分是H2O2、H2O、H2SO4,乙溶液的主要成分是CH3COOH、H2O
(2)20 20
【解析】(1)过氧乙酸是一种由甲、乙两溶液现配现用的消毒液,H2O2和CH3COOH能反应,配制前H2O2和CH3COOH肯定不能存在于同一溶液中。H2O2在强酸性溶液中更稳定,适宜将H2SO4和H2O2放在同一溶液中(设为甲)。甲溶液既有酸性又有强氧化性,乙溶液只有酸性,据此可设计实验验证。
(2)这是一个联系实际的估算题。设需要购进甲溶液和乙溶液都为x瓶,则两种溶液的总体积为2x×500 mL=1 000xmL,50倍纯水的体积为1 000x×50 mL=50 000xmL,由题意可得方程:(1 000x+50 000x) mL=1×106mL,解得x≈20瓶。
【例3】开发具有广谱、高效、低毒的杀菌、消毒剂是今后发展的趋势。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是________。(填序号)
A.Cl2B.H2O2C.ClO2D.O3
(2)氯氨(NH2Cl)可作为杀菌剂,请用化学方程式表示氯氨在水中的杀菌机理:______________。
(3)氯溴海因(C5H6BrClN2O2)是一种比较安全的氯气和氯制剂的替代产品。氯溴海因在水中的水解过程比较复杂,主要是水解生成次卤酸和海因,请画出海因的结构式:
______________。
(4)过碳酸钠是一种有多用途的新型氧系固态消毒剂,化学式为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。


【答案】(1)C

(4)①KHCO3H2O2是氧化剂,其产物是H2O;H2O没有污染性

(5)6.02×1023
【解析】(1)等物质的量时,ClO2可得到的电子最多,消毒效率最高。
(2)NH2Cl与水解生成的HClO和NH3,HClO有强氧化性,具备杀菌作用。
(3)氯溴海因在水中水解主要生成次卤酸和海因,即氯溴海因分子中的卤素原子(Cl、Br)被水中的氢原子取代,然后卤素原子与水中的羟基(-OH)结合为HXO。


(6)该反应是歧化反应,HClO2中+3价的氯元素一部分升高到ClO2中的+4价,一部分降低到-1价。当有1 mol ClO2生成时,反应中失去的电子为1 mol,即转移1 mol 电子,转移的电子数约为6.02×1023。
【作者单位、姓名】江苏省常州市横山桥高级中学 李万春
二、医疗防护相关试题
【例4】(改编)2020年在抗击新冠肺炎过程中穿的医用防护服就掺杂“纳米银”材料。“纳米银”不仅具有很强的杀菌消毒能力,当大量聚集到一定程度时,能在空气中发生自燃。下列有关叙述不正确的是
( )
A.纳米是长度单位,1 nm等于1×10-9m
B.10纳米银颗粒与水形成的均匀分散系具有丁达尔效应
C.常温下,“纳米银”与银片的还原性相同
D.物质的颗粒达到纳米级时,具有特殊的性质
【答案】C
【解析】纳米是长度单位,1 nm等于1×10-9m,A正确;胶体分散系分散质的直径在1~100 nm之间,10纳米银颗粒与水形成的均匀分散系是胶体,胶体具有丁达尔效应,B正确;将铜制成纳米铜时具有非常强的化学活性,在空气中可以燃烧,说明常温下“纳米银”比银片更容易失去电子,C错误;物质的颗粒达到纳米级时,纳米材料具有奇特的光、电、磁、热。力和化学方面的性质,D正确;故选C。
【作者单位、姓名】山东省垦利第一中学 孙海清
三、抗新冠病毒药物合成类试题




回答下列问题:
(1)A的结构简式为____________,C的含氧官能团为____________。G的官能团名称为____________。

(3)写出C与NaOH反应的化学方程式为____________________________。
(4)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。B与足量的氢气加成后的产物为X,指出X的结构中的手性碳,用“*”标注________。
(5)M是与H互为同分异构体,符合下列条件的M有________种,其中核磁共振氢谱显示环上只有3组峰,且峰面积之比为4∶4∶1,写出符合条件的结构简式________。

②酸性水解产物中含有乙酸
③能发生酯化反应


(2)还原反应 取代反应









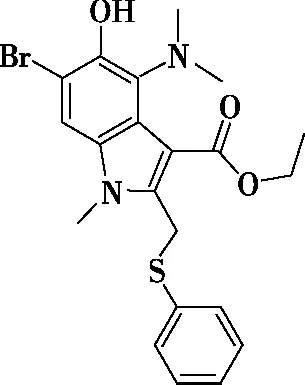

回答下列问题:
(1)盐酸阿比朵尔的含氧官能团名称为________,H的分子式为________。

(4)芳香化合物M是D的同分异构体,满足下列条件的M有________种,写出其中有五种不同化学环境的氢,个数比为2∶2∶2∶2∶1的结构简式为________。
①含有氨基(—NH2)
②既能水解,又能发生银镜反应

【答案】(1)酯基、羟基 C19H18BrNO3S
(2)浓硫酸、浓硝酸、加热 还原反应 取代反应




——推动了照片保护与修复的研究

