全国卷化学有机实验综合题的命题特点和复习指导
福建 陈女婷 新疆 张新芹
一、有机制备实验综合题的考查角度和命题特点
1.考查角度
笔者分析近几年全国卷高考有机实验综合题的考查情况结果详见表1,发现2012~2014年连续3年考查以有机物制备为载体的实验综合题。但是由于有机制备实验的基本装置、基本操作、实验步骤等都比较相似,命题模式和考查方式也相对比较固定,因此,有机制备实验综合题已经许久没有出现在全国卷中。2019年全国卷Ⅱ和卷Ⅲ继续出现了对有机制备综合实验题的重点考查。

表1 近几年全国卷有机实验综合题的考查情况
2.命题特点
有机制备实验综合题常以大学有机化学或中学化学实验中陌生有机物的制备为命题载体,命题形式上紧扣有机物的制备流程:制备合成→分离提纯→获得目标产物。命题落脚点主要集中在实验仪器和装置名称或作用、合成条件的分析与控制、实验关键步骤的操作、粗产物的分离与提纯、合成有机物产率的计算等方面。
二、有机制备综合实验典型例题分析
【例1】(2019·全国卷Ⅲ·27)乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:
水杨酸 醋酸酐 乙酰水杨酸
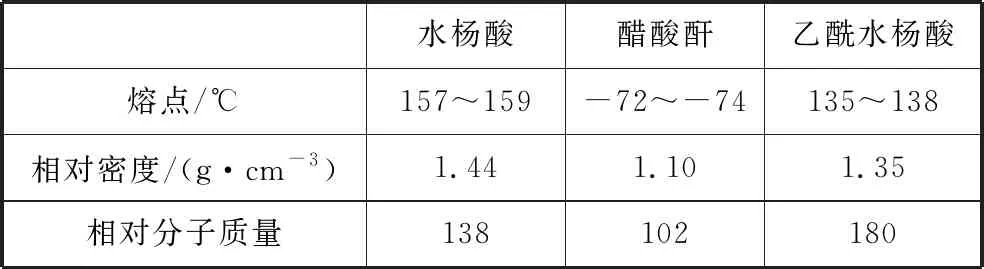
水杨酸醋酸酐乙酰水杨酸熔点/℃157~159-72~-74135~138相对密度/(g·cm-3)1.441.101.35相对分子质量138102180
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70℃左右,充分反应。稍冷后进行如下操作:
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。
回答下列问题:
(1)该合成反应中应采用________(填标号)加热。
A.热水浴 B.酒精灯 C.煤气灯 D.电炉
(2)下列玻璃仪器中,①中需使用的有________(填标号),不需使用的________(填名称)。

B

D
(3)①中需使用冷水,目的是______________。
(4)②中饱和碳酸氢钠的作用是______________,
以便过滤除去难溶杂质。
(5)④采用的纯化方法为________。
(6)本实验的产率是________%。
【答案】(1)A
(2)BD 分液漏斗,容量瓶
(3)充分析出乙酰水杨酸固体(结晶)
(4)生成可溶的乙酰水杨酸钠
(5)重结晶
(6)60
1.命题立意和价值
(1)体现应用性,强化价值导向
乙酰水杨酸(阿司匹林)的提取具有重要的产业化价值。试题以大学教材经典的有机制备实验“水杨酸进行乙酰化制备阿司匹林”为背景,体现化学学科的应用价值和实验方法在解决实际问题中的重要作用。乙酰水杨酸(阿司匹林)的制备反应及用途在选修1 《化学与生活》中有所涉及。
(2)体现基础性,考查必备知识
试题起点较高,以典型有机物的制备“乙酰水杨酸(阿司匹林)的提取”为情境素材,但落点和难度较为适中。命题落脚点主要集中在实验仪器和装置的名称及作用、合成条件的分析与控制、实验操作的关键步骤、粗产物的分离与提纯、合成有机物产率的计算等。
(3)体现综合性,考查关键能力
试题以文字形式介绍乙酰水杨酸制备的简要实验流程,以表格信息的形式提供水杨酸、醋酸酐和乙酰水杨酸的物理参数,并提供制备乙酰水杨酸的化学反应方程式,考查学生的获取、加工信息的能力和现场学习能力。要求学生在系统把握“物质制取程序”和“化学实验体系三要素”(物质体系、仪器体系和操作体系)的基础上综合解决有机合成实验操作的一系列问题。
2.试题考点及解析
(1)本小题考查合成条件的分析与控制,即合成反应采用的加热方式。反应温度在70℃左右,低于水的沸点,且需维持温度不变,故采用热水浴加热。
(2)本小题考查实验仪器的选择,即①中使用的仪器及仪器的名称。操作①需用烧杯量取和存放冷水,并进行过滤,故需用到烧杯、漏斗,无需使用分液漏斗、容量瓶。
(3)本小题考查实验试剂的作用,即①中使用冷水的作用。反应时温度较高,水杨酸和乙酰水杨酸的熔点分别为157~159℃、135~138℃,使用冷水可降低混合液的温度并降低有机物的溶解度,有利于乙酰水杨酸固体析出。
(4)本小题考查实验试剂的作用,即②中饱和NaHCO3溶液的作用。乙酰水杨酸难溶于水,为除去其中的杂质,可将生成的乙酰水杨酸与NaHCO3溶液反应生成可溶性乙酰水杨酸钠。
(5)本小题考查分离与提纯的方法,即④中采用的提纯方法。每次结晶过程中会有少量杂质一起析出,可通过重结晶的方法进行纯化。
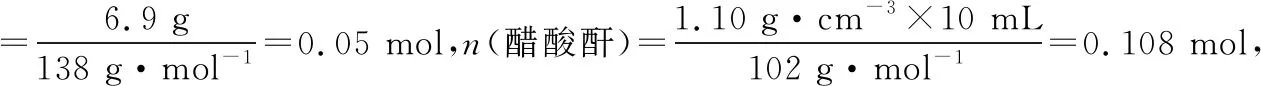
3.解题思维流程
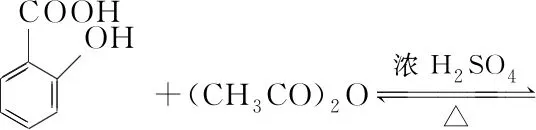
水杨酸 醋酸酐

乙酰水杨酸
合成反应(锥形瓶、水浴装置)、过滤(烧杯、漏斗、玻璃棒)
该制备反应为可逆反应,故生成的乙酰水杨酸、乙酸中会混有水杨酸、醋酸酐、硫酸等杂质
信息:熔点(乙酰水杨酸>100℃、水杨酸>100℃、醋酸酐<0℃)和溶解性(乙酸、硫酸易溶于水)
除杂方案:水洗(冷水可除去乙酸、硫酸、醋酸酐,析出固体水杨酸和乙酰水杨酸)→盐洗(饱和NaHCO3将水杨酸、乙酰水杨酸分别转化成可溶性水杨酸钠、乙酰水杨酸钠,混有NaHCO3)→盐酸(生成乙酰水杨酸固体、水杨酸固体,混有NaCl、HCl)→过滤(得到乙酰水杨酸固体、水杨酸固体)→重结晶(得到乙酰水杨酸固体)

4.制备实验模型

三、解答有机制备实验综合的思维流程

认真审题和解读题给信息,依据实验要求确定有机物制备的反应原理;分析反应特点(如可逆反应等)及可能发生的副反应
选择合适的实验仪器和装置,达到控制反应条件的目的;通过分析装置的特点及物质的制备原理,确定每个装置的作用
依据有机物的制备原理,确定反应物、生成物的成分,并推测可能发生的副反应,利用题目提供的各物质的溶解性、密度等信息判断产品中可能混有的杂质
依据产品和杂质的性质差异(如溶解度、熔沸点、密度、物质状态等)选择合适的分离提纯方法,常见的除杂步骤的大体顺序为水洗→(酸/碱/盐)洗→水洗→干燥→蒸馏

四、有机制备实验解题模型的建构

五、有机物制备实验综合题的变式练习
苯甲醛是一种重要的化工原料,某小组同学利用如图所示实验装置(夹持装置已略去)制备苯甲醛。


有机物化学式沸点/℃密度/(g·cm-3)相对分子质量溶解性苯甲醛CHO178.11.04106微溶于水,易溶于乙醇、醚和卤代烃苯甲醇CH2OH205.71.04108微溶于水,易溶于乙醇、醚和卤代烃二氯甲烷CH2Cl239.81.3385难溶于水,易溶于有机溶剂
实验步骤:
①向容积为500 mL的三颈烧瓶中加入90.0 mL质量分数为5%的NaClO溶液(稍过量),调节溶液的pH为9~10后,加入3.0 mL苯甲醇、75.0 mL二氯甲烷,不断搅拌。
②充分反应后,用二氯甲烷萃取水相3次,并将有机相合并。
③向所得有机相中加入无水硫酸镁,过滤,得到有机混合物。
④蒸馏有机混合物,得到2.08 g苯甲醛产品。
请回答下列问题:
(1)仪器b的名称为__________,电动搅拌棒的作用是
______________。
(2)苯甲醇与NaClO反应的化学方程式为________________________。
(3)步骤①中,投料时,NaClO不能过量太多,原因是
______________;步骤③中加入
无水硫酸镁的目的是______________。
(4)步骤②中,应选用的实验装置是________(填字母代号),该操作中分离出有机相的具体操作方法是______________________。

A

B

C

D
(5)步骤④中,加热蒸馏时应收集________左右的馏分。
(6)本实验中,苯甲醛的产率为________(保留到小数点后一位)。
【答案】(1)球形冷凝管 使物质充分混合,反应更充分
(3)防止苯甲醛被氧化为苯甲酸,使产品的纯度降低 除去少量的水(干燥),提高产品纯度
(4)C 打开分液漏斗颈部的玻璃塞(或使玻璃塞上的凹槽对准分液漏斗上的小孔),再打开分液漏斗下面的活塞,使下层液体慢慢沿烧杯内壁流下,当有机层恰好全部放出时,迅速关闭活塞
(5)178.1℃
(6)67.9%

【解题思维流程】



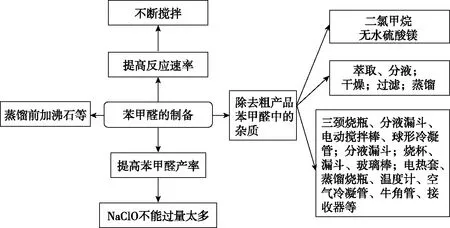
三颈烧瓶(分液漏斗、电动搅拌棒、球形冷凝管)、分液(分液漏斗)、过滤(烧杯、漏斗、玻璃棒)、蒸馏装置(电热套、蒸馏烧瓶、温度计、空气冷凝管、牛角管、接收器)
生成的苯甲醛、NaCl会混有未反应完全的苯甲醇、NaClO;同时,若NaClO过量太多则苯甲醛会进一步被氧化成苯甲酸
题干信息:二氯甲烷易溶于苯甲醛、苯甲醇,难溶于水
除杂方案:萃取、分液(二氯甲烷萃取水相,分液后有机相为苯甲醛、苯甲醇、苯甲酸、二氯甲烷和少量水)→干燥(无水硫酸镁,除去有机物中的少量水)→过滤(除硫酸镁固体,得苯甲醛、苯甲醇、苯甲酸、二氯甲烷的混合物)→蒸馏(收集178.1℃左右馏分,得到苯甲醛)

【制备实验模型】
六、有机物制备实验综合题的考查趋势预测


