可注射型华通胶光交联水凝胶用于组织工程软骨再生的实验研究
徐松山 赵少华 菅炎鹏 刘伟杰 王一公 张伟
各种原因(如肿瘤、外伤、先天畸形等)引起的软骨缺损临床较为常见,但软骨的自我修复能力极为有限,可严重影响患者生活质量[1]。组织工程技术的快速发展为解决这一难题提供了新的思路[2]。组织工程技术有望通过自体细胞构建出具有特定形状、合适力学强度和生物学功能的理想软骨组织,使患者获得结构和功能重建。理想的载体材料是组织工程软骨构建的关键之一。
研究表明,脐带华通胶富含胶原、透明质酸和糖胺聚糖等,且无血管分布、神经支配和淋巴回流[3]。此外,华通胶可保护脐带血管免受外力挤压,从而保障正常的脐带血运,该作用与关节软骨缓冲受力,减少变形、损伤及摩擦的作用相似,故而华通胶在成分、结构、功能上均与软骨组织类似。因此,华通胶有望成为软骨组织工程中载体材料的理想来源。
可注射的水凝胶在软骨再生方面具有巨大的优势,如细胞或药物可以均匀包裹在水凝胶内,用于填充不规则缺损,水凝胶原位成形有利于水凝胶与组织的结合[4]。近年来,温敏水凝胶已经成功制备,但其凝胶化时间较长。光交联水凝胶可以在软骨缺损部位注射水凝胶前驱体并随即快速凝胶化,在临床上显示出巨大的应用前景。因此,光交联水凝胶是软骨组织工程中载体材料的理想形式。
本研究拟将华通胶制备成可注射的光交联水凝胶,并对其进行流变学及溶胀率检测;随后复合软骨细胞进行体外培养,观察华通胶光交联水凝胶的细胞相容性;最后将该软骨细胞-华通胶光交联水凝胶复合物植入裸鼠皮下培养2周和6周,以探索华通胶光交联水凝胶用于构建组织工程软骨的可行性。
1 材料与方法
1.1 实验动物、实验试剂及仪器
6周龄新西兰白兔1只(上海甲干生物科技有限公司),体质量约2.5 kg,雌雄不限。6周龄BALB/c裸鼠6只(上海斯莱克实验动物有限责任公司),雌雄不限。本实验遵守实验动物伦理原则。
光交联水凝胶引发器(华东理工大学),胰蛋白酶、高糖DMEM培养基、胎牛血清、青霉素-链霉素-两性霉素B、磷酸盐缓冲液(Hyclone公司,美国),木瓜蛋白酶溶液(Sigma,美国),DNA含量检测试剂盒(天根生化科技有限公司),GAG阿尔新蓝法检测试剂盒(生工生物工程股份有限公司),总胶原蛋白检测试剂盒(北京博蕾德生物科技有限公司)。
流变仪(Anton-Paar MCR302,上海智鸢机电设备有限公司),压缩测试仪(Instron公司,美国),核酸蛋白质定量检测器(Nanodrop2000,Thermo公司,美国)。
1.2 华通胶水凝胶的制备
收集新鲜健康的人脐带(获捐赠者知情同意,并经潍坊医学院伦理委员会批准)。无菌条件下,去除脐带内的动静脉,剥除脐带外面的膜,可获取胶冻样的华通胶组织。把获得的华通胶置于1 mol/L的NaOH溶液中,室温条件下脱细胞处理4 h,乙酸调节pH值至7.0。将上述脱细胞后的华通胶加入匀浆机内,然后加入5倍体积的无菌三蒸水,在4 ℃下进行充分搅拌粉碎,充分冻干后即可制成华通胶粉末。随后将0.08 g光交联水凝胶[5]和0.16 g华通胶粉末溶解在1 mL PBS中,置于37 ℃条件下充分混匀制成华通胶光交联水凝胶。
1.3 华通胶光交联水凝胶的流变学特性
用流变仪检测华通胶光交联水凝胶在室温下的流变性能。用动态流变学法测定华通胶光交联水凝胶在365 nm、30 mW/cm2紫外光下照射400 s的贮存模量(G′)和损耗模量(G″)。
1.4 华通胶光交联水凝胶的溶胀率检测
将l.0 mL按上述方法制备的华通胶光交联水凝胶加入含有10 mL PBS的离心管中,分别于20、40、60、80和100 h后取出样本并且记录对应体积,记为Vt,初始水凝胶体积记为V0,溶胀率定义为Vt/V0。每个样本平行测量3次。
1.5 原代软骨细胞的分离培养及扩增
无菌条件下取2月龄新西兰兔的耳软骨,用眼科剪将软骨块剪碎后加入Ⅱ型胶原酶,用吸管充分吹打混匀后,置于37 ℃、5%CO2、饱和湿度的培养箱中消化8 h;加入8 mL的H-DMEM培养液(含10% FBS,下同)终止消化,充分吹打混匀后收集至15 mL的离心管中,1 800 r/min离心5 min,弃上清,加入7 mL培养液,充分吹打混匀,取混悬液分至培养瓶中,置培养箱培养。24 h后进行首次换液,之后隔日换液。显微镜下观察细胞生长情况,当细胞生长至培养瓶底部的70%~80%后,胰蛋白酶消化细胞,进行传代培养。取第2代细胞备用。
1.6 软骨细胞-华通胶光交联水凝胶复合物体外构建
将软骨细胞制备成5.0×108个/mL的细胞混悬液,取100 μL混悬液与900 μL的华通胶光交联水凝胶均匀混合,随后用365 nm、30 mW/cm2紫外光照射90 s后加入含10%FBS的H-DMEM培养液至覆盖复合物,于37 ℃、5%CO2、饱和湿度下培养。培养3 d后进行活死细胞染色,荧光显微镜下观察拍照。
将体外培养3 d的软骨细胞-华通胶光交联水凝胶复合物以4%多聚甲醛固定24 h,脱水、石蜡包埋,切片(厚度为5 μm),HE染色观察软骨细胞在水凝胶里的分布情况。
另外,将体外培养1、5、9 d的上述复合物,置于木瓜蛋白酶溶液中,65 ℃消化12 h。根据试剂盒方法,在乙醇提取和吸附柱吸附后,在洗脱缓冲液中回收基因组DNA。用核酸蛋白质定量检测器检测DNA含量。
1.7 软骨细胞-华通胶光交联水凝胶复合物裸鼠体内构建软骨
6只裸鼠麻醉后背部剃毛消毒,做1 cm皮肤切口,分离皮下组织形成一个小腔隙。将体外培养9 d的软骨细胞-华通胶光交联水凝胶复合物植入该腔隙中,缝合伤口。术后分笼饲养,常规喂食,自由活动。分别于术后2周和6周取材,行大体观察和组织学检测。
体内分别培养2周和6周的标本,进行大体观察后将标本以4%多聚甲醛固定24 h,脱水、石蜡包埋,切片(厚度为5 μm),HE染色及Safranin-O染色观察组织结构及细胞外基质分泌情况。用免疫组织化学的方法检测Ⅱ型胶原(软骨组织特异性细胞外基质)的表达情况,进一步证明构建组织的软骨表型[6]。
取体内培养2周、6周的标本,修剪成直径0.8 cm的圆形小块,置于压缩测试仪上,沿垂直气管壁方向以1 mm/min的速度压缩,直到样本组织变形。记录力与、位移曲线和最大拉断力,并计算杨氏模量。
分别将体内培养2周、6周及空白对照组(正常的新西兰大白兔耳软骨)的标本各50 mg置于木瓜蛋白酶溶液中,65 ℃消化12 h。根据试剂盒方法,用阿尔新蓝法检测硫酸化糖胺聚糖(GAG)含量[7]。在乙醇提取和吸附柱吸附后,在洗脱缓冲液中回收基因组DNA。用核酸蛋白质定量检测器检测DNA含量。用羟脯氨酸测定法检测总胶原含量。通过碱水解制备样品,根据先前描述的方法测定游离羟脯氨酸水解产物[8]。以上所有样品的分析重复3次。
1.8 统计学分析
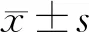
2 结果
2.1 华通胶光固化水凝胶的流变特性和溶胀率
可注射的水凝胶应该具有一定的流变学特性。检测显示华通胶光交联水凝胶表现出剪切变稀行为(图1A),这对于可注射水凝胶的连续流动是必要的。此外,该水凝胶的存储模量(G')随着紫外照射时间的延长而增加(图1C、1D),表明该水凝胶是在光引发交联后形成的,通过控制紫外光照射时间可以调节该水凝胶的存储模量(G′)。溶胀率检测显示该水凝胶在20 h达到平衡溶胀状态,最高溶胀率约为1.2(图1B)。

A:水凝胶在25 ℃的黏度;B:水凝胶的溶胀率;C:水凝胶在不同时长紫外照射下的动态存储模量和损耗模量; D:水凝胶在10、100、200 s时长紫外照射下的存储模量 (*: P<0.05)A: Viscosity of the hydrogel at 25°C; B: Swelling ratio of the hydrogel; C: Dynamic modulus (G′and G″) of the hydrogel under UV irradiation at varying time; D: Storage modulus (G') of the hydrogels under UV irradiation at 10, 100, and 200 s (*: P<0.05)图1 华通胶光交联水凝胶的流变性质及溶胀率Fig. 1 The rheological properties and swelling ratio of Wharton's jelly photo-crosslinking hydrogel
2.2 华通胶光交联水凝胶的细胞相容性
良好的细胞相容性是水凝胶构建组织工程软骨的前提条件。活死细胞染色结果显示,在接种软骨细胞后的第3天,软骨细胞在华通胶光交联水凝胶中能很好存活(图2A)。DNA含量检测结果也表明软骨细胞在该水凝胶中能很好存活并且增殖,进一步说明该水凝胶具有良好的细胞相容性(图2B)。此外,HE染色显示软骨细胞均匀分布于该水凝胶中(图2C、2D),有利于均质的组织工程软骨形成。

A:体外培养3 d后的活死细胞染色;B:DNA含量检测;C、D:体外培养3 d后的HE染色A: Live & dead staining after in vitro culture for 3 days; B: DNA content analysis; C, D: HE staining after in vitro culture for 3 days图2 华通胶光交联水凝胶的细胞相容性检测Fig. 2 The cytocompatibility of Wharton's jelly photo-crosslinking hydrogel
2.3 软骨细胞-华通胶光交联水凝胶复合物体内培养
裸鼠皮下培养2周后,大体观察显示软骨细胞-华通胶光交联水凝胶复合物形成瓷白色且略透明的软骨样结构(图3B)。随着体内培养时间延长至6周,该复合物形成更白且更加厚实的软骨样结构,具有较好的弹性和韧性(图3C)。体内培养2周样本进行组织学检测,HE染色、Safranin-O染色及Ⅱ型胶原免疫组化染色均较为浅淡,显示有初步的软骨结构形成及稚嫩软骨基质的分泌(图3D-F),并能观察到部分未降解的水凝胶成分。体内培养6周样本进行组织学检测,HE染色、Safranin-O染色均呈现强烈的深染,显示大量软骨细胞外基质和均匀的特异性软骨陷窝形成,Ⅱ型胶原免疫组化进一步证明了所构建的组织为均匀的软骨组织(图3G-I)。此时水凝胶成分均完全降解,表明所得组织为纯粹的新生软骨。
如图4所示,生物力学(杨氏模量)和生物化学(DNA含量、GAG含量和总胶原含量)的结果进一步证实,随着体内培养时间延长(由2周至6周),新生软骨质量逐渐提高且接近天然软骨(P<0.05)。

A:光照后的软骨细胞-华通胶光交联水凝胶复合物大体观;B:裸鼠体内培养2周后的大体观; C:裸鼠体内培养6周后的大体观;D-F:裸鼠体内培养2周后的HE染色、Safranin-O染色和Ⅱ型胶原染色; G-I:裸鼠体内培养6周后的HE染色,Safranin-O染色和Ⅱ型胶原染色(红色箭头表示未降解的水凝胶)A: Gross view of chondrocyte-hydrogel construct after UV crosslinking; B: Gross view of neocartilage after 2 weeks' in vivo culture; C: Gross view of neocartilage after 6 weeks' in vivo culture; D-F: HE, Safranin-O and type Ⅱ collagen immunohistochemistry staining of neocartilage after 2 weeks' in vivo culture; D-F: HE, Safranin-O and type Ⅱ collagen immunohistochemistry staining of neocartilage after 6 weeks' in vivo culture (Red arrows: residual hydrogel)图3 裸鼠体内软骨再生Fig. 3 Cartilage regeneration in vivo

A:杨氏模量;B:DNA含量;C:GAG含量;D:总胶原含量(*:P<0.05)A: Young's modulus; B: DNA content; C: GAG content; D: Total collagen content(*: P<0.05)图4 新生软骨生物力学和生物化学检测Fig. 4 Biomechanical and biochemistry analyses of neocartilage
3 讨论
脐带华通胶在成分、结构、功能上均与软骨组织非常类似,被认为是软骨组织工程中支架材料的理想来源。此外,脐带华通胶还具有以下特点:①支持华通胶间充质干细胞的增殖,推测也能支持其他干细胞增殖;②华通胶中透明质酸广泛表达CD44受体,而软骨细胞也表达CD44,使得软骨细胞能紧紧黏附在华通胶上;③华通胶是多肽生长因子储存库,这些生长因子有利于细胞的增殖分化及细胞外基质的重塑;④脐带是分娩废弃物,不涉及伦理问题,来源丰富[9-11]。因此,华通胶可作为组织工程软骨构建的载体材料成分。
水凝胶是一类高度含水的具有三维网络交联结构的聚合物材料,由于其优异的生物相容性及一定的机械强度,可以高度拟合生物组织的微环境,因此广泛应用于组织工程和再生医学[12-13]。在临床应用中,原位固化的水凝胶具有优异的组织赋形能力。光交联水凝胶相对于温敏和双组分水凝胶,由于具有时空精确可控的优势而更具备临床的实际操作性。本研究采用的光固化水凝胶,具有成胶快速(90 s)且力学强度优秀的特点,是组织工程软骨理想的载体材料形式[5]。
本研究成功制备出华通胶光交联水凝胶,适宜的流变特性使其具有可注射能力。此外,该水凝胶还具有良好的细胞相容性,因其主要成分(包括华通胶、明胶和透明质酸)均为具有良好细胞相容性的天然成分或材料。本研究中,我们将软骨细胞-华通胶光交联水凝胶复合物植入裸鼠皮下,6周后形成了瓷白色的典型软骨样组织,组织学显示具有典型的软骨陷窝样结构,免疫组化染色证明其为Ⅱ胶原软骨基质成分。同时,软骨特异性基质定量及生物力学检测结果均显示,裸鼠皮下再生的软骨组织接近天然软骨。以上结果可能得益于:①华通胶中所含的天然成分,为软骨再生提供了理想的微环境;②水凝胶的三维网络结构为软骨细胞增殖和基质分泌提供了良好的空间环境;③裸鼠皮下丰富的毛细血管可为软骨细胞-华通胶光交联水凝胶复合物提供物质交换的动力。
综上所述,华通胶光交联水凝胶可作为一种理想成分和形式的载体材料用于组织工程软骨构建,适宜的流变特性使其具有可注射能力,优秀的成胶能力有利于其塑形及组织整合,良好的细胞相容性有利于体内环境软骨再生。下一步我们将基于该华通胶光交联水凝胶对膝关节软骨缺损进行修复,以期实现其功能性重建。这种理想的载体材料,可能会为临床大块软骨缺损的治疗提供一种新的方法。

