脂肪间充质干细胞对奶牛蹄叶炎的疗效
鲁文赓,刘庆,徐郑美,原冬伟,李维龙,毛莹莹,冯琳,杜珍珍,曹立明,司琳清,金吉东,刘丽丽,付世新,韩英浩*
(1.黑龙江八一农垦大学动物科技学院,黑龙江 大庆 163319;2.黑龙江八一农垦大学生命科学技术学院,黑龙江 大庆 163319;3.科菲特饲料(长春)有限公司,吉林 长春 130012;4.四川省水产学校,四川 成都 401520)
近几年,我国奶牛养殖业发生了翻天覆地的变化,资本的融入推动规模化、集约化、现代化养殖在奶牛养殖模式中所占比重的迅速提升,使奶业的发展进入了一个全新的时期。在短时间内大幅提升规模化、集约化、现代化养殖水平虽卓有成效,但一些棘手的疾病依旧限制着我国奶业的振兴和奶业的健康快速发展。奶牛的肢蹄病是奶牛生产中的常见病、多发病,其与乳腺疾病、繁殖障碍性疾病、前胃疾病并称为危害奶牛养殖的四大疾病[1]。蹄叶炎(laminitis)是在奶牛肢蹄病中所占比例最高的疾病,可达41%,同时72%的奶牛至少有一个蹄曾发生过蹄叶炎[2]。蹄叶炎的高发病率给牧场的治疗与经营费用上造成了高额经济负担[3]。据报道,在美国因蹄叶炎给牧场所造成的直接和间接的经济损失为平均每年每头牛177.62美元[4]。而我国每年因肢蹄病被迫过早淘汰的奶牛占总淘汰数的15%~30%,给奶牛业造成了巨大数额的经济损失[5]。而现如今尚未有一种能够有效防治奶牛蹄叶炎,避免或减少牧场经济损失的方法,因而成为奶牛养殖场最为棘手的疾病之一。鉴于此,对奶牛蹄叶炎的防治研究已成为一个亟待解决的问题,尤其是将基础理论研究成果转化成临床治疗应用上。
脂肪间充质干细胞(adipose-derived mesenchymal stem cells,AD-MSCs)具有来源广泛、采集方便、体外易于扩增、低免疫原性等特性,是目前再生医学、组织工程、基因治疗等方面比较理想的种子细胞[6-7]。AD-MSCs在特定的环境中可以定向分化,从而达到修复细胞和组织损伤的作用[8-9]。有研究表明,除了干细胞本身的分化作用外,其旁分泌所产生的细胞因子和外泌体在调节免疫反应与组织修复过程中发挥了更大的作用[10-12]。目前干细胞疗法在人类与犬猫疾病的治疗方面达到了超乎预期的效果[13]。而在大动物中,尤其是奶牛方面鲜有报道。因此,本试验探讨了牛脂肪间充质干细胞(bovine adipose-derived mesenchymal stem cells,bAD-MSCs)制剂对奶牛蹄叶炎的临床疗效,为探索新的、有效的、绿色的治疗奶牛蹄叶炎方法提供了新思路和临床应用依据。
1 材料与方法
1.1 试验动物
昆明系小鼠,雄性36只,体重30~40 g,由辽宁长生生物技术股份有限公司提供,合格证号为SCXK(辽)2015-0001。新西兰白兔雄性3只体重2.1~2.5 kg,由长春生物制品研究所有限责任公司提供,合格证号为SCXK(吉)2013-0002。荷斯坦奶牛雌性12头,由黑龙江省北安市某规模化奶牛养殖场提供。
1.2 细胞和主要试剂
原代bAD-MSCs由本实验室保存。DMEM(Gibco公司,美国),FBS(四季青公司,中国),胰蛋白酶(Solarbio公司,中国),苏木精(上海兰秀贸易有限公司,中国),伊红(天津大茂化学公司)。
1.3 bAD-MSCs制剂制备
将原代bAD-MSCs进行复苏,用10 cm培养皿进行传代,1个10 cm培养皿中细胞计数为3.3×106个细胞,收集4个培养皿上的细胞,溶于30 mL灭菌生理盐水中进行超声破碎,随后离心取上清用滤膜过滤,测量其蛋白质浓度,记为A液。收集4个培养皿中的上清液,透析除盐,滤膜过滤后进行冻干,冻干粉溶于8 mL灭菌生理盐水中,记为B液。将A液与B液按照3∶1的比例进行混合,制备成200 μg/mL的bAD-MSCs制剂。按照上述方法改变A液灭菌生理盐水浓度,制备成不同浓度(400 μg/mL,800 μg/mL)的制剂。
1.4 小鼠毒性试验
小鼠分为4组,分别为对照组(0.9% NaCl溶液)、低剂量组(200 μg/mL bAD-MSCs制剂)、中剂量组(400 μg/mL bAD-MSCs制剂)、高剂量组(800 μg/mL bAD-MSCs制剂),每组各9只,分别于腹腔注射0.1 mL,注射剂量为临床试验的100倍以上。注射制剂后每日早晚两次观察各组小鼠的食欲,排粪,精神状态等临床症状。在其第0、1、3、7及14天,进行称重,记录体重变化,评价bAD-MSCs制剂对小鼠正常饲喂的影响。小鼠注射制剂后14 d时将各组小鼠进行最后1次称重。随后经颈椎脱臼致死,剖开腹腔与胸腔取出心脏、肝脏、脾脏、肺脏、肾脏进行称重。脏器系数按下列公式计算。脏器系数(%)=(脏器重量/体重)×100%。脏器称重后用10%福尔马林溶液固定,制作石蜡组织切片,经HE染色。最后在显微镜下观察其病理状态。
1.5 热原检查方法
按照《中国药典》三部(2015版)中的“热原检查法”进行判定。当日使用的家兔,正常体温在38.0 ℃~39.6 ℃的范围内,且各兔间正常体温之差不超过1.0 ℃。测定其正常体温后15 min内,对3只家兔,采取缘静脉注射2 mL bAD-MSCs(400 μg/mL)制剂,注射剂量为临床试验的100倍以上。然后每隔30 min按前法测量其体温1次,共测6次,以6次中最高的1次温度减去正常体温,即为该兔体温的升高温度(℃)。
1.6 奶牛临床试验方法
根据宋宝强的奶牛蹄叶炎诊治方法,经牧场兽医在挤奶大厅对奶牛进行临床检查,将蹄部肿大潮红、患病蹄变形、站立时表现拱背、抵抗抬蹄检查、蹄底与白线界限明显、蹄底真皮层充血等症状的奶牛耳标号记录[14]。当奶牛回到牛舍后按照之前记录的耳标号,先远观其站立状态,一般为前肢发病,后肢伸于腹下;后肢发病,前肢伸于腹下。后对其进行驱赶,其行走步态跛行严重,不愿走动喜卧。据此可确诊奶牛患有蹄叶炎。选取胎次平均为3次、其体况评分平均为2.5的泌乳中期蹄叶炎奶牛进行分组。分为对照组6头(未治疗)和治疗组6头。治疗组经蹄间叉上缘注射5 mL 400 μg/mL bAD-MSCs制剂。各组奶牛分别于即将注射之前(0 h)及注射制剂后第6、24、48 h,5、7、14天测量其体温呼吸数,并由牧场同一兽医对各组奶牛进行跛行评分等级盲评。跛行评分是评定奶牛正常行走能力的定性指数。评分值为1~5分,其中1分为正常;2分为轻度跛行;3分为中度跛行;4分为重度跛行;5分为严重跛行。
1.7 统计学分析

2 结果
2.1 小鼠毒性试验
以3组不同剂量的bAD-MSCs制剂对小鼠进行腹腔注射。与对照组相比,试验组小鼠精神状态良好,食欲饮欲正常,试验期间未见死亡。试验组与对照组随着时间变化的小鼠体重差异无统计学意义(P>0.05)。试验组组间比较未见统计学意义(P>0.05)。见图1。
图1 各组小鼠体重变化
脏器系数是反映动物器官健康的重要指标。研究结果显示,低、中、制剂处理组与对照组的小鼠所有脏器系数相比,经统计学分析,均无明显差异(P>0.05);试验组组间相比所有脏器系数,经统计学分析无明显差异(P>0.05),见表1。解剖观察各组小鼠均未发现明显脏器病变,经HE染色的病理组织切片显示,各组小鼠所有脏器无明显病理学改变。
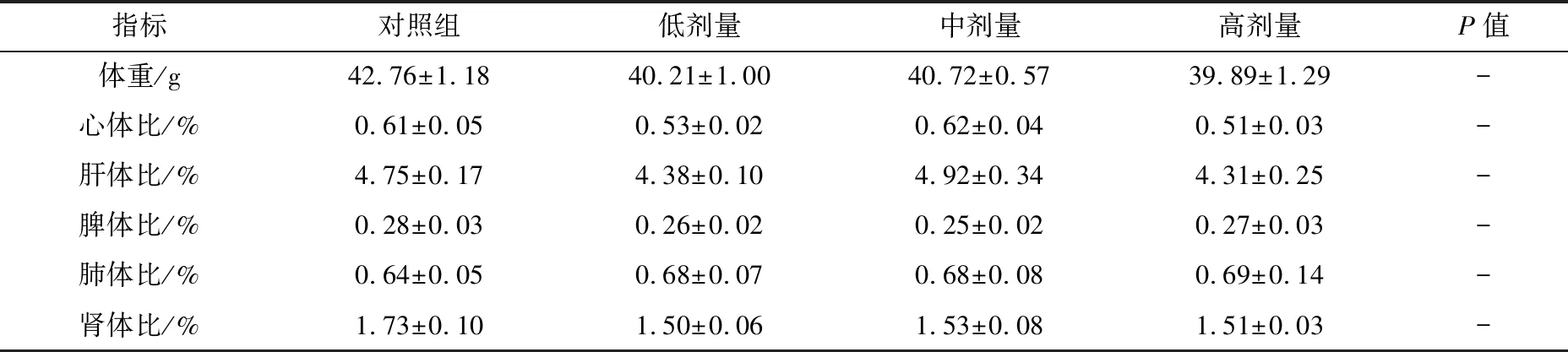
表1 bAD-MSCs制剂对小鼠脏器系数的影响
2.2 热原检查判定
经家兔耳缘静脉注射bAD-MSCs制剂进行热原试验。在受试的3只家兔中,体温升高均低于0.6 ℃,且3只家兔体温升高总和低于1.3 ℃。
2.3 患病奶牛临床治疗效果
利用bAD-MSCs制剂对患病奶牛进行治疗。如表2所示,本研究所用奶牛的胎次与体况评分无显著差异;试验前与试验后呼吸数和体温变化也无显著差异(P>0.05)。对同一患蹄叶炎的奶牛进行驱赶,治疗前的状态为行走时右后腿拖拽行走,蹄部只可轻微着地,不能完全受力,患病蹄肿大潮红;治疗后7 d时的治疗效果为行走时步态正常,四肢受力均匀、步履矫健、更可起跳腾空(蹄部为受力点),患病蹄可见其肿大面积减小和潮红消退。试验期间对照组奶牛跛行程度未见改善,且随着时间的延长,跛行程度可见更加的严重。而在治疗组在给药6 h后其跛行程度开始逐渐变轻。在注射后48 h奶牛的跛行评分在治疗组和对照组分别是3.25 ±0.25和4.5±0.29,治疗效果明显(P<0.05);在注射后120 h奶牛的跛行评分在治疗组和对照组分别是2.75±0.25和4.5±0.29 (P<0.01),在注射后168 h两组的跛行评分分别是 2.5±0.29和4.5±0.29(P<0.01),其治疗效果表现出显著性差异;而在注射后336 h 奶牛的跛行评分在治疗组和对照组分别是1.75±0.25和4.75±0.25,其治疗效果表现出极显著差异(P<0.001)(图2)。

表2 奶牛基本信息表
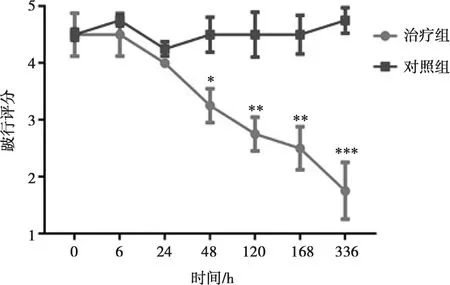
注:*P<0.05,**P<0.01,***P<0.001图2 牛跛行评分变化
3 讨论
奶牛蹄叶炎是一种无菌性炎症,可诱发蹄白线病、蹄底溃疡、蹄部变形等疾病,是引起奶牛跛行的主要原因[15]。关于蹄叶炎的诱发原因,学者们众说纷纭,尚未有一定论。目前认为蹄叶炎的诱发原因主要包括亚急性瘤胃酸中毒、脂质代谢紊乱、牧场环境、年修蹄次数等[16-17]。但大家一致认可的是,蹄叶炎的发病原理为蹄部的炎症反应、蹄真皮的血管破损、表皮细胞的异常分化[18]。针对其发病原理,牧场对蹄叶炎通常的治疗方法可以简单概括为:封闭疗法、抗生素疗法与保守疗法。而这三种方法都存在着弊端,如封闭疗法治标不治本,容易复发;抗生素疗法存在抗生素滥用现象,影响动物食品安全;而保守疗法见效慢,影响奶牛生产性能。因此,研发治疗蹄叶炎的新方法,对我国奶业的振兴和奶业的健康绿色发展具有重要意义。
在干细胞治疗领域中,间充质干细胞(mesenchymal stem cells MSCs)应用于临床的可能性已经得到了证实。仅在2006—2012 年基于MSCs产品向美国食品和药物管理局(FDA)提交的研究性新药申请数量较之前增加了大约3倍[19]。干细胞疗法不仅应用于人医领域,在兽医小动物方面也有大量的研究[20],但尚未见到与奶牛相关的报道。因而本试验将bAD-MSCs通过提纯浓缩步骤,制作成不同蛋白浓度的制剂,首先进行了小鼠毒性与家兔热原试验。结果表明,bAD-MSCs制剂对小鼠的体重、主要脏器系数、脏器组织病理学均无影响,符合毒理学无毒性判定标准[21]。家兔热原试验的家兔体温变化结果也与《中国药典》三部(2015版)中“热原检查法”规定的无热原性判定标准相一致[22]。研究表明bAD-MSCs制剂是无毒性、无热原性和无刺激性的制剂。
在奶牛临床治疗试验中,可以清晰地看出bAD-MSCs制剂有效地缓解奶牛病蹄的肿胀程度,显著降低了患病牛跛行评分等级。利用人源AD-MSCs中纯化的外泌体进行miRNA模拟试验证明了miR-423-5p是外泌体中促血管生成的关键活性分子[23]。Vasilev等[24]在人源AD-MSCs对类风湿性关节炎的治疗效果研究中阐明了AD-MSCs产生的分泌因子具有免疫调节作用。而Mitchel等[6]通过人源AD-MSCs的细胞外囊泡对光损伤的人真皮成纤维细胞的影响研究,阐明了AD-MSCs细胞外囊泡分泌的可溶性分子可以促进肌肉生成的机理。据此可以推论出本试验所利用的bAD-MSCs制剂在治疗奶牛蹄叶炎上所发挥出的较好疗效,可能是bAD-MSCs中的分泌因子与外泌体修复了患病蹄内部破损血管并抑制了蹄部炎症反应,从而减轻了临床跛行的症状。
综上所述,本试验证实了bAD-MSCs制剂对奶牛蹄叶炎具有较好的疗效,为探索治疗奶牛蹄叶炎方法提供了新思路。至于bAD-MSCs制剂对于蹄叶炎治疗的具体分子机制,尚需进一步深入探究。

