柔嫩艾美耳球虫配子体基因Etgam56的克隆表达与鉴定
刘悦,汪飞燕,叶状,宿世杰,侯照峰,许金俊,陶建平,刘丹丹*
(1.扬州大学兽医学院,江苏 扬州 225009;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
鸡球虫病是一种危害严重的寄生性原虫病,每年给全球养鸡业造成巨大的经济损失。鸡球虫病通常由7种艾美耳属球虫单独或混合感染引起,其中柔嫩艾美耳球虫是致病性最强的虫种,重度感染可引起急性盲肠球虫病。目前国内外主要通过化学药物防控球虫病,随着抗球虫药大量广范使用,耐药性的产生以及药物残留引起的食品安全问题也逐渐为人们所重视,而传统活疫苗免疫的方法也存在散播病原的风险且稳定性较差,因此重组亚单位疫苗成为更被关注的球虫病防治手段[1]。已有研究报道巨型艾美耳球虫配子体基因Emgam56和Emgam82的原核表达重组蛋白免疫雏鸡,可以有效降低卵囊产量和病变记分,具有一定的免疫保护力[2],且2种配子体蛋白GAM56和GAM82在卵囊壁形成过程中发挥重要作用,推测其可能通过免疫阻断作用阻断卵囊发育[3-4]。本文对柔嫩艾美耳球虫配子体蛋白编码基因gam56(Etgam56)进行了克隆和序列分析,构建原核表达载体并进行体外诱导表达,并对表达产物的抗原性进行了评价,旨为研制新型球虫亚单位疫苗奠定基础。
1 材料与方法
1.1 虫株
柔嫩艾美耳球虫扬州株,由扬州大学兽医学院寄生虫学教研室经单卵囊分离建株,定期经无球虫污染的鸡传代保种。
1.2 主要试剂材料
pMD20-T载体,购自TaKaRa公司。大肠杆菌DH5α和BL21菌株、表达载体pET-28a(+),均由本实验室保存。PrimeSTAR GXL DNA Polymerase,Mighty TA-cloning Reagent Set for PrimeSTAR,Hind Ⅲ、BamHⅠ限制性内切酶,TaKaRa MiniBEST Universal Genomic DNA Extraction Kit等,均购自宝生物工程(大连)有限公司;Ni-NTA亲和层析介质,购自金斯瑞生物科技公司;6×Loading Buffer,购自碧云天公司;硝酸纤维素膜,购自默克公司;ECL化学发光试剂,购自Tanon公司;Anti-6×HIS标签小鼠单抗和HRP标记的家兔抗小鼠IgG,购自BBI公司;HRP标记的绵羊抗鸡IgG,购自HPL公司。
1.3 引物设计
根据GenBank中收录的柔嫩艾美耳球虫Etgam56基因序列(XM_013376832.1),使用Primer 5.0软件设计3条特异性引物,F1:5′-ATGACTCGCCTCAGCCTCT-3′;F2:5′-TTACGGAGGAACGGGGCCGAA-3′;F3:5′-TACAGCTACAGGTACCCCTCC-3′。引物由华大基因科技股份有限公司合成。
1.4 球虫卵囊总DNA的提取
取实验室提取、保存的柔嫩艾美耳球虫配子体,按TaKaRa MiniBEST Universal Genomic DNA Extraction Kit说明提取基因组DNA。
1.5 Etgam56基因的扩增
参照PrimeSTAR®GXL DNA Polymerase说明书,PCR法扩增Etgam56,以F1为上游引物、F2为下游引物扩增基因全长序列,由于该基因下游GC含量较高,为保证扩增序列的准确性,以F3为上游引物、F2为下游引物单独扩增高GC片段。50 μL PCR反应体系:5×PrimeSTAR GXL Buffer 10 μL,dNTP混合物(每种2.5 mmol/L)4 μL,F1/F2/F3引物(10 mmol/L)各1 μL,模板(30 ng/μL)2 μL,PrimeSTAR GXL DNA Polymerase (1.5 U/μL)1 μL,灭菌水31 μL,反应条件为:98 ℃ 3 min;98 ℃ 10 s,68 ℃ 1.5 min,30个循环;72 ℃ 5 min。预计扩增目的片段分别为1 425 bp(引物F1和F2)和573 bp(引物F3和F2)。
1.6 Etgam56基因的克隆与序列分析
将含有目的片段的PCR产物分别经试剂盒纯化回收后,参照Mighty TA-cloning Reagent Set for PrimeSTAR®说明书对纯化的PCR产物3′端添加“A”碱基,构建pMD20-T-Etgam56克隆质粒,常规转化至大肠杆菌DH5α。经蓝白斑筛选,随机挑选白斑,提取质粒,经HindⅢ和BamHⅠ双酶切鉴定为阳性的克隆,送华大基因科技股份有限公司测序。将测序得到的两段核苷酸序列进行拼接,并进行生物信息学分析。
1.7 原核表达质粒的构建
根据大肠杆菌蛋白表达系统的密码子偏嗜性,将Etgam56基因序列进行优化合成后连接至pET-28a(+),构建原核表达载体pET-28a(+)-Etgam56,转化至大肠杆菌BL21(DE3),挑取阳性重组菌进行体外诱导表达。
1.8 重组蛋白表达条件优化与可溶性分析
1.8.1 IPTG浓度的确定
将阳性重组菌的单菌落接种卡那霉素(100 μg/mL)的LB培养基,37 ℃,200 r/min过夜培养,按1∶100转接种3 mL含相同浓度卡那霉素LB培养基中,37 ℃,200 r/min培养4 h后,分别加入终浓度为0.10、0.30、0.50、0.70和1.00 mmol/L的IPTG诱导表达4 h;取诱导后重组菌1 mL,PBS洗涤3次后,200 μL PBS重悬菌体,加入40 μL 6×SDS-PAGE上样缓冲液,12 000 r/min离心10 min,取上清进行12% SDS-PAGE分析。
1.8.2 最佳诱导温度的确定
将重组菌分组接种到含有卡那霉素(100 μg/mL)的LB培养基中,37 ℃,200 r/min培养4 h后,分别加入终浓度为0.10 mmol/L的IPTG,分别置于10 ℃、16 ℃、20 ℃、37 ℃环境中诱导表达20 h;取诱导后重组菌1 mL,悬浮于200 μL PBS中,冰浴超声裂解(功率30%,超声2 s,间歇3 s,5 min),4 ℃ 12 000 r/min离心10 min后分别取上清和沉淀(沉淀用200 μL PBS稀释)进行SDS-PAGE。
1.8.3 最佳诱导时间的确定
将重组菌分组接种到含有卡那霉素(100 μg/mL)的LB培养基中,37 ℃,200 r/min培养4h后,分别加入终浓度为0.10 mmol/L的IPTG,37℃诱导表达,分别于诱导后1.0、1.5、2.0、2.5、3.0、3.5、4.0、8.0、12.0、16.0及20.0 h取重组菌1 mL,PBS洗涤3次后,200 μL PBS重悬菌体,加入40 μL 6 × SDS-PAGE上样缓冲液,12 000 r/min离心10 min后分别取上清进行12% SDS-PAGE分析。
1.9 重组蛋白的特异性检测
将诱导的阳性重组菌蛋白、pET-28a(+)质粒转化菌蛋白以及未经转化的BL21菌体蛋白进行12% SDS-PAGE电泳,并转移到NC膜上。转印结束后参照刘丹丹等[5]方法进行Western blot检测。其中一抗为6×HIS标签单抗(用封闭液按1∶5 000倍稀释),二抗为HRP标记的兔抗小鼠IgG(用封闭液按1∶15 000倍稀释)。ECL化学发光显色,天能5200成像系统观察显色结果并扫描保存。
1.10 重组蛋白的纯化与复性
取诱导后的重组菌250 mL,离心收集沉淀,经PBS洗涤后重悬于10 mL PBS中,冰浴超声释放包涵体;4 ℃ 12 000 r/min 离心 15 min,弃上清,将沉淀重悬于10 mL LE Buffer,冰浴超声加速包涵体溶解;4℃ 12 000 r/min 离心 15 min,将上清移入Ni-NTA亲和纯化层析柱中,4℃结合30 min;用2×层析柱体积的Washing Buffer洗涤层析柱3次,用2×层析柱体积的Elution Buffer洗涤层析柱3次,收集Elution Buffer的洗脱液,转移至透析袋中,分别置于含有6、4、2及1 mol/L尿素的透析液和0.1 mol/L PBS 中4 ℃复性6~8 h,最终PEG8 000浓缩,收集蛋白。
1.11 重组蛋白的免疫学鉴定
参照1.9的方法,分别以鸡抗柔嫩艾美耳球虫康复血清、鸡抗毒害艾美耳球虫康复血清(由扬州大学兽医学院寄生虫学教研室制备保存)为一抗,以HRP标记的绵羊抗鸡IgG为二抗,对重组蛋白进行Western blot抗原性和种间交叉反应性检测。
2 结果
2.1 目的基因的扩增
PCR扩增得到的目的片段大小分别为1 425 bp、673 bp左右,与预期大小相符(图1)。
2.2 核苷酸序列分析
将酶切鉴定为阳性的克隆(图2)进行测序,将分段克隆的测序结果进行拼接,两段序列重叠237 bp左右,拼接后所得序列全长为1 425 bp。将所测序列与发表在GenBank中的Eagam56(XM_013395657.1、XM_013395658.1)、Emgam56(AY129951.2、XM_013478110.1、XM_013478111.1)和Engam56(XM_013585547.1)进行序列比对,同源性分别为67.3%、51.0%、68.9%、51.0%、69.1%、87.9%。
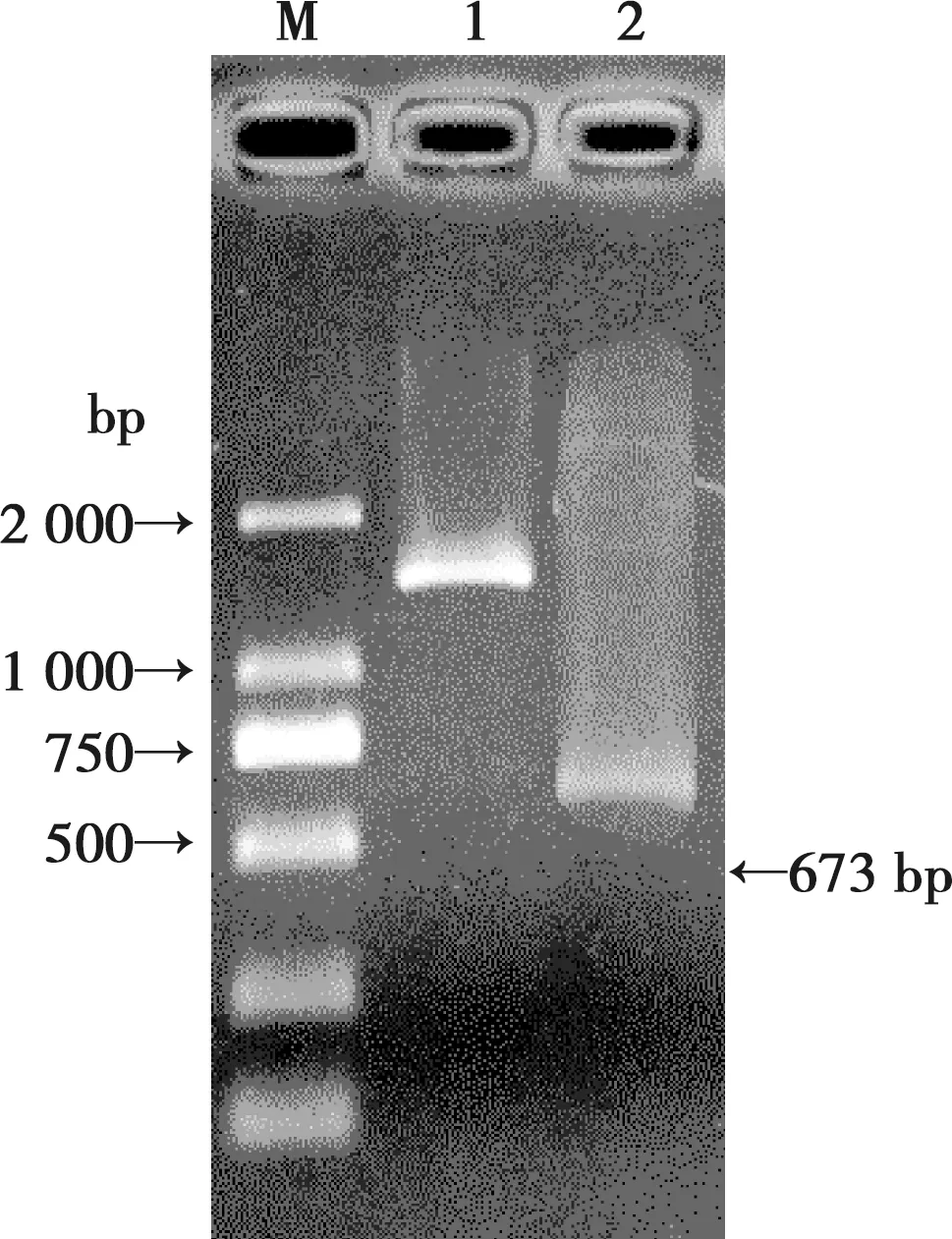
M.DL2000 DNA Marker;1.Etgam56扩增产物(F1,F2);2.Etgam56扩增产物(F3,F2)图1 Etgam 56的PCR扩增
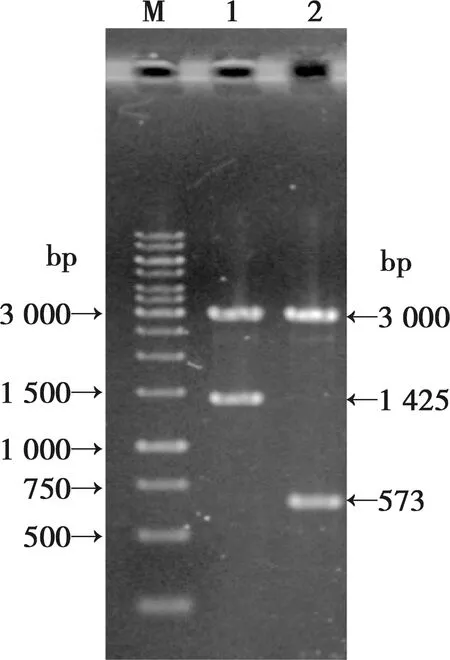
M.DNA分子质量标准;1,2.重组质粒HindⅢ和BamHⅠ双酶切产物图2 重组质粒的酶切鉴定
2.3 氨基酸序列分析
氨基酸序列分析显示,Etgam56基因共编码474个氨基酸,分子质量为53.74 ku,等电点(PI)为4.92,pH值为7.0时电离点为-10.641,含有33个强碱性氨基酸(K、R),44个强酸性氨基酸(D、E),98个疏水性氨基酸(A、I、L、F、W、V),170个极性氨基酸(N、C、Q、S、T、Y)。该蛋白富含脯氨酸(13.47%)、苏氨酸(10.11%)、酪氨酸(9.68%)、丝氨酸(8.84%)、甲硫氨酸(7.58%),且含有1个酪氨酸和丝氨酸富集区(第245-321位)和1个脯氨酸和甲硫氨酸富集区(第339-454位)。抗原决定簇在线分析显示,此蛋白共含有9个抗原决定簇,显示其具有较好的抗原性。
2.4 重组蛋白的诱导表达及不同条件对表达水平的影响
将重组质粒pET-28(+)-Etgam56转化BL21(DE3)大肠杆菌,诱导表达后进行SDS-PAGE分析,结果显示,重组蛋白(rEtGAM56)大小为56 ku左右。IPTG浓度为0.10 mmol/L,37 ℃诱导3 h的蛋白表达量最高。
2.5 重组蛋白的纯化与复性
在最适表达条件下,大量诱导表达重组蛋白,经HIS标签Ni-NTA亲和层析柱纯化,收集纯化过程中不同时期流出液进行12% SDS-PAGE,结果显示,裂解液中的蛋白能与Ni-NTA较好结合,经3次Washing Buffer洗涤,可有效去除未与Ni-NTA结合的杂蛋白,Elution Buffer可以有效洗脱目的蛋白,纯化效果较好,且复性过程中未发生蛋白降解(图3)。
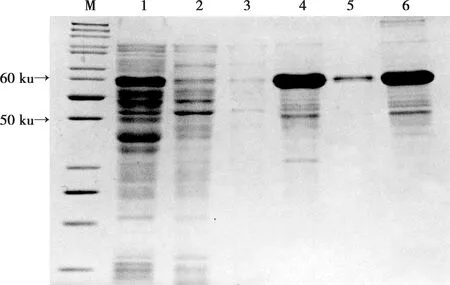
M.标准蛋白质分子量标记;1.包涵体尿素裂解后上清;2.裂解液与 Ni-NTA 结合后的流出液;3.Washing Buffer 第3次洗脱液;4.Elution Buffer第1次洗脱液;5.Elution Buffer第3次洗脱液;6.纯化复性后蛋白图3 重组蛋白的纯化与复性
2.6 重组蛋白的鉴定
Western blot分析显示,重组蛋白能被抗6×HIS标签单克隆抗体特异性识别(图4),在56 ku左右出现目的条带,而pET-28a(+)质粒转化菌蛋白对照组未见条带,证实Etgam56基因成功体外表达。

M.蛋白分子质量标准;1.pET-28a(+)/BL21 IPTG诱导;2.pET-28a(+)-Etgam56/BL21 IPTG诱导图4 重组蛋白的特异性鉴定
2.7 重组蛋白抗原性分析
Western blot分析显示,柔嫩艾美耳球虫病鸡康复血清(图5)和毒害艾美耳球虫的鸡康复血清(图6)特异性识别,而pET-28a(+)质粒转化菌蛋白未与抗体发生反应,显示重组蛋白具有较好的抗原性和交叉抗原性。

M.蛋白分子质量标准;1.pET-28a(+)/BL21 IPTG诱导;2.pET-28a(+)-Etgam56/BL21 IPTG诱导图5 抗鸡柔嫩艾美耳球虫康复血清的Western blot检测

M.标准蛋白分子质量;1.pET-28a(+)-Etgam56/BL21 IPTG 诱导;2.pET-28a(+)/BL21 IPTG 诱导图6 抗鸡毒害艾美耳球虫康复血清的Western blot检测
3 讨论
经序列分析显示Etgam56基因无内含子序列,故本研究提取了柔嫩艾美耳球虫配子体的基因组DNA,采用PCR方法扩增目的基因,鉴于片段大小以及高GC含量,同时考虑到测序结果的准确性,特设计了中间引物F3扩增序列后段的高GC区域,所得序列经Lasergene7.0分析,拼接后的序列大小为1 425 bp,为一个完整阅读框,编码474个氨基酸,含有1个酪氨酸和丝氨酸富集区(第245-321位)、1个脯氨酸和甲硫氨酸富集区(第339-454位),在线软件(http://imed.med.ucm.es/Tools/antigenic.pl)预测抗原决定簇,结果显示,该蛋白共含有9个抗原决定簇,其中最长的抗原决定簇富含酪氨酸和丝氨酸,且位于酪氨酸和丝氨酸富集区内,符合鸡球虫配子体蛋白基因在氨基酸序列上的结构域特征[6-7]。核酸序列分析显示与其他配子体蛋白编码基因具有较高的同源性,故证实研究获得的基因确为柔嫩艾美耳球虫Etgam56基因。
球虫的生活史复杂,不同发育阶段不同抗原的免疫原性也有较大的差别,配子体蛋白是卵囊壁的前体蛋白,推测其在囊壁形成过程中发挥重要作用。目前已经报道的配子体蛋白编码基因主要有:巨型艾美耳球虫的Emgam56、Emgam82[8]和Emgam230[9],柔嫩艾美耳球虫的Etgam56 (Etgam56 tmp1)、Etgam59 (Etgam56 tmp2)和Etgam22[10],毒害艾美耳球虫的Engam59和Engam22[11],堆型艾美耳球虫的Eagam56[12]。有研究证明,分离于巨型艾美耳球虫突然配子体内的EmGAM56、EmGAM82和EmGAM230蛋白,以及体外重组表达的rEmGAM82和rEmGAM56,均能诱导宿主产生免疫反应,在一定程度上抑制巨型艾美耳球虫的发育,降低卵囊产量,具有一定的免疫保护效果[13]。本研究中获得的重组蛋白rEtGAM56能被柔嫩艾美耳球虫的鸡康复血清所识别,同时也可被毒害艾美耳球虫的鸡康复血清所识别,显示该重组蛋白具有良好的抗原性和一定的种间交叉反应性,但其对鸡体的免疫保护效果还有待进一步研究。

