犬泌尿道处方粮对犬膀胱炎的防治调理效果研究
申茂玉,曹利,赵杰,谢昕,朱雷,周凡,冯士彬,李玉,吴金节,阮崇美,辜丽川,王希春*
(1.安徽农业大学动物科技学院,安徽 合肥 230036;2.上海比瑞吉宠物用品股份有限公司,上海 201100;3.安徽科技学院动物科学学院,安徽 凤阳 233100;4.安徽农业大学信息与计算机学院,安徽 合肥 230036)
随着生活水平的提高,饲养宠物犬的家庭越来越多,但由于大部分宠物主人的饲养管理经验不足,对宠物疾病防治缺乏了解,导致在临床上宠物犬泌尿道疾病的发病率呈上升趋势。泌尿系统疾病是宠物犬的高发病之一,其中膀胱炎尤为常见[1]。膀胱炎是指膀胱黏膜及黏膜下层的炎症,是常见的犬下尿路感染性疾病[2],临床症状有尿频、尿痛、尿液混浊带血伴有氨臭味,尿沉渣检测多见红细胞、白细胞、膀胱上皮细胞,B超影像可显示膀胱壁肿胀增厚或表面粗糙皱样变化[2]。引发膀胱炎的病因有很多,如尿路的细菌感染;膀胱结石或尿潴留过度压迫膀胱壁造成膀胱机械性刺激及损伤;肾炎、输尿管炎等邻近器官的炎症蔓延;有毒物质或强烈药物刺激等[3]。犬膀胱炎的治疗一般通过抗菌消炎药、利尿、止血止痛或清热利湿的中药等对症治疗,当宠物犬出现泌尿系统疾病时,积极遵医嘱配合治疗的,同时要改善饲养管理,保证安静无刺激惊吓的环境,给予充足的水分,饮食上选用高营养无刺激易消化的犬粮,适当限制高蛋白质的食品。调整饮食结构减少对泌尿道的刺激和负担,以防复发[4]。宠物犬出现泌尿系统疾病时,处方粮作为具有一定食疗效果的犬粮,其辅助治疗、方便快捷的特点被越来越多的宠物主人认可,泌尿道处方粮针对性的添加改善泌尿系统问题的食疗成份,作为宠物的“病号餐”能全面改善患犬饮食结构,辅助泌尿系统疾病的治疗。
为探究犬泌尿道处方粮对膀胱炎的防治调理效果,本试验通过对膀胱灌注75%的医用酒精来建立犬膀胱炎症的模型[5-8],在建模的过程中饲喂泌尿道处方粮监测其对发病期的干扰情况,并对膀胱炎模型犬饲喂处方粮探究其对膀胱炎的治疗调理效果,为今后犬处方粮的临床应用提供试验依据。
1 材料与方法
1.1 实验动物
选取24只无泌尿系统病史的健康比格犬作为试验犬,公母各半,体重(13±1.5)kg,年龄(2±0.2)岁,购于南京亚东实验动物研究开发中心公司。
1.2 犬粮选择
普通犬粮、犬泌尿道处方粮,由上海比瑞吉宠物用品股份有限公司提供,处方粮的主要成分配比为粗蛋白质≥19.0%、粗脂肪≥14.0%、粗纤维≤5.0%、粗灰分≤10.0%、钙≥0.6%、总磷0.5%、赖氨酸≥0.63%、水溶性氯化物≥0.09%、水分≤10.0%,此外还添加了陈皮、茯苓、车前子、泽泻及麦冬等中药成分。
1.3 动物分组与管理
在造模及预防调理试验中,将24只比格犬随机分为对照组6只、预防组6只、造模组12只,试验前对所有试验犬只做临床常规检查后确定健康、精神状态良好,并进行体内外驱虫,疫苗免疫。每两只试验犬在8 m2的半开敞犬舍内圈养,以保证其正常的活动量,整个试验过程全部饲喂犬粮,无其他食物投喂,饮用清洁水。
1.4 试验设计
对照组、造模组每只犬饲喂基础犬粮35 g/(kg·d),预防组每只犬饲喂泌尿道处方犬粮35 g/(kg·d)。采用75%的医用酒精对造模组和预防组膀胱灌注建立犬的膀胱炎症,每周1次,连续灌注两次,每次每只0.6 mL/kg。第14天造模犬出现血尿、食少纳呆,尿液中白细胞呈阳性,超声检查膀胱壁明显增厚,即判定膀胱炎造模成功。保留对照组和造模组,将造模组平均分成自然组和治疗组各6只,自然组犬饲喂普通犬粮35 g/(kg·d),治疗组犬饲喂泌尿道处方犬粮35 g/(kg·d)。试验期间没有介入任何药物,没有饲喂其他食物,早晚饲喂犬粮各1次,自由饮水。
1.5 样品的采集与处理
分别在试验开始的第0、7、14、21和28天,通过前肢静脉采血,取新鲜EDTA抗凝血检测血常规,将抗凝血以3 000 r/min离心3 min,取上层血浆检测C反应蛋白;取非抗凝血在室温中倾斜放置30 min,以3 000 r/min离心10 min,取上清液用于检测肾功能指标与炎症因子水平;收集第0、7、14、21和28天的尿液,以1 000 r/min离心5 min,取尿沉渣镜检。
1.6 指标检测
1.6.1 临床症状
试验期间观察犬的食欲、饮食量、饮水量、精神状况、排尿量,观察排尿姿势、排尿次数、排尿量及尿液的感官状态,并做记录。
1.6.2 血液指标
采用兽用全自动血细胞分析仪测定犬血常规各项指标,用荧光C反应蛋白分析仪检测犬血浆中的C反应蛋白(CRP)的浓度,将分离好的血清用BS-220全自动生化分析仪检测犬肾功能生化指标检查,用MK3型酶标仪检测犬血清中肿瘤坏死因子-α(TNF-α)、白细胞介素6(IL-6)的浓度。
1.6.3 尿液检查
将当天收集的尿液做尿液4项指标(白细胞、pH、尿潜血和尿蛋白)检测;对尿沉渣做Diff-Quik染色观察尿沉渣中细胞情况。
1.7 数据统计
应用SPSS 20.0统计软件的独立样本将试验组不同试验时间点的测定数据与对照组进行比较,试验结果用“平均值±标准差”表示。
2 结果与分析
2.1 各组犬的临床表现
造模组和预防组犬只在75%的医用酒精灌注后出现了精神不振,厌食,尿频,尿液略微泛红,舔舐生殖器,预防组在第5天症状减轻,正常饮水进食。在第二次灌注后,造模组和预防组组犬体温升高、尿频,其中造模组公犬只出现生殖器滴血情况,尿淋漓,生殖器红肿可见脓性分泌物,尿液浑浊呈暗红色。
在治疗调理阶段,治疗组犬只在饲喂处方粮后食量增加,饮水次数增多,精神状态明显转好,尿频、尿淋漓状况开始缓解,排尿变得顺畅,尿液变得清澈,自然恢复组犬精神倦怠、食欲差。尿液仍浑浊呈琥珀色,排尿时间长。第28天,治疗组犬只的临床症状基本消失,对照组症状略有缓解,但精神食欲较差,尿液仍浑浊并伴有刺鼻氨臭味。
2.2 血常规检查
在预防调理试验中,第0天各组间指标并无明显差异;在第7天,造模组犬血液中红细胞数和血红蛋白含量显著降低(P<0.05),造模组和预防组犬只血液中的白细胞数量显著增高(P<0.05),中性粒细胞数量极显著增高(P<0.01);第14天造模组的红细胞数和血红蛋白含量均显著低于对照组和预防组(P<0.05),白细胞数显著高于对照组和预防组(P<0.05),中性粒细胞数极显著高于对照组(P<0.01),预防组中性粒细胞显著高于对照组(P<0.05)。见表1。

表1 预防调理阶段不同处理组犬血常规指标的比较
治疗调理试验阶段,第14天自然组和治疗组红细胞和血红蛋白含量均显著低于对照组(P<0.05),白细胞数显著高于对照组(P>0.05),中线粒细胞数极显著高于对照组(P<0.01);第21天 治疗组红细胞数和血红蛋白含量与对照组无显著差异(P>0.05),自然组红细胞数仍显著低于对照组和治疗组(P<0.05),血红蛋白含量显著低于对照组(P<0.05),但与治疗组无明显差异(P>0.05),自然组和治疗组的白细胞数和中性粒细胞数仍显著高于对照组(P>0.05);第28天治疗组和对照组各指标均无显著性差异(P>0.05),自然组血红蛋白含量显著低于对照组和治疗组(P<0.05),红细胞数显著低于对照组(P<0.05),中性粒细胞数极显著高于对照组(P<0.01),白细胞数显著高于对照组和治疗组(P<0.05)。见表2。
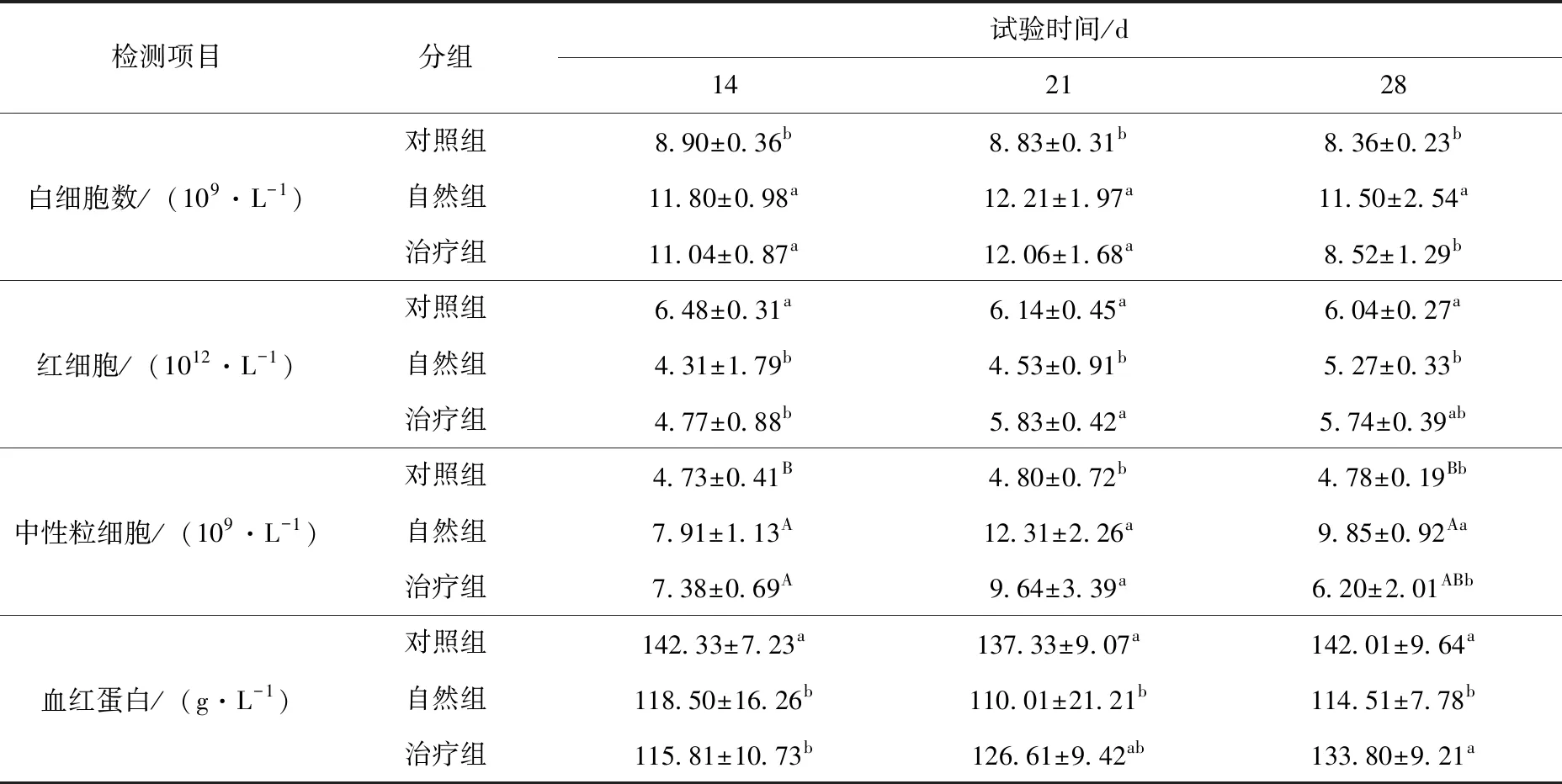
表2 治疗调理阶段不同处理组犬血常规指标的比较
2.3 各组犬血清肾功能指标的变化
预防调理阶段,第0天各组指标均无显著差异,酒精灌注后7 d造模组尿素氮含量显著高于对照组(P<0.05),肌酐含量显著高于对照组与治疗组(P<0.05);第14天造模组尿素氮、肌酐含量极显著高于对照组(P<0.01),预防组肌酐和尿素氮含量也略有升高但与对照组无显著差异(P>0.05)。见表3。

表3 预防调理阶段不同处理组犬肾功能指标的比较
治疗调理阶段,第14天自然组和治疗组尿素氮含量显著高于对照组(P<0.05),肌酐含量极显著高于对照组(P<0.01);第21~28天,自然组和治疗组尿素氮、肌酐含量都有所降低,但自然组尿素氮含量显著高于对照组和治疗组(P<0.05),自然组和治疗组肌酐含量显著高于对照组(P<0.05)。见表4。
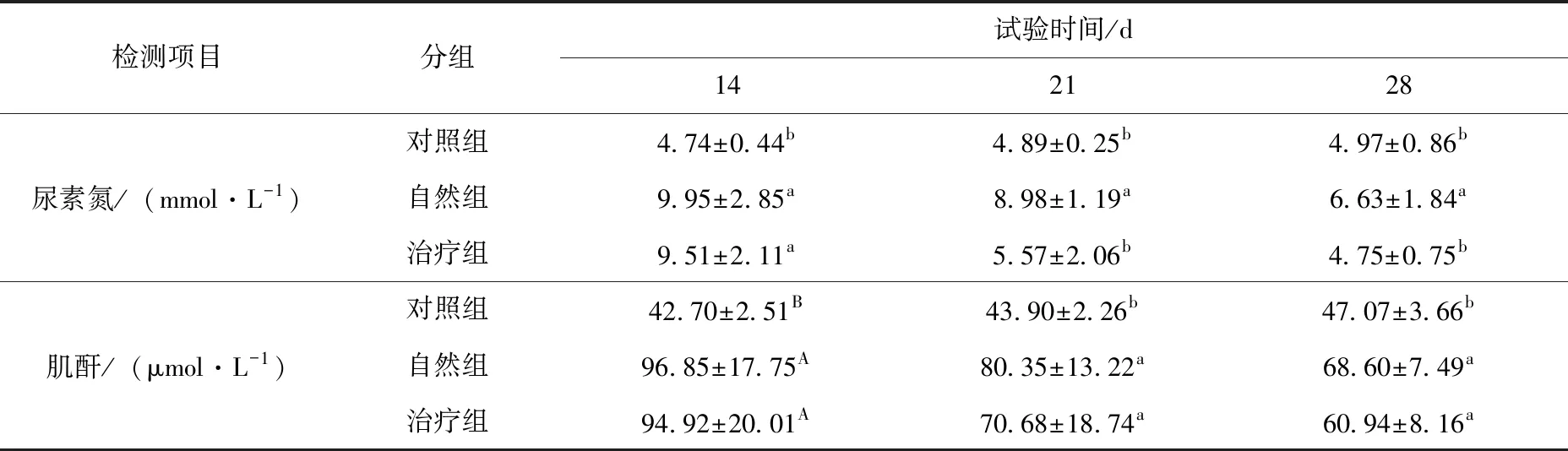
表4 治疗调理阶段不同处理组犬肾功能指标的比较
2.4 各组犬尿常规指标的变化
在预防调理试验中,第0天各组的白细胞、尿潜血、尿蛋白检测均为阴性;第7天预防组和造模组犬只尿液中白细胞、尿潜血、尿蛋白检测呈阳性;第14天造模组尿液中白细胞出现大量白细胞(+++),各组间尿液pH值无明显变化。在治疗调理试验第21天,自然恢复组犬尿液常规检测中白细胞、尿潜血、尿蛋白含量逐渐减少,治疗组尿潜血、尿蛋白检测转为弱阳性。治疗组犬只尿液的pH值与对照组略有下降但差异不显著(P>0.05)。见表5、6。
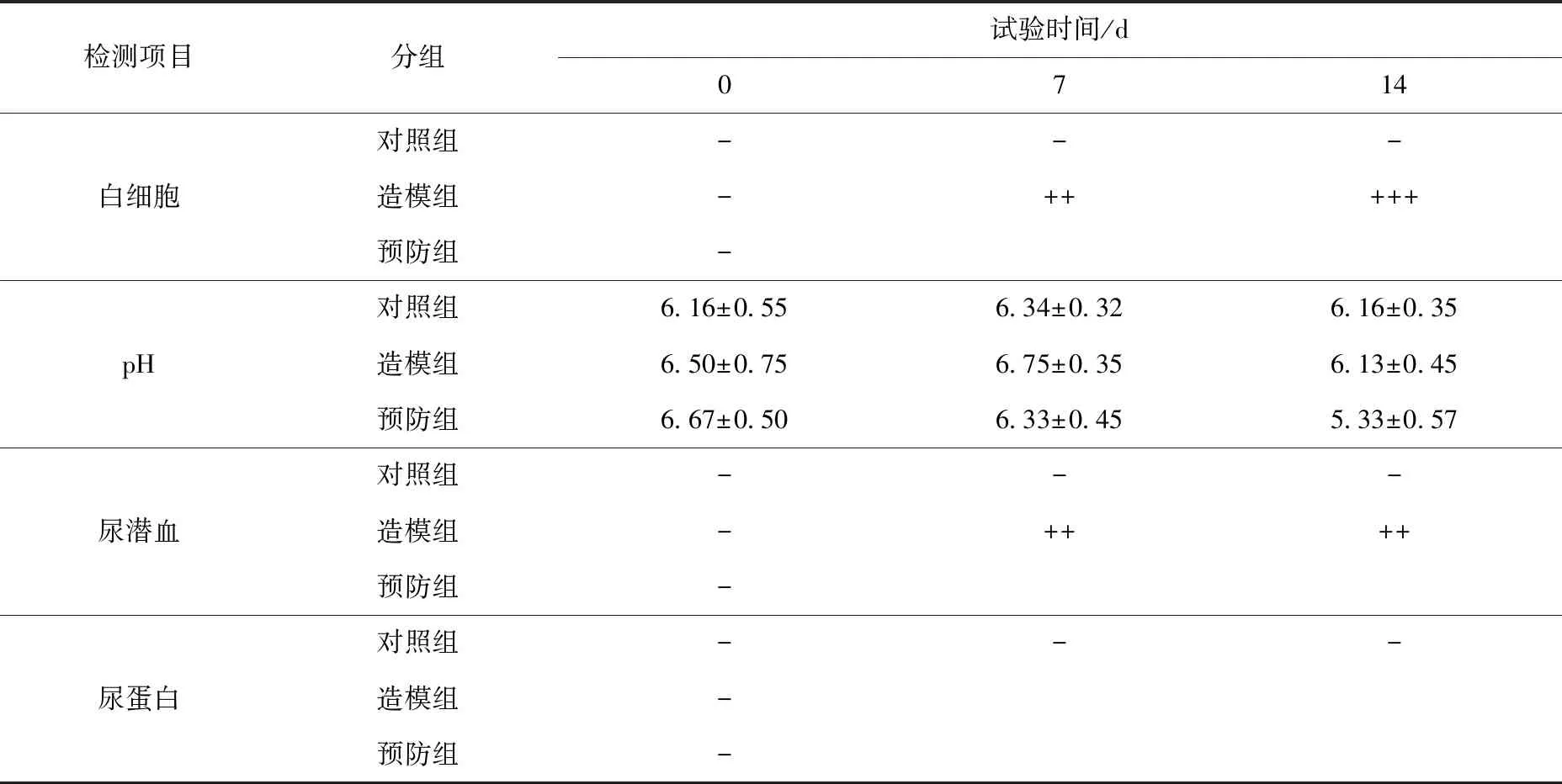
表5 预防调理阶段不同处理组犬尿常规的比较

表6 治疗调理阶段不同处理组犬尿常规的比较
2.5 炎性因子的变化
在预防调理试验中,第0天各组犬指标无显著差异,造模组犬血清中的TNF-α的浓度在第7 ~14天显著高于对照组(P<0.05),而预防组在TNF-α浓度在第7 ~14天略有升高与对照组差异不显著(P>0.05);犬血清中IL-6含量第7天造模组显著高于对照组(P<0.05),治疗组与对照组无显著差异(P>0.05),第14天造模组和预防组均极显著高于对照组(P<0.01);犬血液中CRP含量造模组7~14天持续上升与对照组差异极显著(P<0.01),预防组犬血液中CRP含量在第7天极显著高于对照组(P<0.01),第14天显著高于对照组(P<0.05)并极显著低于对照组(P<0.01)。见表7。
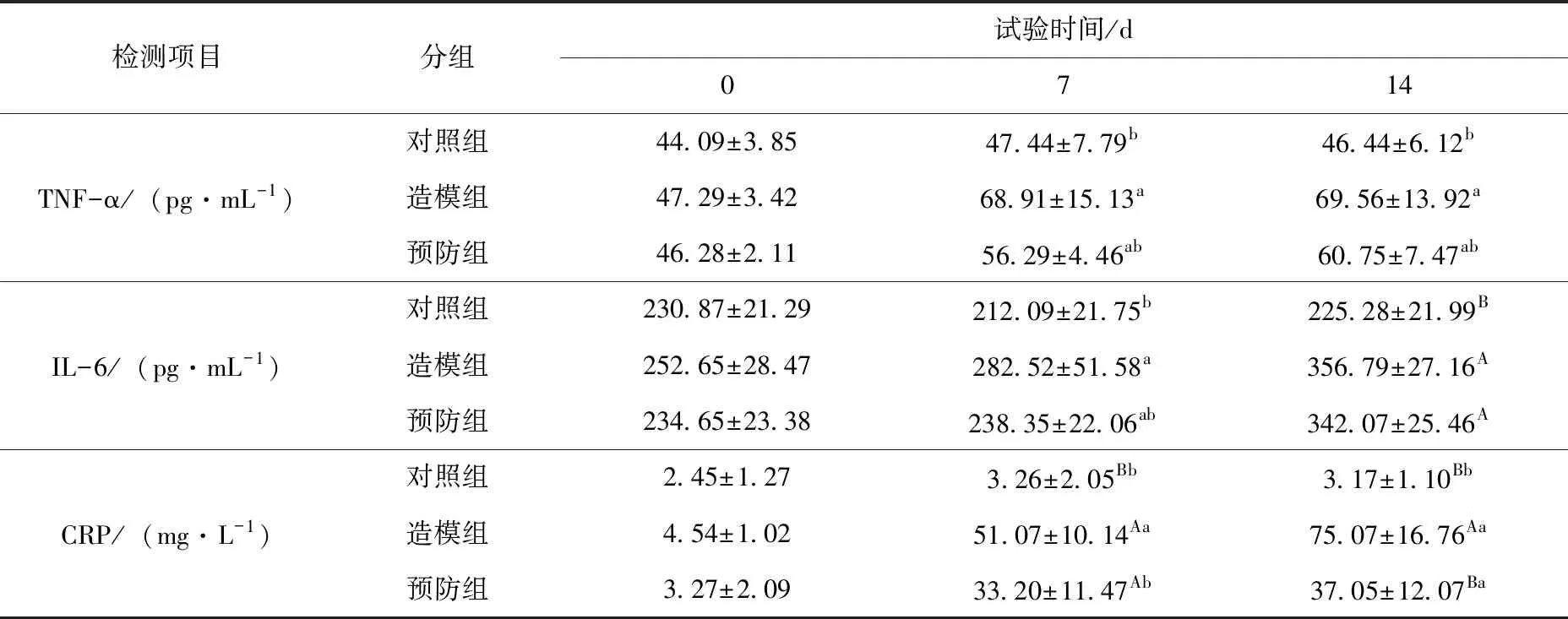
表7 预防调理阶段不同处理组犬炎性因子的变化
治疗调理试验中,经过1周处方粮饲喂在第21天治疗组犬血清TNF-α、IL-6的浓度与自然组相比显著下降(P<0.05),CRP浓度与自然组相比极显著下降(P<0.01),自然组犬TNF-α的浓度仍显著高于对照组(P<0.05),IL-6和CRP浓度极显著高于对照组(P<0.01);第28天自然恢复组IL-6浓度仍显著高于对照组和造模组,TNF-α和CRP浓度各组无显著差异(P>0.05)。见表8。

表8 治疗调理阶段不同处理组犬炎性因子的变化
2.6 各组犬尿沉渣检测
在试验第0天,各组犬只尿沉渣并无太多细胞内容物(图1A);试验第7天,造模组和预防组犬的的尿沉渣中均出现少量细胞形态不明显的内容物(见图1B、1C);试验第14天,造模组犬尿沉渣染色后在显微镜下观察发现大量的细胞,根据细胞的结构形态特征判断,其中有细胞核小而圆、细胞大而多角的的扁平膀胱上皮细胞和大量白细胞(见图1D),预防组少量的白细胞和纺锤型的尿路上皮细胞(见图1E);试验第21天自然恢复组有外形不规则,结构模糊,浆内充满粗大颗粒,细胞肿胀成团、界限模糊的脓细胞(见图1F),治疗组犬经过1周治疗调理后,尿沉渣中的白细胞和膀胱上皮细胞减少(见图1G);第28天自然恢复组仍存在少量的膀胱上皮细胞(见图1H),治疗组尿沉渣内容物基本消失(见图1I)。

A.对照组0天;B.造模组第7天;C.预防组第7天犬;D.造模组第14天;E.预防组第14天;F.自然恢复组第21天;G.治疗组第21天;H.自然恢复组第28天;I.治疗组第28天图1 各试验组犬尿沉渣检查结果 (400×)
3 讨论
利用复制的犬膀胱炎症模型,通过对犬的临床症状、血常规、肾功能、致炎因子、尿常规、尿沉渣等的检测,将犬泌尿道处方粮对犬膀胱炎的预防调理效果和治疗调理效果进行了一系列的试验研究。在预防调理试验中,用75%医用酒精进行膀胱灌注后,造模组和预防组犬只都出现了体温升高、尿血、尿淋漓、厌食、精神不振等症状,而造模组比预防组临床症状明显且持续时间长,预防组犬只第5天症状减轻,而预防组血清中的炎性因子以及尿液中白细胞的结果显示炎症并没有消除。由此推断在致病因素下,处方粮并不能阻止炎症的发生发展,也不能像消炎药物一样短时间内消除炎症,但具有清热舒缓、减轻犬的不适症状的作用。
中医认为膀胱湿热症属里热症,因湿热下行引起,需清下焦湿热,处方粮中添加的茯苓、泽泻是中医临床上常用的渗湿利水药[9]。处方粮中添加了陈皮、茯苓、车前子、泽泻及麦冬等中药成分,其中,茯苓、泽泻有利尿作用;车前子、麦冬、茯苓、泽泻均有抗炎抗肿瘤功效;陈皮、泽泻有泻热化浊等功效;茯苓、车前子、麦冬还可增强机体免疫力的作用[10-14],从利尿、抗炎抗菌、清热去火、增强机体免疫力的角度解决膀胱的湿热之症。
为进一步探究炎症的情况,再次对犬血清中TNF-α、IL-6、CRP浓度进行检测。CRP对全身性炎症的反应更迅速,相比于白细胞计数对炎症的提示更为灵敏,尤其是在炎症的加剧阶段[15-16];TNF-α作为炎症反应的主要诱导剂,在炎症反应过程中出现最早;IL-6作为反映机体炎症和组织损伤严重程度的重要指标,也是炎症反应的诱发剂[17]。在前14 d预防组、造模组犬只经过两次医用酒精膀胱灌注后,白细胞数只是正常范围内上升,而CRP浓度在第7天就已经达到重度炎症范围,第14天CRP的浓度仍持续显著上升,犬只血清中TNF-α、IL-6的浓度也迅速升高,犬血液中TNF-α、IL-6的浓度和CRP的浓度与炎症反应正相关,同时结合犬只有体温升高、频尿、有红色尿液等临床症状表明造模组犬的膀胱炎已经形成,预防组犬只血液中CRP、TNF-α浓度在第14天显著低于造模组。
在治疗调理试验中,治疗组犬只没有使用抗炎药物的情况下经过1周的处方粮饲喂,血液中CRP浓度率先下降至轻度炎症范围;血清中TNF-α的浓度与自然恢复组相比显著降低;尿液沉渣染色后观察到的大量白细胞和膀胱上皮细胞等有机沉渣大幅度减少,第2周治疗组症状基本消失,而自然组在第2周症状才有所减轻,表明泌尿道处方粮中的车前子、麦冬、茯苓、泽泻等中药成分对治疗组膀胱炎症有一定的利尿消炎调节作用。
由此可见,处方粮可以帮助治疗组犬只减少致炎因子对机体过长时间的损害和消耗,因此,在临床上如果在使用抗菌消炎药物治疗犬膀胱炎症的同时饲喂犬泌尿道处方粮,会加速炎症的消除,缩短致炎因子对泌尿系统黏膜的损害时间,更有利于日后的恢复,在犬只出现轻度膀胱炎症问题或发病幼犬不建议使用消炎药时,可饲喂犬泌尿道处方粮进行保守治疗调理。

