猪轮状病毒、猪札幌病毒和猪星状病毒三重PCR检测方法的建立及应用
曲雅新,孙连静,张胜斌,王若木,杨春杰,钟莲,周学光,黄克宏,罗期方,陈樱,韦祖樟,黄伟坚,欧阳康*
(1.广西大学动物科学技术学院,广西 南宁 530005;2.广西农垦永新畜牧集团西江有限公司,广西 贵港 537104)
猪轮状病毒(porcine rotavirus,PRoV)、猪札幌病毒(porcine Sapovirus,PoSaV)、猪星状病毒(porcine astrovirus,PAstV)是严重危害生猪养殖业的肠道病原,临床上常以腹泻、呕吐和厌食为特征[1-4]。猪轮状病毒属于呼肠孤病毒科(Reoviridae)轮状病毒属(Rotavirus),猪的A群PRoV是引起新生仔猪和断奶仔猪急性腹泻的常见病原体[5-7],此病毒在猪场中阳性感染率为3.30%~67.30%[2];猪星状病毒为星状病毒科(Astroviridae)成员,该病毒可感染各年龄段的猪[8-9]。2010年兰家暖等[10]曾对广西及广东腹泻猪粪便样品进行检测,发现猪星状病毒阳性率高达82.8%。猪札幌病毒是杯状病毒科(Caliciviridae)、札幌样病毒属成员,该病毒在全世界流行,断奶仔猪感染率最高且常呈混合感染,此病毒具有复杂的遗传多样性[11-13]。沈权[14]曾发现一株猪源毒株与人源毒株高度同源;陈琰[15]、Saif等[16]曾在粪便中发现札幌病毒、轮状病毒和星状病毒的混合感染。
猪群感染PRoV、PoSaV、PAstV后,其临床症状及病理变化相似,临床上难以区分,必须依靠实验室检测技术才能进行鉴别诊断,给猪群腹泻疾病的防控带来较大困难。目前常用的诊断方法有电镜观察、病毒的分离、血清学方法等,但是这些方法存在操作繁琐、耗时长等缺点,多重PCR检测方法因检测成本低廉、效率高、耗时短等被广泛应用于临床疾病的检测,另外,多重PCR检测方法更适用于临床混合感染的检测。本研究旨在建立快速、准确鉴别PRoV、PoSaV和PAstV临床感染的检测方法,为猪群腹泻疾病的监测和防控提供技术支持。
1 材料与方法
1.1 材料
1.1.1 毒株与临床病料样品
猪传染性胃肠炎病毒(TGEV)、猪流行性腹泻病毒(PEDV)、PRoV、PAstV、猪繁殖与呼吸综合征病毒(PRRSV)、猪伪狂犬病病毒(PRV)、猪圆环病毒2型(PCV2)均由本实验室分离并保存,PoSaV阳性材料为本实验室保存临床病料,猪瘟病毒(CSFV)阳性材料为本实验室所购疫苗。试验所用的80份临床样品为肠内容物,采自于2018年6月至2019年5月广西、广东以及云南等地发生腹泻的规模猪场。
1.1.2 主要试剂
病毒DNA/RNA提取试剂盒、2×TaqPlus Master Mix Ⅱ、DL1 000 DNA Marker购自北京康为世纪生物科技有限公司;pMD18-T载体、AMV反转录试剂盒、质粒抽提试剂盒等均购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 引物设计与合成
参考GenBank上发表的PRoV毒株(登录号:MF940551.1)、PoSaV毒株(登录号:KX688107)、PAstV毒株(登录号:KF787112.2)基因序列,在基因保守区域进行引物设计,应用Oligo 6.0软件对所选区域进行分析,设计出3对特异性引物(表1),分别用于PRoV VP6基因、PoSaV RdRp基因、PAstV ORF1基因的扩增,预期扩增片段分别为160、299和466 bp。引物序列由生物公司上海杰李合成。

表1 引物信息
1.2.2 RNA的提取与反转录
样品经12 000 r/min 4 ℃ 离心5 min后,取上清按照病毒DNA/RNA提取试剂盒说明书抽提病毒总RNA并进行反转录,产物于-20 ℃保存备用。
1.2.3 单重PCR扩增
以PRoV、PoSaV和PAstV的cDNA为模板,利用本研究设计的引物进行单重PCR检测,反应体系为:2×TaqPlus Master Mix Ⅱ 12.5 μL,上、下游引物各1 μL,cDNA模板3μL,加ddH2O至25 μL。反应条件为:94℃ 3 min;94℃ 30 s、51℃ 30 s、72℃ 40 s,30个循环;72℃ 5 min;4℃保存。扩增产物经1.5%的琼脂糖凝胶电泳检测。将得到的目的片段进行纯化并连接到pMD18-T载体,构建重组质粒p-PRoV,p-PoSaV和p-PAstV,将阳性质粒送至上海杰李生物技术有限公司进行测序。
1.2.4 三重PCR反应条件的优化
根据已建立好的单重PCR反应体系,对退火温度(48 ℃、49 ℃、50 ℃、51 ℃、52 ℃、53 ℃)进行优化;将引物终浓度稀释至0.125、0.250、0.375、0.500、0.625和0.750 pmol/μL,进行组合,筛选出最佳引物浓度;并对反应循环数(25、30、35、40、45)进行优化。
1.2.5 特异性试验
以PRoV、PoSaV、PAstV、PEDV、TGEV、CSFV、PRRSV的cDNA和PRV、PCV2的DNA为模板,在已建立的三重PCR反应条件的基础上进行PCR扩增,同时设置阴性对照,分析三重PCR的特异性。
1.2.6 敏感性试验
测定3种重组质粒的浓度并计算质粒拷贝数,将重组质粒等比例混合后,以10倍系列稀释至108~100拷贝数/μL,应用已建立的三重PCR方法进行扩增,同时设置阴性对照,分析三重PCR的敏感性。
1.2.7 重复性试验
以PRoV、PoSaV、PAstV的cDNA为模板,应用已建立的三重PCR方法进行扩增,共重复6次,同时设置阴性对照,验证本研究建立的三重PCR的重复性。
1.2.8 临床样品检测
应用本研究建立的三重PCR检测方法和单重PCR方法对所采集的80份腹泻样品同时进行检测,按照病毒DNA/RNA提取试剂盒说明书抽提病毒总RNA并进行反转录,对样品进行检测,将阳性样品的PCR扩增产物送至上海杰李生物技术有限公司进行测序。
2 结果
2.1 单重PCR扩增
以PRoV、PoSaV和PAstV的cDNA为模板,进行PCR扩增,获得大小为160、299和466 bp的目的片段(图1),将扩增的目的片段纯化后连接到pMD18-T载体,将阳性重组质粒进行测序,将测序序列与NCBI上公布的参考株序列比对,确认质粒上连接的片段为本研究扩增的目的片段。

M.DL1 000 Marker;1.目的基因片段;2.阴性对照;A.PRoV VP6基因片段;B.PoSaV RdRp基因片段;C.PAstV ORF1基因片段图1 PCR扩增结果
2.1 三重PCR反应条件的优化
通过对反应退火温度、引物浓度以及反应循环数进行优化,确定反应最佳退火温度为50 ℃(图2);PoSaV、PAstV的最佳引物浓度为0.125 pmol/μL,PRoV的最佳引物浓度为0.750 pmol/μL(图3);反应的最佳循环数为35(图4)。

M.DL1 000 Marker;1~6.退火温度分别为:48 ℃、49 ℃、50 ℃、51 ℃、52 ℃、53 ℃图2 三重PCR退火温度优化

M.DL1 000 Marker;1~6.PoSaV、PAstV的引物终浓度为0.125 pmol/μL,PRoV的引物终浓度分别为0.750、0.625、0.500、0.375、0.250和0.125 pmol/μL图3 引物浓度优化

M.DL1 000 Marker;1~5.循环数分别为25、30、35、40、45图4 循环数优化
2.2 特异性试验
用PRoV、PoSaV、PAstV、CSFV、PRRSV、PEDV、TGEV的cDNA和PRV、PCV2的DNA为模板,在已建立的三重PCR反应条件的基础上进行PCR(图5),结果显示,PEDV、TGEV、CSFV、PRRSV、PRV、PCV2均无扩增产物,说明三重PCR的特异性良好。

M.DL1 000 Marker;1.三重混合质粒;2.PRoV;3.PoSaV;4.PAstV;5~10.分别为CSFV、PRRSV、PEDV、TGEV、PRV、PCV2;11.阴性对照图5 三重PCR特异性试验
2.3 敏感性试验
测定3种重组质粒p-PRoV、p-PoSaV、p-PAstV的浓度并将质粒10倍系列进行稀释至108~100拷贝数/μL,用所建立的三重PCR方法进行检测(图6),结果显示,PRoV的最低检测限量为1.38×102拷贝数/μL;PoSaV的最低检测限量为8.33×102拷贝数/μL;PAstV的最低检测限量为4.40×103拷贝数/μL。三重PCR具有较好的敏感性。

M.DL1 000 Marker;1-9.重组质粒浓度分别为108~100 拷贝数/μL;10.阴性对照图6 三重PCR敏感性试验
2.4 重复性试验
用PRoV、PoSaV、PAstV的cDNA为模板,在已建立的三重PCR反应条件的基础上进行PCR(图7),共重复6次,同时设置阴性对照,结果显示,PRoV、PoSaV、PAstV三重PCR具有较好的重复性。

M.DL1 000 Marker;1~6.PRoV+PoSaV+PAstV;7.阴性对照图7 三重PCR重复性试验
2.5 三重PCR检测方法的临床应用
应用本研究建立的三重PCR检测方法对2018—2019年广西、广东以及云南等地规模猪场采集的80份临床腹泻样品进行检测,结果显示,PRoV、PoSaV及PAstV阳性样品均为4份,样品阳性率均为5.00%,其中有1份样品存在PRoV与PoSaV的混合感染,1份样品存在PAstV与PoSaV的混合感染,部分样品电泳图见图8。将单重PCR方法与本研究建立的三重PCR方法相对比,结果显示,2种方法的检测结果一致,阳性样品符合率为100%。阳性样品的扩增产物经测序验证,其结果相一致。
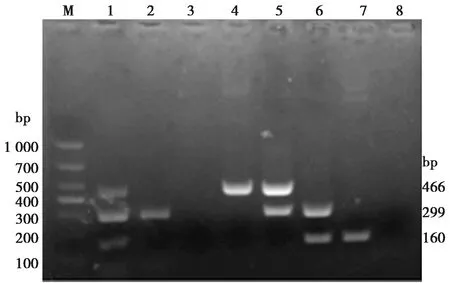
M.DL1 000 Marker;1.三重混合质粒;2~7.临床样品;8.阴性对照图8 三重PCR临床样品检测
3 讨论
近年来,在规模化猪场中因多种病毒混合感染引起猪腹泻的报道日益增多,严重危害生猪的养殖。由于PRoV、PoSaV和PAstV这3种病毒所引起的临床症状和病理变化相似很难区分,给疾病的诊断造成了不小的挑战,故需一种方法能够快速对其进行鉴别。多重PCR不仅克服了电镜观察、病毒分离、免疫组织化学、血清学等诊断技术操作复杂、准确率较低、耗时长等[17-18]缺点,且检测成本低廉、耗时短、效率高,故建立一种能够同时、快速检测出这3种病毒的检测方法在临床诊断和病原监测方面具有重要意义。目前,已报道有李军等[19]建立了TGEV、PEDV、PRoVA的多重荧光定量RT-PCR检测方法;罗欣[20]建立了诺如病毒GⅠ型和GⅡ型、腺病毒、星状病毒和札如病毒的五重PCR检测方法;杨文宇等[17]建立了PRoVA、PRoVC、PAstV三重PCR检测方法,但尚未有报道可同时鉴别PRoV、PoSaV和PAstV的检测方法。因此,本研究在3种病毒保守区设计引物建立一种特异、有效、敏感的鉴别诊断方法,为PRoV、PoSaV和PAstV的快速鉴别诊断以及流行病学调查提供帮助。
应用所建立的方法对2018年6月至2019年5月采自广西、广东、云南的80份临床腹泻样品进行检测,结果显示:各病毒感染率均为5%,轮状病毒检测结果与使用陈静[21]所设计的引物检测结果一致,猪星状病毒检测结果阳性率略高于实验室检测结果;同时试验还发现,在这80份临床腹泻样品中存在1例猪札幌病毒与猪轮状病毒以及1例猪札幌病毒与猪星状病毒的双重感染。对于病毒的混合感染,陆琰[15]、Saif等[16]使用免疫电镜法在腹泻仔猪的粪便中首次观察到猪札幌病毒,同时在该粪便中发现轮状病毒和星状病毒;Shimizu等[22]提出星状病毒在世界各国的猪群中普遍存在,发生单一病毒感染的情况很少见,这与本次试验所发现病毒存在混合感染的现象相似。在一定程度上提示生猪养殖时要加强多病原的预防。
有研究表明,猪源星状病毒有感染人类或其他物种的可能性[23]。已有文献报道来自动物的星状病毒和人源星状病毒之间的重组事件[24];猪源札幌病毒与人源札幌病毒具有较高同源性[25-27],且已分离到由人源和猪源札幌病毒之间通过基因重组产生的新毒株[28-30],这提示札幌病毒可能具有在人与动物之间跨种传播的能力。同样轮状病毒在婴儿和其他哺乳动物中广泛存在,也是引起新生仔猪和断奶仔猪急性腹泻最常见的因素,易继发细菌感染[7]。
综上所述,本研究建立的猪轮状病毒、猪札幌病毒和猪星状病毒三重PCR检测方法不仅为猪场腹泻病的监测和防控提供技术支持,更是对潜在人畜共患病的监测具有公共卫生意义。

