细胞周期检查点激酶1的表达对猪卵母细胞体外成熟的影响
韩国波,李英花,叶孟傲然,许永男,2*
(1.延边大学农学院,吉林 延吉 133000;2.吉林省延边黄牛种质资源保护工程研究中心,吉林 延吉 133000)
卵母细胞的成熟是指卵母细胞在受到多种因素的影响下其活性得以激活,完成第一次减数分裂进入到第二次减数分裂中期的过程,其中生发泡破裂(GVBD)是减数分裂恢复的标志。卵母细胞开始减数分裂前的停滞和从MI到MII是其减数分裂的两个非常重要的时期,也是阻碍其成熟的两个主要原因[1-2]。Chk1是细胞周期中的一套保证DNA复制和染色体分配质量的检查机制,是一类负反馈调节机制。当细胞周期进程中出现异常事件,如DNA损伤或DNA复制受阻时,这类调节机制就被激活,及时地中断细胞周期的运行,待细胞修复或排除故障后,细胞周期才能恢复运转[3-4]。研究Chk1在猪卵母细胞中的表达和定位及其对猪卵母细胞减数分裂的影响,对于改善猪卵母细胞体外成熟具有重要意义。
有研究表明,Chk1对小鼠卵母细胞减数分裂前的停滞是必需的,消耗Chk1会加速小鼠卵母细胞的GVBD,其过表达会使小鼠卵母细胞纺锤体组装检查点(SAC)活化,并阻碍卵母细胞的成熟[5];而猪卵母细胞的成熟不需要Chk1,但Chk1的敲低会延缓卵母细胞的成熟,并对染色体的排列有影响[6]。卵母细胞减数分裂的重新开始与细胞周期蛋白依赖性激酶1(CDK1)的活动密切相关,Chk1可抑制细胞周期调控因子Cdc25,使CDK1和CDK2失活,DNA不能被复制;此外,它有助于丝氨酸/苏氨酸蛋白激酶(Wee1/Myt1)的磷酸化,使Wee1/Myt1更稳定[7-8]。Chk1也在SAC调节中发挥作用,在有丝分裂中SAC通过延缓姐妹染色单体分离,直到所有姐妹染色单体的着丝粒与两极的纺锤丝相连接,来防止染色体的异常分离[9]。停在减数分裂初期的卵母细胞,其CDK1的活性由几个因素调节而维持在较低程度。细胞周期蛋白B(Cyclin B)是CDK1相关蛋白,通过去磷酸化来激活CDK1;Cdc25磷酸酶在哺乳动物中包括Cdc25A、Cdc25B、Cdc25C,负责CDK1的Thr14、Tyr15位点的去磷酸化来激活CDK1;Wee1/Myt1激酶家族通过磷酸化CDK1的Thr14和Tyr15位点负调控CDK1;Gwl激酶通过与ENSA/ARPP19相互作用抑制蛋白磷酸酶2A(PP2A)的激活,PP2A可负调节CDK1的活化。在G2中,由于CDK1在Thr14和Tyr15被Wee1/Myt1激酶家族磷酸化,因此,卵母细胞促成熟因子(MPF)被抑制,当细胞进入M期时,磷酸酶Cdc25被激活,通过去磷酸化CDK1在Thr14和Tyr15的磷酸位点来激活CDK1,CDK1反过来磷酸化自己的调节器,从而增强Wee1/Myt1抑制和Cdc25激活[10-13]。
已知chir-124是一种基于喹诺酮的小分子,在结构上与其他已知的Chk1抑制剂无关,它在体外有效地和选择性地抑制Chk1[14]。本研究采用chir-124代替向卵母细胞内注射干扰RNA的方法来消耗Chk1,以进一步研究Chk1对猪卵母细胞减数分裂成熟的影响,并为进一步提高猪卵母细胞成熟的效率提供参考依据。
1 材料与方法
1.1 主要试剂及仪器
组织培养基(TCM-199)、磷酸盐缓冲盐水(PBS)、透明质酸酶(Hy)、聚乙烯醇(Hepes-TL-PVA)、Triton X-100、anti-tubulin、Hoechst 33342均购自Sigma公司。立体显微镜购自OLYMPUS公司;共聚焦显微镜购自尼康公司;荧光定量PCR仪购自安捷伦公司;培养箱购自ESCO公司。
1.2 方法
1.2.1 卵母细胞的收集和培养
从屠宰场收集猪卵巢放入到添加有75 ng/L青霉素G和50 ng/L硫酸链霉素的磷酸盐缓冲盐水(DPBS)中运输到实验室。用配备有18号针头的10 mL注射器反复抽取卵巢上的2~8 mm卵泡,将卵泡液放入15 mL离心管中,在37 ℃水浴中静置15 min后弃去上清液,加入Hepes-TL-PVA清洗液重悬沉淀,再次静置15 min后弃去上清液,反复2次。将重悬液放入直径为90 mm培养皿中,在显微镜下,用口吸管挑选卵丘包裹3层以上且细胞质均匀的卵丘细胞-卵母细胞复合体(cumulus-oocyte complexes,COCs)。挑选完成后用培养液洗涤3遍,转入培养皿中平衡4 h左右的成熟培养液滴内(25枚/100 μL),放入培养箱里(39 ℃,5% CO2),用矿物油覆盖。
1.2.2 不同浓度chir-124处理卵母细胞
将chir-124溶于二甲基亚砜(DMSO)中保存,使用时用TCM199培养液稀释。将GV期卵母细胞分别放入含有0、0.1、0.5和1 μmol/L的chir-124 TCM199培养基中,覆盖石蜡油后在39 ℃,5% CO2培养箱中培养。在15 h时收集卵母细胞,进行免疫荧光染色(使用Hoechst 33342对卵母细胞进行活染,观察其细胞核),并统计卵母细胞处于各时期(GV-Ⅰ,GV-Ⅱ,GV-Ⅲ,GV-Ⅳ 4个时期)的数量。随后在18 h时收集卵母细胞,观察并统计到达GVBD的卵母细胞。
1.2.3 0.5 μmol/L chir-124处理卵母细胞
使用0.5 μmol/L chir-124在卵母细胞成熟的不同时期进行处理,处理时间分别为0~24 h、0~44 h、24~44 h(分别对应GV期到GVBD期、GV期到MII期、GVBD期到MII期),随后统计各阶段卵母细胞的比率。
1.2.4 减数分裂相关基因的检测
应用实时荧光定量PCR进行检测。分别在0和0.5 μmol/L chir-124处理组各取20个GVBD期卵母细胞放入不含Ca2+和Mg2+的PBS中清洗,于液氮中迅速冷冻,-80 ℃保存备用。使用Dynabeads mRNA Kit提取mRNA,利用Oligo(dT)12-18引物和SuperScript逆转录酶对RNA进行反转录,获得cDNA。用特异性引物(见表1)对chk1、cdk1、cdc25C、cyclinb1、gwl的mRNA进行实时荧光定量PCR检测。根据DyNSmo SYBR Green qPCR Kit方法进行反应。PCR反应程序:95 ℃预变性10 min;95 ℃变性10 s,退火30 s,72 ℃延伸30 s,40个循环。熔解曲线分析:65~95 ℃,加热速率0.2 ℃/s,连续荧光测量,在实时荧光定量PCR反应中加入SYBR Green,得到最终冷却到12 ℃的荧光数据。通过生成熔解曲线对实时荧光定量PCR产物进行分析。应用2-ΔΔCt法分析基因表达的相对定量。
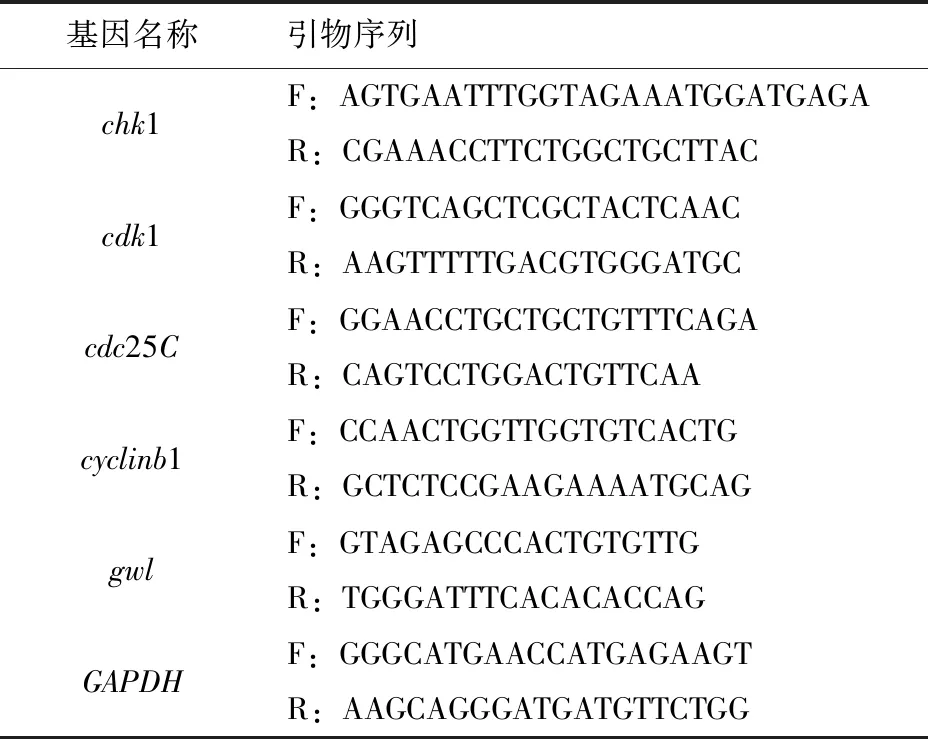
表1 引物序列
1.2.5 免疫荧光染色
将卵母细胞经0.1% PVA-PBS洗涤3次后,放入添有3.7%多聚甲醛的PVA-PBS中,在室温下固定20 min,然后转移到含0.5%的Triton X-100的PVA-PBS中透膜1 h;室温下用PBS(含1% BSA)清洗5~8次,每次3 min,放入 PBS(含1% BSA)中在室温下封闭1 h,之后在一抗中避光、4 ℃孵育过夜,抗体的稀释比例是anti-tubulin(1∶200),anti-chk1(1∶200);第二天用PBS(含0.1% Tween 20 和 0.01% Triton X-100)室温洗脱一抗6次,每次3 min,然后用二抗稀释液在室温下孵育1 h,稀释液用PBS(1∶100 Alexa Fluor 488 goat-anti-mouse IgG);PBS(含0.1% Tween 20 和 0.01% Triton X-100)清洗6次,用Hoechst 33342 复染核;最后将卵母细胞放到玻璃载玻片上封片,在共聚焦显微镜下拍照。使用Image J软件进行荧光强度分析。
1.3 统计分析
每个试验设有3次重复,试验数据均使用SAS程序进行差异显著性分析,所有数据用平均值±标准误表示,以P<0.05为差异显著性判断标准。
2 结果
2.1 Chk1在猪卵母细胞成熟过程中的表达和定位
Chk1在猪卵母细胞减数分裂4个阶段的表达与定位分别见图1与图2。结果表明,chk1 mRNA在GV期向GVBD期过渡阶段的表达水平下降,在GVBD期到MI期阶段的表达水平显著升高(P<0.05),并且持续到MII期(图1)。同时,Chk1蛋白在GV期主要定位在生发泡内,在 GVBD期主要定位在核的周围,在MI期和MII期主要定位在纺锤体上(图2)。

注:不同字母表示差异显著(P<0.05);相同字母或无字母标注表示差异不显著(P>0.05)。下同图1 chk1 mRNA在猪卵母细胞成熟过程中各个时期的表达水平
2.2 不同浓度chir-124对猪卵母细胞恢复减数分裂的影响
GV期卵母细胞的四个阶段如图3所示,用不同浓度(0、0.1、0.5及1 μmol/L)的chir-124对GV期的猪卵母细胞进行处理后,观察卵母细胞处于各个时期的比例如图4和图5所示。用0.5μmol/L的chir-124处理的卵母细胞在GV期前3个阶段的影响与其他3组无显著差异;但是在GV-IV阶段其影响显著高于其他3组(P<0.05)。而且0.5μmol/L chir-124处理的卵母细胞到达GVBD期的百分率显著高于其他3组(P<0.05)。

DAPI.细胞核(蓝色荧光);Chk1.Chk1蛋白(红色荧光);Merged.合成图图2 Chk1蛋白在猪卵母细胞成熟过程中各个时期的定位(40×)

图3 猪卵母细胞GV期的4个阶段(40×)

图4 不同浓度chir-124对GV期猪卵母细胞比率的影响

图5 chir-124对猪卵母细胞GV期达到GVBD期比率的影响
2.3 降低Chk1的表达水平对卵母细胞GVBD及随后成熟的影响
为了进一步研究Chk1在猪卵母细胞成熟过程中的作用,用0.5 μmol/L chir-124在卵母细胞成熟的不同时期进行处理,结果见图6。从GV期开始处理卵母细胞后,发育到GVBD期(图6A)和MII期(图6B)的比率均显著高于对照组(P<0.05)。然而,从GVBD期开始处理卵母细胞,到达MII期的比率与对照组相比差异不显著(图6C)。

A.0~24 h;B.0~44 h;C.24~44 h图6 chir-124处理不同时期猪卵母细胞的GVBD与MII百分率
2.4 chir-124处理猪卵母细胞对减数分裂相关基因表达的影响
如图7所示,与对照组相比,0.5 μmol/L chir-124处理chk1 mRNA表达水平显著降低(P<0.05),同时gwlmRNA表达水平也显著降低(P<0.05),cdc25C、cdk1和cyclinb1 mRNA表达水平的与对照组相比,有增加但无显著差异。

图7 chir-124处理对减数分裂相关基因表达的影响
2.5 Chk1的表达对第二次减数分裂的影响
如图8所示,通过共聚焦显微镜观察纺锤体的变化,与试验组相比,对照组MI期染色体没有完全分离;试验组MI期、MII期纺锤体发生了很大变化,而对照组两个时期的纺锤体几乎没有变化。

DAPI.细胞核(蓝色荧光);Tubulin.纺锤体(绿色荧光);Merged.合成图图8 猪卵母细胞MI期和MII期的纺锤体形态(大图10×;小图40×)
3 讨论
3.1 Chk1在猪卵母细胞成熟过程中的表达和定位
Chk1被报道在卵母细胞成熟的每个阶段都有表达[5-6]。为此,本研究在猪卵母细胞成熟的4个阶段(GV、GVBD、MI和MII期)分别检测了Chk1的表达与定位。结果显示,Chk1从GV期到MII期的各个时期都有表达,在MI期和MII期含量急剧升高,这表明细胞周期在这两个阶段容易受到干扰。此外,研究还发现Chk1随着纺锤体的形成而产生变化,也表明Chk1可能通过影响纺锤体功能进而影响猪卵母细胞的成熟。
3.2 不同浓度chir-124对猪卵母细胞恢复减数分裂的影响
卵母细胞GV期可以根据待成熟时受抑制状态的生发泡的发育程度进一步分为GV-Ⅰ、GV-Ⅱ、GV-Ⅲ和GV-Ⅳ 4个阶段[15]。根据Tao等[16]的研究,本研究用不同浓度的chir-124对GV期的猪卵母细胞进行处理,然后将卵母细胞分别定位于GV期的不同阶段。结果显示,所有处理组处于GV-Ⅰ期的卵母细胞比率均比对照组低,说明Chk1的消耗加快了卵母细胞从GV-Ⅰ期发育到GV-Ⅳ期的速度,且用0.5μmol/L的chir-124处理时卵母细胞达到GV-Ⅳ的比率显著高于对照组。因此,在后续的试验中都使用了这个浓度。
3.3 降低Chk1的表达水平对卵母细胞GVBD及随后成熟的影响
在小鼠中,降低Chk1的表达可以促进卵母细胞到达GVBD的速率,但是对后续的减数分裂进程没有影响[5]。然而在猪卵母细胞中,Chk1的耗竭会降低卵母细胞成熟的速率,并对MI期卵母细胞的染色体排列产生不利影响[6]。本研究中,用0.5 μmol/L chir-124对GV期猪卵母细胞进行处理后,发现Chk1的消耗显著增加了猪卵母细胞达到GVBD的比率,并且相应地增加了达到MII期的比率,但是在GVBD后再处理chir-124消耗Chk1时,这种促进效果消失。因此,推测Chk1只是在GVBD前对猪卵母细胞的成熟有影响,即加快卵母细胞到达GVBD 的速率,但对随后的成熟没有影响。这与Nie等[6]的结果相反,可能是由于处理方法不同,对Chk1相关基因的表达产生了不同的影响,具体机制仍有待探究。
3.4 chir-124处理猪卵母细胞对减数分裂相关基因表达的影响
DNA损伤检查点由ATM、ATR、Chk1或Chk2、Cdc25和其他相关的下游蛋白组成,通过信号通路ATM/ATR-Chk1/Chk2-Cdc25对细胞生长具有广泛的作用[17-18]。其中Cdc25的磷酸化会导致CDK1的失活,而细胞减数分裂的开始与CDK1的活性密切相关[19]。本研究检测了MII期卵母细胞中与CDK1相关基因的表达量,发现Chk1的消耗显著降低了gwl基因的表达,并且略微提升了cdc25C和cyclinb1基因的表达水平。其中,gwl基因负反馈调节cdk1基因,cdc25C和cyclinb1正反馈调节cdk1基因的去磷酸化,使其保持相对较高的活性水平[20-22],进而促进卵母细胞恢复减数分裂的进程。
3.5 Chk1的表达对第二次减数分裂的影响
Chk1对于SAC的功能和将BubR1募集到动粒中是必需的[23]。在小鼠卵母细胞中,Chk1的消耗对于SAC的功能没有影响,但是Chk1的过表达激活了SAC并阻止同源染色体的分离[5]。在猪卵母细胞中,Chk1的消耗减少了SAC相关蛋白的表达量[6]。本研究发现,对照组MI期和MII期卵母细胞的染色体数量与状态一致,即卵母细胞没有渡过MI期,停滞在MI期;而chir-124处理组的卵母细胞,MII期的染色体数量相较于MI期明显减半,说明Chk1的表达会活化SAC,从而阻止同源染色体的分离,将卵母细胞固定在MI期。
4 结论
在猪卵母细胞体外成熟的GV期添加0.5 μmol/L chir-124来抑制Chk1的活性,可以促进猪卵母细胞恢复减数分裂,并促进后续的成熟。

