玉带凤蝶铁蛋白亚基的鉴定及组织表达谱分析*
江嘉玲,张 芹,胡 艳,黄 婧,宋见春,卢占军,2,†
(1.赣南师范大学 生命科学学院;2.国家脐橙工程技术研究中心,江西 赣州 341000)
铁是生命活动过程中的重要元素,作为辅因子,广泛参与DNA的合成,氧代谢、三羧酸循环、激素以及氨基酸的合成等过程[1-2].然而,铁过量也会对细胞产生毒性[3].因此,保持生物体内铁离子的平衡至关重要.在生物体中,90%以上的铁都与蛋白质紧密结合,这些含铁蛋白质具有重要的生物学功能,主要包括运输铁离子的转铁蛋白(Transferrin)和储存铁离子的铁蛋白(Ferritin).
铁蛋白是普遍存在于生物界的一种高度保守的多功能蛋白,其广泛分布于动物、植物和微生物中,由重链同源亚基(heavy chain homology,HCH)和轻链同源亚基(light chain homology,LCH)组成的分子量约为400-600 kDa的球形蛋白,而这些亚基组成4, 3, 2点对称或八面体对称的空心球体,空腔内可以容纳4500个铁原子[4-5].然而,机体中的铁蛋白重链亚基和轻链亚基的功能并不一样,重链亚基主要参与铁离子的快速解毒,而轻链亚基在铁离子的成核、矿化以及长期储存过程中起着关键作用[6].近年来,昆虫铁蛋白的功能一直是研究的热点.晶体结构分析揭示昆虫铁蛋白由12个HCH和12个LCH组成的四面体对称结构,与哺乳动物铁蛋白复合体形成的八面体对称结构类似[4].Dunkov等人从家蚕基因组中鉴定3个与铁蛋白相关的蛋白:Fer1HCH,Fer2LCH和Fer3HCH,家蚕铁蛋白的重链亚基与大部分昆虫铁蛋白都具有高度保守的铁氧化酶活性中心[7].Georgeva等人采用RNA印迹法对果蝇(Drosophilamelanogaster)铁蛋白重链亚基进行了研究,结果显示存在三个杂交条带,推测可能是由于可变剪切产生[8].在东方果实蝇(Bactroceradorsalis)中,轻链亚基受转录后以及可变剪切机制共同调控,最终导致提前产生终止密码[9].此外,铁蛋白也从一些鱼类和贝类等海洋生物中被鉴定,包括鲍鱼(Haliotisdiversicolor),刺参(Stichopusmonotuberculatus)以及扇贝(Chlamysfarreri)[10-11].
铁作为重要的金属离子参与宿主许多重要的生理过程,同时也是病原菌入侵的营养来源.因此,铁在免疫过程中也发挥着重要作用.宿主一旦感染病原菌,生物体中的铁蛋白含量将发生显著性的变化.例如甲虫(Protaetiabrevitarsis)感染白僵菌(Beauveriabassiana)后,血液中的铁含量明显增加[12].在绿棉铃虫(Heliothisvirescens)病毒刺激以后,血液中的铁含量也增加[13].这些研究暗示了铁含量的变化在病原菌与宿主之间互作关系中作为重要的指标.Boran等人利用抑制消减杂交分析赤拟谷盗(Triboliumcastaneum)注射脂多糖后铁蛋白主要参与免疫防御和信号传导.同样在蓖麻蚕(Samiacynthiaricini)中,金黄色葡萄球菌(Staphylococcusaureus)和绿脓杆菌(Pseudomonasaeruginosa)能显著的诱导铁蛋白重链亚基基因上调表达[14].另一方面,过量的2价铁能够通过芬顿反应(Fenton reaction)被氧化为3价铁,同时产生大量的羟基自由基,对细胞产生毒害作用,从而使蛋白质变性、脂质过氧化和DNA断裂等[15].然而,有关玉带凤蝶(Papiliopolytes)铁蛋白的功能还未见报道.
玉带凤蝶P.polytes属于鳞翅目凤蝶科,在我国广为分布,其幼虫是危害柑橘类植物的重要害虫[16].当前,玉带凤蝶的防治主要依靠化学杀虫剂,不仅污染环境,而且使害虫的抗药性明显增强.因此,从害虫本身出发,对关键基因的结构以及功能解析可以更好的防治害虫[14].本研究从玉带凤蝶基因组数据库中鉴定到铁蛋白的2个亚基基因:PpFerHCH和PpFerLCH,通过生物信息学和荧光定量PCR分析2个基因的组织表达谱以及铁离子胁迫下的表达水平,为进一步研究玉带凤蝶铁蛋白的功能奠定基础,同时也对开发绿色新型生物杀虫剂提供了新思路.
1 材料与方法
1.1 供试昆虫与样品收集
玉带凤蝶采集自赣南师范大学国家脐橙工程技术研究中心种质资源圃内,分别取玉带凤蝶5龄第1天幼虫的头部、中肠、血淋巴、表皮、马氏管和脂肪体等组织.铁离子胁迫材料的准备参考Fei等人的方法[17],取5龄第1天的玉带凤蝶,经口添食10 μL10% FeCl3溶液,对照组添食10 μL 0.85%NaCl溶液,24 h以后收集中肠组织,实验分成3组,每组20头,并用液氮迅速冷冻,置于-80 ℃保存备用.
1.2 主要试剂和仪器
DH5α大肠杆菌和pMD19-T克隆载体由本实验室保存;Trizol试剂购自Invitrogen(北京)公司;胶回收试剂盒、PrimeScriptTM1st Strand cDNA synthesis Kit和SYBR Green Ⅱ购自TaKaRa(大连)公司;所用的引物通过Primer premier 5.0软件设计,并由上海生物工程有限公司合成.NanoDrop 2000 spectrophotometer购自Thermo Fisher Scientific(上海)公司;LightCycle?96 PCR Detection System购自Roche(上海)公司.
1.3 实验方法
1.3.1 玉带凤蝶各组织总RNA提取及cDNA的合成
采用Trizol法提取玉带凤蝶各组织的总RNA,具体参考蓖麻蚕组织RNA提取方法[14].取100 mg组织加入液氮充分研磨成粉末,加入1 mL Trizol充分混匀,室温静置5 min;加入200 μL酸性酚,200 μL氯仿后振荡混匀,室温静置3 min;后取上清液(重复该过程1次);加入等体积的异丙醇混匀;室温静置10 min,4 ℃,12,000 g,离心15 min后去除上清液;加入1 mL 75%的乙醇(DEPC水配置)重悬沉淀,4 ℃,7 500 g,离心5 min,去除上清;室温干燥8 min以去除多余的乙醇,然后加入适量的DEPC水充分溶解RNA,并通过紫外光分光光度计检测RNA的浓度及纯度.将总RNA使用PrimeScriptTM1st Strand cDNA synthesis Kit反转录试剂盒处理,并按照试剂盒说明书完成cDNA第一链的合成,以此作为PCR的模板.
1.3.2 玉带凤蝶铁蛋白亚基PpFerHCH和PpFerLCH的鉴定
根据GenBank上已经发表的鳞翅目昆虫铁蛋白的重链亚基和轻链亚基的蛋白质序列,包括家蚕(Bombyxmori)、烟草天蛾(Manducasexta)、大蜡螟(Galleriamellonella)和蓖麻蚕(Samiacynthiaricini),通过BLASTX软件对玉带凤蝶基因组数据库进行搜索,获得2个包含完整开放阅读框的铁蛋白轻链亚基和重链亚基的序列,利用Primer premier 5.0软件设计引物扩增2个基因的开放阅读框并送至生物公司进行测序.
1.3.3 生物信息学分析
通过DNAMAN7.0软件分析目的基因cDNA序列的开放阅读框和氨基酸序列;序列同源性搜索使用BLAST工具(http://www.ncbi.nlm.nih.gov/BLAST);采用DNAMAN软件对目的基因和其他昆虫同源序列进行多重序列比对,利用Expasy在线软件(https://web.expasy.org/compute_pi/)预测目标蛋白的理论分子量和等电点;利用MEGA5.2软件的邻近法构建系统发育树;利用SMART在线软件(http://smart.embl-heidelberg.de/)对蛋白质的结构域进行分析.
1.3.4 内参基因的确立
通过搜索玉带凤蝶基因组数据库,获得了4个不同功能的内参基因,即肌动蛋白A1(Actin-A1,登录号:)、核糖体蛋白60(RP60,登录号:)、3-磷酸甘油醛脱氢酶(GAPDH,登录号:)和E2F转录因子4(E2F4,登录号:).根据核苷酸序列运用Primer Premier5.0软件设计特异性表达引物(表1),并在NCBI数据库中进行引物特异性比对.

表1 引物序列
1.3.5 基因的时空表达分析
取玉带凤蝶5龄第1天幼虫的头、中肠、血液、脂肪体、马氏管和表皮,分别提取总RNA并反转录成cDNA.利用荧光定量PCR和半定量PCR分析4个内参基因在玉带凤蝶不同组织中的表达水平,确定合适的内参基因.利用荧光定量PCR检测2个基因在幼虫不同组织和铁离子胁迫后的表达水平.反应体系为SYBR 10 μL,ROX 0.4 μL,上游引物1.0 μL,下游引物1.0 μL,cDNA模板1.0 μL,用ddH2O补齐至20 μL.反应条件为:50 ℃预热2 min;95 ℃预变性10 min;95 ℃ 15 s,60 ℃ 1 min,40个循环.实验用3次独立样品重复3次.反应均在ABI Prism 7500 Fast Detection System(Applied Biosytems)实时定量PCR 仪上完成.
2 结果分析
2.1 PpFerHCH和PpFerLCH开放阅读框的克隆与分析
以玉带凤蝶中肠cDNA为模板,根据其设计的特异性引物,对PpFerHCH和PpFerLCH的开放阅读框进行PCR扩增,分别得到636 bp和696 bp的特异性片段(图1).通过序列比对,结果显示PpFerHCH基因的cDNA全长为1300 bp,编码211个氨基酸,预测的理论分子量为23.7 kDa,等电点为6.53.PpFerLCH基因的cDNA全长为1 207 bp,编码231个氨基酸,预测的理论分子量为26.5 kDa,等电点为5.64.

图1 玉带凤蝶PpFerHCH和PpFerLCH基因开放阅读框的PCR扩增
SMART软件分析显示PpFerHCH和PpFerLCH都含有一个信号肽和一个保守的铁蛋白结构域(图2).多重序列比对分析显示PpFerHCH和PpFerLCH与其他已知昆虫铁蛋白相似性非常高,氨基酸序列的一致性介于之间,并与烟草天蛾蛋白序列一致性最高,表明玉带凤蝶铁蛋白亚基在物种间比较保守.

图2 玉带凤蝶PpFerHCH和PpFerLCH基因cDNA序列及其编码氨基酸序列(双下划线表示铁离子结合中心;方框表示预测的信号肽;单下划线表示铁蛋白结构域) 图3 玉带凤蝶PpFerLCH及其同源基因推导的氨基酸序列的多序列比对结果
基于不同昆虫铁蛋白重链亚基和轻链亚基的氨基酸序列,对玉带凤蝶的铁蛋白亚基进行了系统发育树分析,如图5所示,昆虫的铁蛋白重链亚基和轻链亚基分别聚类到一起,其中,玉带凤蝶铁蛋白重链亚基(PpFerHCH)与烟草天蛾铁蛋白重链亚基的亲缘关系最近,而玉带凤蝶铁蛋白轻链亚基(PpFerLCH)主要与烟草天蛾和大蜡螟保持较高的同源性.这些结果进一步反应出了鳞翅目昆虫中铁蛋白亚基的保守性.

图4 玉带凤蝶PpFerHCH及其同源基因推导的氨基酸序列的多序列比对结果 图5 玉带凤蝶PpFerHCH和PpFerLCH与其他昆虫铁蛋白亚基的系统进化树枝上显示bootstrap 1000个循环的置信度
2.2 内参基因的特异性验证
为了筛选5龄玉带凤蝶不同组织的最适内参基因,通过半定量PCR和荧光定量PCR对4个筛选出的基因进行验证,结果如图6A所示,ActinA1和E2F4在不同组织中的表达水平显示较大的波动性,而GAPDH和RP60在不同组织中的相对表达量比较稳定.荧光定量PCR结果与半定量结果相一致,但是RP60的稳定性要显著高于GAPDH(图6B).因此,GAPDH为5龄玉带凤蝶不同组织的最适内参基因.

图6 候选内参基因在玉带凤蝶不同组织中的相对表达水平分析
2.3 PpFerHCH和PpFerLCH基因的组织表达谱
为了确定PpFerHCH和PpFerLCH基因在玉带凤蝶5龄第1天不同组织中的表达模式,利用荧光定量PCR对其在不同组织中的相对表达水平进行检测,结果如图7所示,PpFerHCH和PpFerLCH主要在玉带凤蝶的中肠和马氏管中高表达,而在头部和血淋巴的相对表达水平较低.
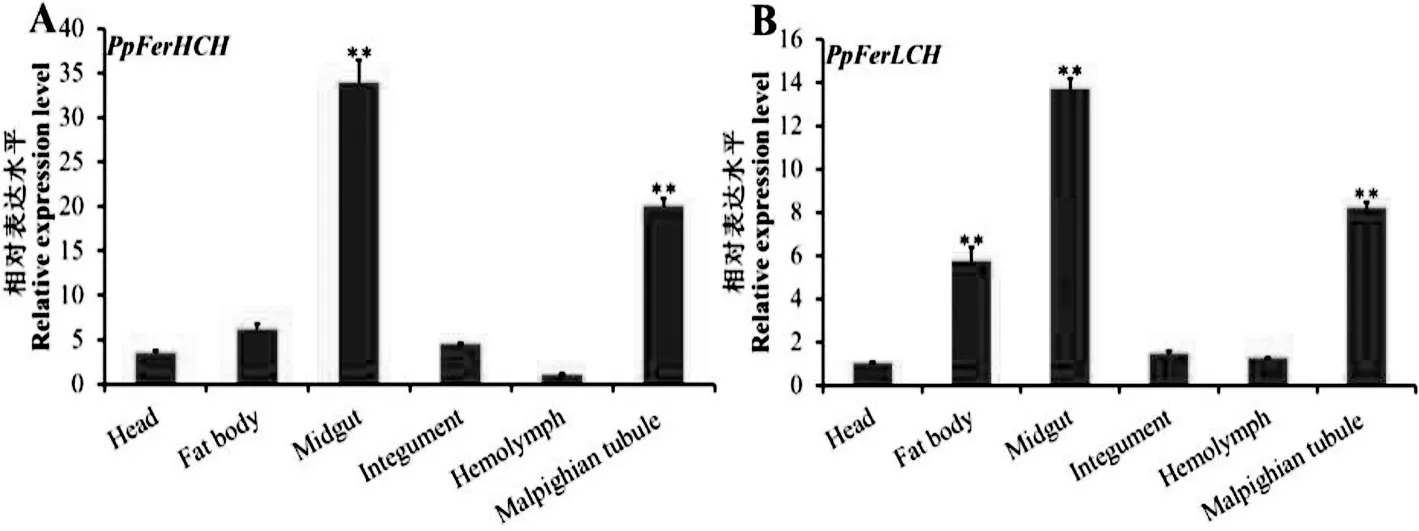
图7 PpFerHCH和PpFerLCH基因在玉带凤蝶不同组织中的相对表达水平分析
2.4 PpFerHCH和PpFerLCH应答铁离子刺激的表达水平分析
为了研究铁过量刺激对玉带凤蝶铁蛋白表达水平的影响,对5龄第1天的玉带凤蝶添食10% FeCl3,24 h后提取中肠组织RNA并反转录成cDNA,使用RT-qPCR分析PpFerHCH和PpFerLCH的表达水平.结果如图8所示,添食FeCl324 h以后,与对照组相比,PpFerHCH和PpFerLCH的表达水平显著上调.

图8 10% FeCl3刺激后PpFerHCH和PpFerLCH在中肠中的相对表达水平分析
3 讨论
铁是生命活动中的必须营养物质,铁蛋白是一种普遍存在的铁结合蛋白,在铁的储存和运输过程中扮演着重要角色.脊椎动物铁蛋白由24个亚基构成的分子量约为440 kDa的异源多聚体,亚基的组成包括重链和轻链两类,分别由不同基因编码.在昆虫中,铁蛋白也是由2种类型的亚基构成,但是多聚体的分子量普遍比哺乳动物大[2].Dunkov等人揭示烟草天蛾的天然铁蛋白的分子量超过669 kDa[18].在我们之前的研究中,通过蛋白质电泳和质谱技术分离了家蚕铁蛋白,揭示分子量约为670 kDa[17].在本研究中,通过进化树发现玉带凤蝶铁蛋白重链亚基和轻链亚基都与烟草天蛾保持较高的同源性.因此,我们推测玉带凤蝶的天然铁蛋白的分子量大约为669 kDa.在哺乳动物中,细胞外的铁离子主要通过转铁蛋白运输,细胞内的铁离子通过铁蛋白储存.与哺乳动物不同的是,昆虫铁蛋白大部分都属于分泌性蛋白.在刺舌蝇(Glossinamorsitans)中,GmmFer1HCH和GmmFer2HCH都含有一个假定的信号肽[19].在熊蜂(Bombusignitus)中,BiFerHCH也包含一个假定的信号肽[20].我们发现玉带凤蝶铁蛋白轻链亚基和重链亚基都含有一个假定的信号肽,进一步揭示玉带凤蝶铁蛋白是一个分泌型蛋白.此外,PpFerHCH基因的5’UTR包含一个铁反应元件(IRE),该元件可以形成茎环结构,是铁调节蛋白的结合位点,在调控铁吸收与释放代谢过程中起着重要作用.铁反应原件是受到铁调节蛋白(IRP)的调节.当细胞铁缺乏时,IRP和IRE结合,阻止铁蛋白表达,从而减少过载铁,减少活性氧(ROS)的产生[21-22].
荧光定量PCR技术已经普遍用于基因表达的分析,而内参基因的选择显著影响着实验结果的准确性.任何一种内参基因的所谓恒定表达都只是在一定类型的细胞或实验因素作用下的恒定,所以在选择合适的内参基因将有效消除不同样本在RNA的质量、产量以及反转录效率方面的差异[23].目前,对于玉带凤蝶,内参基因的选择还没报道,只有先确定合适的内参基因,才能进一步确定目的基因在特定实验条件下的表达.在以前的报道中,Teng等人对鳞翅目昆虫内参基因的选择进行了研究,结果显示,核糖体蛋白49(RP49)和三磷酸甘油醛脱氢酶(GAPDH)在家蚕和甜菜夜蛾的不同发育时期比较稳定;GAPDH、RP49和E2F在家蚕、甜菜夜蛾和二化螟的不同组织中表达量比较稳定[24].在本研究中,半定量PCR和荧光定量PCR分析显示RP60在玉带凤蝶不同的组织中的表达量相对稳定.因此,RP60可以作为玉带凤蝶的内参基因.
通过RT-qPCR分析显示,PpFerHCH和PpFerLCH基因主要在玉带凤蝶的中肠和马氏管中高表达,其次是脂肪体.昆虫中肠作为分泌消化酶和其他酶类的主要部位,起着消化食物和吸收养分的重要作用,同时也是病原微生物和各种毒素的作用靶标,因此,中肠在昆虫的免疫过程中起着重要作用[25].玉带凤蝶铁蛋白的2个亚基在中肠中高表达,也就暗示PpFerHCH和PpFerLCH在玉带凤蝶的免疫过程中起着关键作用.在东方果实蝇中,BdFer1HCH和BdFer2LCH也在中肠中高表达[9].有意思的是,我们也发现PpFerHCH和PpFerLCH在玉带凤蝶的马氏管中具有较高的表达水平.昆虫的马氏管作为重要的排泄器官,维持机体内的渗透压、水份和无机盐的平衡.研究发现在果蝇的马氏管体内大量表达了细胞色素P450、谷胱甘肽-S-转移酶和乙醇脱氢酶等酶类,暗示了果蝇马氏管在异源物质的代谢和解毒方面起了关键作用[26].Shireen-Anne等人研究发现在果蝇马氏管内存在一些抗菌肽的表达,主要包括Dipericin、Metchnikowin和Cecropin[27].这些研究结果表明马氏管在昆虫的免疫防御过程中起着关键作用.因此,我们推测PpFerHCH和PpFerLCH在玉带凤蝶的马氏管中可能参与先天性免疫反应.与哺乳动物相比,大部分昆虫铁蛋白属于分泌性蛋白,由脂肪体合成分泌到血淋巴中,再通过血淋巴循坏运送到机体的各个组织中发挥功能[28-29].PpFerHCH和PpFerLCH在玉带凤蝶脂肪体中也具有较高的表达水平,可能于铁蛋白的合成有关,具体的机制还需要进一步研究.
之前的研究已经表明铁蛋白能够有效地调节体内铁代谢的平衡.在本研究中,10% FeCl3刺激24 h后,中肠中PpFerHCH和PpFerLCH的相对表达量显著上升.因铁蛋白是一种急性时相反应蛋白,它受到外界高浓度的3价铁Fe3+,在短时间内大量合成铁蛋白来抵抗应激,防止铁过量对玉带凤蝶幼虫造成氧化损伤.在桔小实蝇的人工饲料中添加1.8 mg/g FeCl3后,BdFer1HCH和BdFer2LCH的表达量显著上调[9].铁调控蛋白(IRP)能够与铁蛋白重链亚基5’UTR的铁反应原件(IRE)相互作用,控制铁蛋白的翻译.因此,当细胞内铁浓度过高时,IRP2迅速退化,不再与IRE结合,同时转铁蛋白受体减少.当细胞内铁浓度较低时,IRP与IRE结合,抑制铁蛋白翻译和提高转铁蛋白受体的合成[30-31].这些结果进一步表明PpFerHCH和PpFerLCH在调控机体内铁离子的平衡过程中起着重要作用.
本研究以凤蝶科的玉带凤蝶为材料,基于基因组数据库,鉴定了铁蛋白重链亚基PpFerHCH和轻链亚基基因PpFerLCH,并且克隆出2个基因的开放阅读框.采用荧光定量PCR分析PpFerHCH和PpFerLCH的组织表达模式和相应铁离子刺激后的表达水平,以阐明玉带凤蝶铁蛋白基因的表达调控机制,为进一步明确玉带凤蝶铁蛋白的功能奠定基础.

