不同类型减重代谢手术治疗重度肥胖合并2型糖尿病的近期疗效分析
罗衡桂,唐彬,毛岳峰,陈伟,张晓玲,李绍杰,姜学润,陈香林,郭进,王力,张全安,林慧,夏佩,张水湘
(湖南省湘潭市中心医院 1.减重代谢外科中心 2.麻醉科 3.手术室,湖南 湘潭 411100)
由于生活方式及饮食结构的改变,肥胖及糖尿病已经成为现今社会所面临的最严重的公共健康问题之一。在一些欧美发达国家肥胖症的发病率超过30%,我国由于人口基数大,目前肥胖及糖尿病患总数位居全球之首[1-2],占全球肥胖患者总数的16.3%[3],成人超重合并2型糖尿病(T2DM)的患病率高达33.7%[4]。肥胖合并的代谢性疾病如糖尿病、高脂血症、高尿酸血症、高血压、糖尿病、高血压、睡眠呼吸暂停综合征、多囊卵巢综合征等严重降低了肥胖患者的生活质量,威胁人类健康。2015年相关研究显示,全球大约 400万人的死因与肥胖直接相关,占全部死亡人数的7.1%[5]。
通过饮食和生活方式改变等保守方式仅能降低体质量的1%,而且长期效果不佳[6]。传统的糖尿病治疗需要终生治疗、定期随访,导致糖尿病总体控制较差。目前,我国仅有25.8%的成人糖尿病患者接受规范治疗,而血糖的良好控制率仅为39.7%[7]。多项研究表明减重代谢手术对肥胖合并的T2DM的患者具有显著、持久的治疗效果[8]。
减重代谢手术是肥胖合并T2DM唯一长期有效的治疗方式[9],减重代谢手术始于20世纪中叶,经过70余年的不断发展,目前被普遍接受的主流术式为:腹腔镜袖状胃切除术(laparoscopic sleeve gastrectomy,LSG)、腹腔镜胃旁路术(laparoscopic Roux-en-Y gastric bypass,LRYGB)。
不同的代谢手术在治疗肥胖症和控制血糖等方面效果不同,手术技术标准和并发症也有所不同。LRYGB自1994年以来,一直作为减重代谢手术的金标准,但存在远期营养不良、贫血及旷置胃体后成为胃镜检查的盲区等缺点,近几年全球范围实施LRYGB所占比例有所下降,从2003年的65%降至2013年的45%[10]。LSG起始于2008年始逐渐开始作为一种独立的术式,因其相对技术简单、并发症发生少、远期营养风险低,同时短期内能达到与LRYGB相近的疗效等特点,近几年来已成为主流术式之一,目前占总比例的49%[10]。但LSG的术后远期总体减重与降血糖效果不如LRYGB,面临术后复胖及加重胃食管反流等不足,如何提高LSG的效果,一直是大家探索和感兴趣的问题,目前主要的探索性术式集中在以LSG为基础的附加手术[3],例如,LSG加空肠旷置术(LSG plus jejuno-jejunal bypass,LSG+JJB)、LSG加十二指肠和空肠旁路术(LSG plus duodeno-jejunal bypass,SG+DJB)[11]、LSG加空回肠侧侧吻合术(sleeve gastrectomy plus jejunal-ileo bypass,LSG+JI)[12]等。LSG附加手术由于具有操作简单、效果确切的同时兼备胃镜检查,将来可能成为减重代谢的主流术式[6]。
我科自2016年2月以来开展了LSG+JJB手术治疗重度肥胖患者,手术顺利,效果良好,无明显并发症。现将其与同期开展的LSG、LRYGB治疗重度肥胖合并T2DM的患者在术后6、12个月的疗效进行分析比较,以明确3种减重代谢手术在治疗重度肥胖合并T2DM的疗效以及三者在减重、降糖、降脂、降血尿酸等方面不同的特点,以期为临床治疗提供参考。
1 资料与方法
1.1 一般资料
回顾分析2016年2月—2019年9月在湘潭市中心医院减重代谢外科中心接受减重代谢手术治疗重度肥胖合并T2DM患者的临床资料。按照 “2018年版糖尿病医学诊疗标准”[7]及“中国肥胖及2型糖尿病外科治疗指南(2019版)”要求[3],符合以下标准视为有代谢手术指征并纳入研究组:⑴ 连续5年以上体质量稳定或稳定增加且BMI≥32.5 kg/m2。⑵ 合并T2DM,非手术治疗的疗效不佳或不能耐受,预测手术能获益,且病程<15年。⑶年龄16~65岁。排除标准为:⑴ 明确诊断为非肥胖型1型糖尿病。⑵ 以治疗T2DM为目的的患者胰岛B细胞功能已基本丧失。⑶ 妊娠糖尿病及某些特殊类型糖尿病患者。⑷ 滥用药物或酒精成瘾或患有难以控制的精神疾病。⑸ 智力障碍或智力不成熟,行为不能自控者。⑹ 全身状况差,难以耐受全身麻醉或手术者。
其中筛选出符合标准的患者总共63例患者,其中女38例,男25例;年龄18~55岁;BMI均>32.5 kg/m2,平均BMI为(44.36±8.22)kg/m2。所有入组患者均按照标准诊断为T2DM,其中35例口服降血糖药物控制血糖,28例通过胰岛素控制血糖。14例术前合并高血压病,其中11例口服降血压药物,术前血压控制可。12例女性患者合并多囊卵巢综合征。34例合并睡眠呼吸暂停综合征。所有患者术前接受内分泌科、呼吸科,心血管内科等多学科MDT会诊,完善相关检查并评估手术风险及获益。术前均签署由医院伦理委员会批准的《患者手术知情同意书》,符合医学伦理学规定。
1.2 研究分组
根据手术方式的不同分为LSG组、SLG+JJB组、LRYGB组,其中LSG组25例,SLG+JJB组18例,LRYGB组20例。分别记录三组患者年龄、体质量、腰围、臀围、BMI、空腹血糖(fasting plasma glucose,FPG)、空腹C肽、空腹胰岛素、糖化血红蛋白(glycosylated hemoglobin,HbA1c)、胆固醇、甘油三酯、高密度脂蛋白、低密度脂蛋白、血尿酸等情况。
1.3 术前准备及手术方式
1.3.1 术前准备所有患者除常规检查及多学科讨论评估(MDT)外,完善胃镜、呼吸睡眠监测,控制术前血压及血糖,对于合并睡眠呼吸暂停综合征的患者,术前经睡眠呼吸监测确诊后,监测血气变化,对于低氧血症的患者围手术期间给予吸氧或无创呼吸机正压辅助通气,改善低氧血症,常规呼吸功能锻炼及使用低分子肝素预防深静脉血栓形成。
1.3.2 手术方式63例患者均在全麻下接受腹腔镜减重代谢手术,其中25例行LSG、18例行LSG+JJB、20例行LRYGB。术中残余胃容量均由36-F Bougie 减重胃管经口插入标识。术式要点、技术指标均符合2019版《中国肥胖及2型糖尿病外科治疗指南(2019版)》要求[3]。LSG 手术技术要点:⑴ 距幽门4 cm 用Ligasure 沿胃大弯侧游离切断胃网膜左动静脉、胃短动静脉,逐步游离胃结肠韧带及胃脾韧带至食管左侧,暴露His 角;⑵ 大弯侧距幽门4 cm 处作为胃袖状切除起点,紧靠36-F Bougie 减重胃管逐步向上切割闭合;⑶ 切除胃大弯及胃底直至His 角旁1.5~2 cm;⑷ 3-0 倒刺线全层加固胃壁切口;⑸ 术中发现食管裂孔疝一期修补处理。LSG+JJB 手术技术要点:⑴ 在袖状胃切除基础上,距屈式韧带下20 cm 用切割闭合器切割闭合空肠;⑵ 空肠远断端往下测量200 cm,使用切割吻合器与近端空肠侧侧吻合;⑶ 3-0 倒刺线全层关闭肠肠吻合残口,3-0 可吸收线关闭肠系膜裂孔。LRYBG 手术技术要点:⑴ 从小弯侧胃左血管第一支下缘开始,游离切割胃壁,隔绝全部胃底,建立容积为2~30 mL的胃小囊;⑵ 距屈氏韧带约100 cm 处空肠与胃小囊以切割闭合器行侧侧吻合,吻合口直径约为1.5~2 cm;⑶ 用3-0 倒刺线双层关闭胃肠吻合残口;⑷ 在胃肠吻合口近端约5 cm 以切割闭合器离断空肠;⑸ 距胃肠吻合口远端约100 cm 行胆胰支、胃肠支侧侧吻合,胃肠支、胆胰支消化道长度均为100 cm;⑹ 3-0 倒刺线关闭肠肠吻合残口;⑺ 用3-0 可吸收线关闭Peterson 孔及小肠系膜裂孔。
1.4 术后随访
所有减重患者在麻醉复苏后6 h 鼓励下床活动,术后第2天逐步开始饮水,48 h内完善上消化道造影观察是否有胃切缘或吻合口漏。术后长期补充蛋白质、叶酸、复合维生素、微量元素等,尽量减少碳水化合物的摄入。推荐从术后恢复期即开始逐渐进行日常运动锻炼。所有患者术后定期随访由减重代谢外科医师及个案管理师统一管理,采用门诊、电话或网络通信等方式进行随诊。
1.5 研究指标
围手术期相关指标:比较3组手术时间、术中出血量、术后住院时间及并发症发生情况。体质量下降相关指标:术后第6、12个月体质量、腰围、臀围、BMI及多余体质量减少百分比(the percentage of excess weight loss,%EWL)。糖代谢相关指标:术后第6、12个月空腹血糖(FPG)、糖化血红蛋白(HbA1c)、空腹胰岛素(FINS)、胰岛素抵抗指数(HOMA-IR)[胰岛素抵抗指数=空腹血糖(mmol/L)×空腹胰岛素(mIU/L)/22.5]。脂代谢相关指标:术后第6、12个月血胆固醇、血甘油三酯、高密度脂蛋白、低密度脂蛋白、血尿酸浓度。
1.6 糖尿病疗效判定
糖尿病缓解率参照ADA标准[8]。⑴ 完全缓解:术后停止药物治疗1年,FBG<5.6 mmol/L,HbAlc≤6%;⑵部分缓解:术后停止药物治疗1年,FBG 5.6~6.9 mmol/L,HbAlc≤6.5%;⑶ 改善:术后1年内HbAlc下降程度>1%或FBG下降程度>25 mg/dL;⑷ 无效:术后FBG或HbAlc未出现缓解或改善。
1.7 统计学处理
使用SPSS 23.0统计软件进行统计分析。计量资料用均数±标准差(±s)表示,计数资料用例数(百分比)[n(%)]表示。计量资料中手术前后资料比较采用配对t检验,组间资料比较采用重复测量的方差分析,多重比较采用LSD-t检验。计数资料比较采用χ2检验,不满足χ2检验条件者用Fisher精确概率计算。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料比较
术前三组患者的一般资料比较,差异均无统计学意义(均P>0.05),具有可比性(表1)。
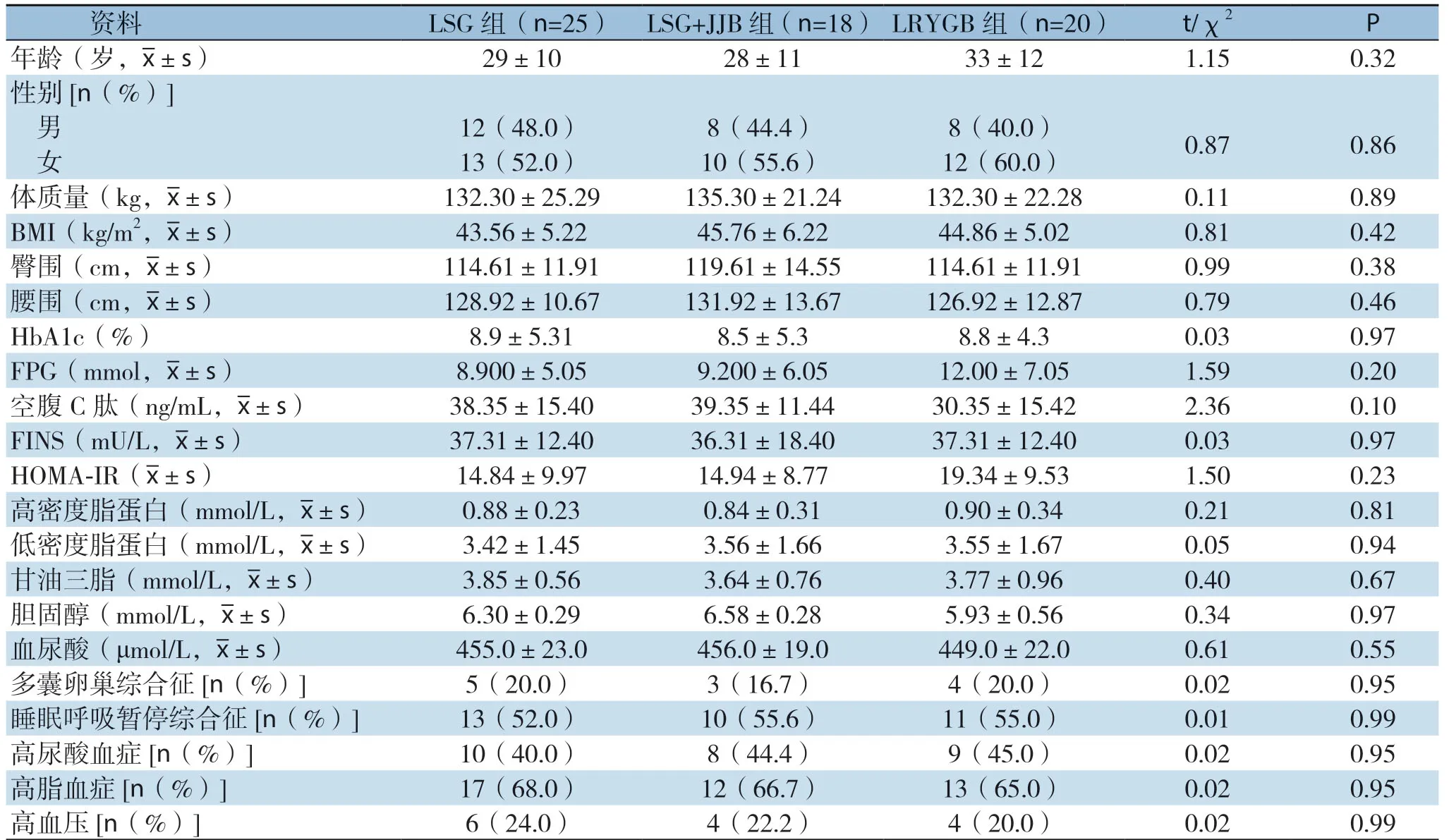
表1 术前三组患者一般情况比较Table1 The preoperative general data of the three groups of patients
2.2 手术情况
63例患者均成功完成腹腔镜手术,无中转开腹或死亡病例,具体情况见表2。手术时间:LSG组(83.50±1 5.29)min、LSG+JJB组(115.30±20.28)min、LRYGB组(152.30±25.29)min,三组间差异有统计学差异(P<0.01)。术中出血量及术后住院时间3组差异无统计学意义(均P>0.05)。LRYGB组中1例术后出现吻合口微漏,保守治疗15 d后痊愈,1例术后出血,经保守治疗后好转;LSG+JJB术后出血1例,经再次腹腔镜探查止血后治愈。余患者均顺利出院,均无吻合口狭窄、肺部感染、深静脉血栓等并发症。
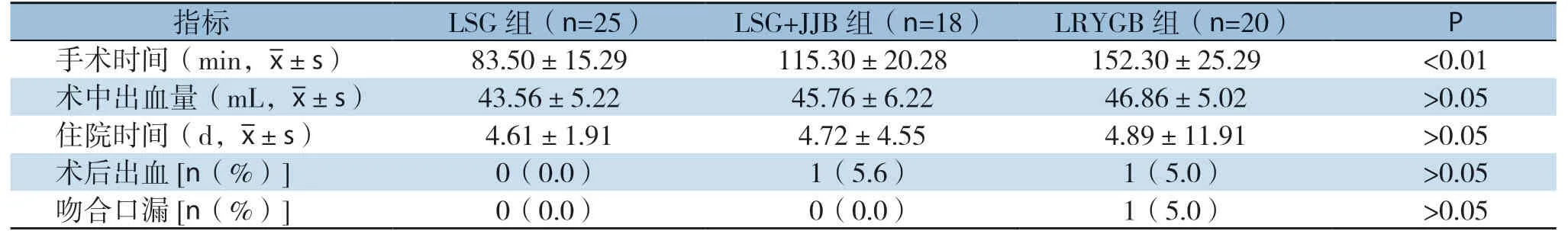
表2 三组患者手术相关指标Table2 Surgery-related variables of the three groups of patients
2.3 减重情况
三组患者术后6、12个月体质量、腰围、BMI与术前比较差异均有统计学意义(均P<0.01)。LSG组、LSG+JJB组、LRYGB组术后6个月平均%EWL分别为56.27%、68.72%和70.98%,术后12个月分别为68.17%、82.89%和84.98%,术后12个月的%EWL、体质量、腰围、BMI均较术后6个月有明显改善(均P<0.05)。术后臀围与术前比较有统计学差异(P<0.05),但术后12个月与术后6个月之间以及同期三组间的臀围差异均无统计学意义(P>0.05)。术后体质量、腰围、BMI、%EWL同期组间比较,LSG+JJB组及LRYGB组效果均优于LSG组(均P<0.05),LSG+JJB组及 LRYGB组之间差异无统计学意义(P>0.05)(表3)。
表3 三组患者术后减重指标的变化(±s)Table3 Changes in weight loss indexes of the three groups of patients after surgery (±s)
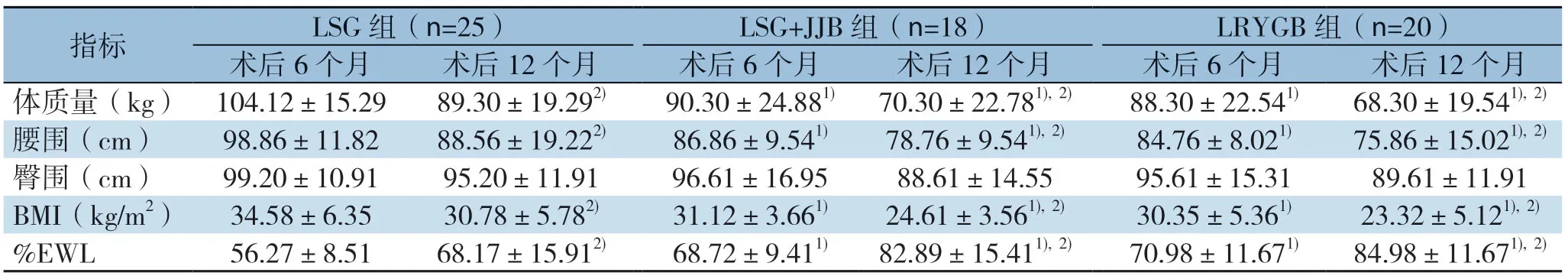
表3 三组患者术后减重指标的变化(±s)Table3 Changes in weight loss indexes of the three groups of patients after surgery (±s)
注:1)与同时期LSG 组数据比较,P<0.05;2)与同组术后6个月数据比较,P<0.05Note:1) P<0.05 vs.the data of LSG group in same time period;2) P<0.05 vs.the data of the same group in the postoperative 6 months
指标 LSG 组(n=25)LSG+JJB 组(n=18)LRYGB 组(n=20)术后6个月 术后12个月 术后6个月 术后12个月 术后6个月 术后12个月体质量(kg)104.12±15.29 89.30±19.292) 90.30±24.881) 70.30±22.781),2) 88.30±22.541) 68.30±19.541),2)腰围(cm)98.86±11.82 88.56±19.222) 86.86±9.541) 78.76±9.541),2) 84.76±8.021) 75.86±15.021),2)臀围(cm)99.20±10.91 95.20±11.91 96.61±16.95 88.61±14.55 95.61±15.31 89.61±11.91 BMI(kg/m2)34.58±6.35 30.78±5.782) 31.12±3.661) 24.61±3.561),2) 30.35±5.361) 23.32±5.121),2)%EWL 56.27±8.51 68.17±15.912) 68.72±9.411) 82.89±15.411),2) 70.98±11.671) 84.98±11.671),2)
2.4 糖代谢指标变化
三组术后6、12个月FPG、HbA1c、FINS及HOMA-IR较术前均明显下降(均P<0.05),但每组各项指标在各自的两个时间点以及各组的相同时间点差异均无统计学意义(均P>0.05)(表4)。LSG、LSG+JJB、RYGB组术后6个月糖尿病缓解率分别达84%、83.3%、85.0%,12个月分别达到88%、88.9%、90.0%,三组间差异无统计学意义(均P>0.05)(表5)。
表4 三组患者术后糖代谢相关指标的变化(±s)Table4 Changes in related indexes of glucose metabolism of the three groups of patients after surgery (±s)

表4 三组患者术后糖代谢相关指标的变化(±s)Table4 Changes in related indexes of glucose metabolism of the three groups of patients after surgery (±s)
指标 LSG 组(n=25)LSG+JJB 组(n=18)LRYGB 组(n=20)术后6个月 术后12个月 术后6个月 术后12个月 术后6个月 术后12个月FPG(mmol)5.32±2.05 5.90±2.05 5.59±1.86 5.00±0.56 4.90±2.37 5.01±1.39 HbA1c(%)6.21±1.38 5.89±0.38 5.14±1.55 5.65±0.55 4.88±1.31 5.67±0.32 FINS(mU/L) 8.59±3.99 8.72±0.60 7.31±1.56 6.11±1.96 6.39±2.68 6.18±11.68 HOMA-IR 2.36±0.68 2.26±0.78 2.19±2.56 1.36±0.56 2.04±1.22 1.34±1.12
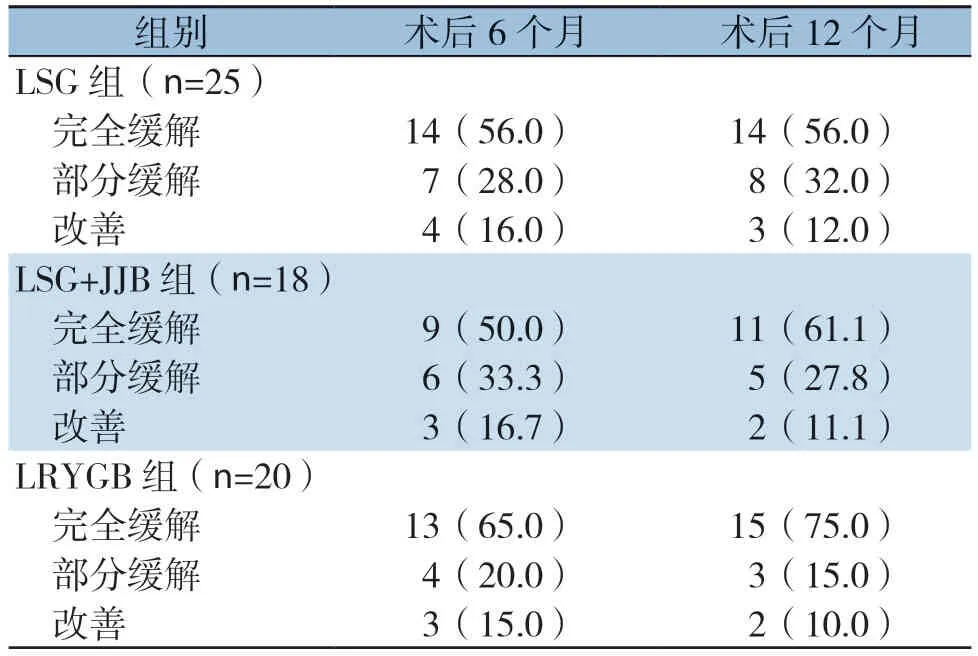
表5 三组患者术后糖尿病缓解率[n(%)]Table5 Diabetes remission rate of the three groups of patients after surgery [n (%)]
2.5 脂代谢指标的变化
三组患者在术后6、12个月的血胆固醇、甘油三脂、低密度脂蛋白、高密度脂蛋白、尿酸均较术前明显改善(均P<0.05)。三组间甘油三脂、高密度脂蛋白、低密度脂蛋白改善效果差异均无统计学意义(均P>0.05);LRYGB组与LSG+JJB组6、12个月血尿酸及胆固醇降低程度优于LSG组(均P<0.05),且三组的尿酸水平均为术后12个月明显优于术后6个月(均P<0.05)(表6)。
表6 三组患者术后脂质代谢相关指标的变化(±s)Table6 Changes of the indexes of lipid metabolism of the three groups of patients after surgery (±s)
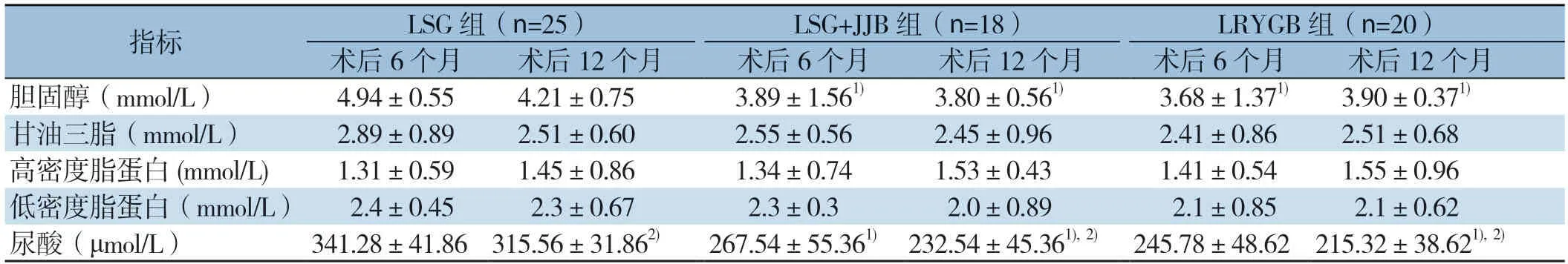
表6 三组患者术后脂质代谢相关指标的变化(±s)Table6 Changes of the indexes of lipid metabolism of the three groups of patients after surgery (±s)
注:1)与同时期LSG 组数据比较,P<0.05;2)与同组术后6个月数据比较,P<0.05Note:1) P<0.05 vs.the data of LSG group in same time period;2) P<0.05 vs.the data of the same group in the postoperative 6 months
指标 LSG 组(n=25)LSG+JJB 组(n=18)LRYGB 组(n=20)术后6个月 术后12个月 术后6个月 术后12个月 术后6个月 术后12个月胆固醇(mmol/L)4.94±0.55 4.21±0.75 3.89±1.561) 3.80±0.561) 3.68±1.371) 3.90±0.371)甘油三脂(mmol/L)2.89±0.89 2.51±0.60 2.55±0.56 2.45±0.96 2.41±0.86 2.51±0.68高密度脂蛋白(mmol/L) 1.31±0.59 1.45±0.86 1.34±0.74 1.53±0.43 1.41±0.54 1.55±0.96低密度脂蛋白(mmol/L)2.4±0.45 2.3±0.67 2.3±0.3 2.0±0.89 2.1±0.85 2.1±0.62尿酸(μmol/L)341.28±41.86 315.56±31.862) 267.54±55.361) 232.54±45.361),2) 245.78±48.62 215.32±38.621),2)
3 讨 论
减重代谢手术根据其机制可分为3类:限制型手术、吸收不良型手术、限制结合吸收不良型手术[13]。目前减重代谢手术的机制研究认为:减重代谢手术不单只是限制了食物的摄入和吸收限制,胃肠道激素的改变发挥了很重要的作用。多种机制参与的代谢手术比单一机制参与的代谢手术具有更好的手术效果[12]。
LRYGB由于具有显著的减重及改善糖脂代谢作用,已成为重度肥胖合并T2DM治疗的“金标准”,其机制是胃小囊限制摄食,同时根据“后肠学说”[14-15],由于旷置了大部分的胃及近端小肠,食糜可以较快接触远端小肠,刺激后肠L细胞分泌胰高血糖素样肽1(GLP-1)和酪酪肽(PYY),从而促进糖原合成和胰岛素分泌,促进胰岛B细胞增殖抑制其凋亡,提高胰岛素的敏感性。相关研究[16]显示LRYGB术后1年%EWL为61.2%~94.4%,糖尿病缓解率为42%~93%。本组LRYGB术后1年的%EWL为(84.98±11.67)%,糖尿病缓解率为90%。但LRYGB也存在一些问题,如术后长期营养吸收不良导致的贫血、代谢骨病综合征和低蛋白血症以及被转流的胃体成为胃镜检查的盲区,对于有胃癌前期病变或者有胃癌家族史的患者不适合。有研究[17]显示截止2014年共17篇文献报道了代谢术后共18例发生胃癌,其中7例为RYGB术后;LSG作为减重及改善糖脂代谢主流术式之一,其手术机制是通过切除胃底和部分胃体,产生限制摄食作用,食欲被抑制,同时饥饿素分泌减少,胰岛素的抑制作用被解除,胰岛素敏感性得以恢复[18-19],从而产生减重及改善糖脂代谢作用。LSG术后1年随访%EWL达到49%~81%,糖尿病缓解率到达26%~75%[16]。本组LSG术后1年的%EWL为(68.17±15.91)%,糖尿病缓解率为88%。LSG操作简单,但远期可能因胃容积扩大而导致复胖及血糖控制不佳,需行修正手术。据报道LSG术后2年复胖率为5.7%,而6年复胖率高达75.6%[20]。Yeung等[21]的Meta分析结果显示,LSG与胃食管反流的发生密切相关,术后患者发生胃食管反流的比例达到了19%。
不同术式的疗效评估,合理术式的选择与新术式的改良是目前代谢减重手术探讨的主要内容。LSG操作相对简单,术后长期营养并发症较少,费用相对较低,但远期的减重效果与降血糖效果不如RYGB[22],并可能加重胃食管反流症状。RYGB目前被认为是同时具有限制及吸收不良型的手术,一直作为代谢减重外科“金标准”手术,尤其对T2DM的治疗能达到手术风险与获益最佳平衡的目的。但其操作相对复杂,近期及远期并发症高,全球范围近几年实施RYBG术所占比例有所下降,从2003年的65%降至2013年的45%。如何在这两种术式之间寻求一种更为有效的办法值进一步探索,诸多学者致力于在胃袖状切除术的基础上叠加其他手术,以期兼顾多种手术的获益。例如:2001年Rutledge[23]报道了迷你胃旁路术(mini-gastric bypass,MGB),2009年Kasama等[24]报道LSG+Roux-en-Y吻合空回肠转流术(LSGDJB),2014年,Lee等[25]报道LSG+袢式吻合空回肠转流术(SADJB-SG);2015年周程等[26]报道了LSG联合十二指肠回肠Ω转位术(LSG-DIOS),2016年马颖璋等[12]尝试的在LSG基础上加空回肠侧侧吻合术(JI-LSG)等。
LSG+JJB作为LSG附加手术的一种,目前主要在智利开展,中国也相继在江苏南京市、广东中山市、台湾、北京等多地区开展[6,27]。LSG+JJB在LSG基础上旷置一段的小肠,理论上兼顾了吸收不良及限制摄入的原理,兼具了LSG及LRYGB两种术式的优点,既有前肠学说理论上的改变(LSG术后导致各种肠道激素的改变,抑胃肽GIP的减少)又有后肠学说的改变(食物快速到达回肠末端导致GLP-1、PYY产生,抑制食欲),理论上产生与LRYGB相近的降糖及降血脂效果,同时避免了LRYGB术后不能通过胃镜检查远端残胃的弊端。
Alamo等[28]研究表明,LSG+JJB对于BMI<35的T2DM,完全缓解率达到81.6%,术后1年%EWL为81.65%,未见明显并发症。Sepúlveda等[29]将SG-JJB与LRYGB进行对比,术后1、3年的糖尿病完全缓解率相似,分别为(69.2% vs.64.7%)和(56.1% vs.58.8%),术后1年LRYGB组血细胞比容、血钙较SG-JJB组显著降低。赵象文等[27]研究报告10例LSG+JJB术后1、3个月减重效果优于LSG及LRYGB。本研究结果显示SG+JJB术后1年%EWL为(82.89±15.41)%,糖尿病缓解率为88.9%,与LSG及LRYGB一样具有良好的减重及改善糖脂代谢和尿酸代谢作用,短期效果显著。在减重、降尿酸及降胆固醇方面,LSG+JJB与LRYGB效果相当并优于LSG。手术时间LSG+JJB明显低于LRYGB。
本组数据显示术后3组臀围的改变没有其他减重指标改变显著,并且3组间差异均无统计学意义,可能与亚洲人大部分是腹型肥胖有关,故臀围变化不明显。本研究结果显示虽然3组胆固醇均显著改善,但LSG+JJB及LRYGB相比LSG降胆固醇效果更明显,其可能机制是部分近端小肠的旷置减少了胆汁酸的吸收以及改变受核蛋白如LXR、FXR和PPAR调控的反馈机制,导致胆固醇水平下降[30-31],因此与单纯的限制型手术相比,吸收不良型手术能更有效的降低胆固醇水平[32]。本研究结果还显示,LSG-JJB与LRYGB一样比LSG更明显的降血尿酸效果,分析原因可能与近端小肠旷置,导致肠道结构及生理的改变,产生更明显的肠道菌群改变,从而导致黄嘌呤氧化酶活性的降低和机体炎症反应状态改善而改变血尿酸的代谢状态有关[25,33-35]。
LSG+JJB操作简单,只有一个吻合口,具有良好疗效的同时又兼具了胃镜检查,这对有胃癌前期病变及胃癌家族史者尤其重要。因此可作为减重代谢手术的一种良好的术式选择,尤其在以下情况我们倾向于选择LSG+JJB:⑴ BMI≥40 kg/m2的超级肥胖患者;⑵ 有胃癌前期病变及胃癌家族史者;⑶ LSG术后复胖患者。我院对1例3年前LSG术后复胖的患者行LSG+JJB治疗,术后6个月,体质量下降40 kg,术后代谢综合征基本得到缓解,效果良好。
由于本研究术后随访时间较短,观察例数有限,系单中心研究,具有一定的局限性,随着多中心样本量的扩大,随访时间的延长,LSG+JJB与LSG及LRYGB远期疗效的比较及并发症进一步观察,LSG+JJB与LSG+DJB、LSG+JI等袖状胃加术式的横向研究比较,以及更多更有说服力证据的出现,LSG+JJB的手术价值将进一步明确。为肥胖及T2DM外科治疗提供一种合理的手术选择。

