麦冬皂苷B通过调控Notch1信号通路增加前列腺癌细胞的放疗敏感性
李挺云 梁培育 王声兴 周治彦 陈金火
(海南医学院第一附属医院泌尿外科,海南 海口 570102)
前列腺癌(PC)是男性中发病率较高的恶性肿瘤之一,研究显示我国PC发病率及致死率呈逐年增加的趋势〔1〕。PC具有强侵袭性且严重威胁男性生命安全,目前放疗是治疗PC的有效手段,可提高患者生存质量并改善患者预后,由于PC细胞及个体差异等因素导致不同前列腺癌患者对射线的反应不同进而导致治疗效果不佳〔2〕。因而放射治疗PC患者过程中提高放疗敏感性对提高治疗效果及改善患者预后均具有重要意义。有研究表明麦冬皂苷(OP)D作为麦冬提取物可通过蛋白激酶-1/混合系激酶域样蛋白(RIP1/MLKL)信号通路进而抑制PC细胞增殖,具有较强的抗肿瘤作用〔3〕;还有研究显示OP可抑制非小细胞肺癌细胞增殖以及调控细胞周期相关蛋白等作用〔4,5〕。OP-D、OP-B均是从麦冬中分离出的单体,但是目前关于麦冬提取物OP-B是否可抑制PC细胞增殖尚不明确。因此本研究主要探讨OP-B对前列腺癌细胞放疗敏感性的影响,并分析其是否通过抑制Notch1信号通路发挥作用。
1 材料与方法
1.1实验细胞 PC-3细胞(货号:BNCC100267)购自美国ATCC公司。
1.2方法
1.2.1主要试剂与仪器 OP-B(批号:20160908)购自南京普怡生物科技有限公司;DMEM培养基(批号:20160306)、胎牛血清(批号:20161109)均购自美国Gibco公司;胰酶(批号:20170907)购自北京中衫金桥生物技术有限公司;Notch1信号通路特异性阻断剂(DAPT,批号:20170321)购自深圳市浩博世纪生物有限公司;磷酸盐缓冲液(PBS,批号:20161207)购自北京全式金生物技术有限公司;四甲基偶唑氮盐(MTT,批号:20161003)、二甲基亚砜(DMSO,批号:20160908)均购自美国Sigma公司;乳酸脱氢酶(LDH)检测试剂盒(批号:20170803)购自上海信裕生物技术有限公司;膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)/碘化丙锭(PI)细胞凋亡检测试剂盒(批号:20160903)购自上海博谷生物科技有限公司;兔抗人Notch1(批号:20170305)、Hes1抗体(批号:20170403)购自北京义翘神州科技有限公司;兔抗人Bcl-2相关蛋白(Bax批号:20170201)、B细胞淋巴瘤(Bcl-2,批号:20170405)抗体均购自美国Abcam公司;兔抗人裂解的半胱氨酸天冬氨酸蛋白酶(cleaved Caspase-3,批号:20161105)、裂解的多聚ADP核糖聚合酶(cleaved PARP)抗体(批号:20170105)均购自美国Cell Signaling Technology公司;辣根过氧化物酶标记羊抗兔免疫球蛋白(Ig)G(批号:20170406)购自美国CST公司;蛋白裂解液(RIPA,批号:20170503)购自青岛捷世康生物科技有限公司;电化学发光(ECL)液(批号:20170613)购自北京欣经科生物技术有限公司;结晶紫染料(批号:20170728)购自上海碧云天生物技术有限公司。倒置显微镜购自日本奥林巴斯公司;F20型透射电镜购自美国FEI公司;DxFLEX型流式细胞仪购自美国贝克曼库尔特公司;Trans-Blot Turbo transfer system快速转膜系统购自美国伯乐公司;Smart View Pro2000型凝胶成像系统购自Major Science公司;Synergy2多功能酶标仪购自美国伯腾仪器有限公司;TEM-SN型透射电镜购自上海纳腾仪器有限公司。
1.2.2细胞培养、处理及分组 PC-3细胞放入10%胎牛血清的DMEM培养基中,置于培养箱(37℃ 5%CO2、95%湿度)内培养,待细胞融合度至80%~90%时进行传代培养。将PC-3细胞分为5组:空白对照组:X射线照射后不进行任何处理的PC-3细胞;阳性对照组:以DAPT处理PC-3细胞;低剂量组:PC-3细胞中加入2.5 μmol/L OP-B;中剂量组:PC-3细胞中加入5 μmol/L OP-B;高剂量组:PC-3细胞中加入10 μmol/L OP-B〔6〕。所有细胞采用X射线照射,放射剂量率为2.0 Gy/min,每组细胞平均分成5份,每份只经0、2、4、6、8 Gy其中一种辐射处理〔7〕,继续培养48 h后用于后续研究。
1.2.3MTT实验检测PC-3细胞增殖 放射处理后的各组细胞经胰酶消化,接种至96孔板(2.5×104个/孔),置于培养箱内继续培养48 h,采用MTT实验检测PC-3细胞增殖,分别加入5 g/L MTT(20 μl/孔),继续培养4 h,弃培养液,分别加入DMSO(150 μl/孔),放入摇床上振荡5 min,使用多功能酶标仪检测各孔在490 nm处的吸光度值,计算细胞增殖率=实验组/空白组×100%。
1.2.4检测LDH漏出率〔8〕收集各组PC-3细胞,接种于96孔板(2.5×104/孔),同时以DMEM培养基为细胞自然释放对照组,以0.8% Triton X-100为最大释放对照组,每组5个生物学重复,置于培养箱内继续培养48 h,其中最大释放孔需在培养结束前加入0.8% Triton X-100(时间45 min),分别向酶联免疫吸附试验(ELISA)板内加入100 μl上清,室温孵育10 min,分别加入LDH底物溶液(100 μl),避光孵育15 min,分别加入30 μl柠檬酸终止液(1 mol/L),采用多功能酶标仪检测各孔在490 nm处的吸光度值,LDH漏出率(%)=(实验组吸光度值-自然释放对照组吸光度值)/(最大释放对照组吸光度值-自然释放对照组吸光度值)×100%。
1.2.5流式细胞仪检测PC-3细胞凋亡 综合1.2.3实验结果选取PC-3细胞增殖率为50%左右的辐射剂量进行后续研究。收集各组PC-3细胞,胰酶消化后接种于6孔板,继续培养24 h后,5 Gy辐射处理细胞,继续培养72 h后弃培养基,磷酸盐缓冲液(PBS)清洗,胰酶〔不含乙二胺四乙酸(EDTA)〕消化,收集细胞,加入PBS制备细胞悬液,加入结合缓冲液(500 μl)重悬细胞,分别加入FITC标记的Annexin V(5 μl)、PI(5 μl),室温孵育15 min,置于流式细胞仪检测细胞凋亡并计算细胞凋亡率,细胞凋亡率(%)=凋亡细胞数目/细胞总数×100%。
1.2.6Western印迹法检测Notch1、Hes1、Bcl-2、Bax、cleaved caspase-3、cleaved PARP蛋白表达 收集各组PC-3细胞,胰酶消化,3 000 r/min转速离心5 min后收集细胞,加入RIPA重悬细胞,12 000 r/min转速离心10 min,参照BCA试剂盒说明书操作检测蛋白浓度与纯度,取30 μg蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE,10%)反应,结束后将蛋白转移至聚偏氟乙烯(PVDF)膜上,加入脱脂牛奶(5%)封闭室温孵育2 h,分别加入Notch1、Hes1、Bcl-2、Bax、cleaved caspase-3、cleaved PARP一抗,稀释比均为1∶500,置于4℃冰箱内保存过夜,次日加入稀释比为1∶5 000的二抗,ECL显影,各蛋白均以β-actin为内参基因,并采用Image J软件检测条带灰度值,蛋白相对表达量=目的蛋白积分吸光度值/β-actin积分吸光度值。
1.3统计学方法 采用SPSS22.0软件进行t检验、方差分析。
2 结 果
2.1OP-B对PC-3细胞增殖的影响 随着辐射剂量的增加PC-3细胞增殖逐渐降低,同一辐射条件下,与空白对照组相比,阳性对照组及OP-B中、高剂量组PC-3细胞增殖率显著降低(P<0.05);与低剂量组、中剂量组相比,高剂量组与阳性对照组均显著降低(P<0.05),高剂量组与阳性对照组相比无明显差异(P>0.05),见表1。
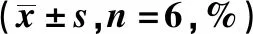
表1 OP-B对PC-3细胞增殖的影响
2.2OP-B对PC-3细胞LDH漏出率的影响 随着辐射剂量的增加PC-3细胞中LDH漏出率逐渐降低,同一条件下,与空白对照组相比,OP-B不同剂量组及阳性对照组PC-3细胞经不同剂量电离辐射后LDH漏出率显著降低(P<0.05),与低剂量组、中剂量组相比,高剂量组与阳性对照组均显著降低(P<0.05),见表2。
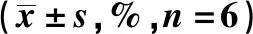
表2 OP-B对PC-3细胞 LDH 漏出率的影响
2.3OP-B对PC-3细胞凋亡的影响 由于照射剂量为5 Gy时PC-3细胞增殖率为50%左右,因此选用5 Gy照射剂量处理各组PC-3细胞进行后续实验研究。与空白对照组〔(16.13±2.15)%〕相比,低、中、高剂量组及阳性对照组PC-3细胞凋亡率显著升高〔(41.51±2.37)%、(43.45±3.16)%、(79.75±2.24)%、(80.28±1.32)%,P<0.05〕,与低剂量组、中剂量组相比,高剂量组与阳性对照组PC-3细胞凋亡率均显著升高(P<0.05),见图1。
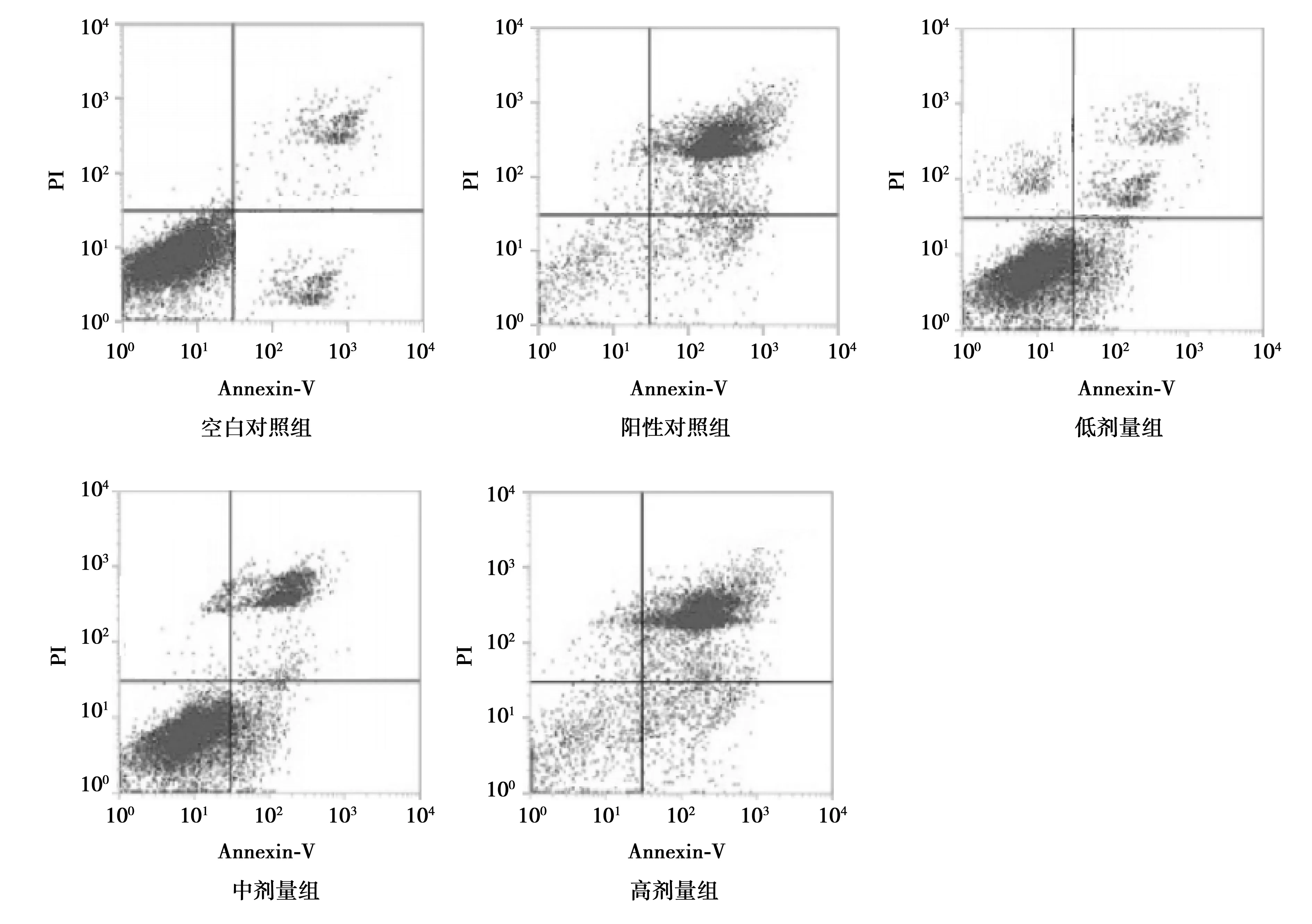
图1 OP-B对PC-3细胞凋亡的影响
2.4各组PC-3细胞Notch1、Hes1蛋白表达比较 与空白对照组相比,OP-B不同剂量组及阳性对照组PC-3细胞中Notch1、Hes1蛋白表达均显著降低(P<0.05),高剂量组与阳性对照组均显著低于低剂量组、中剂量组(P<0.05),高剂量组与阳性对照组相比无明显差异性(P>0.05),见图2、表3。
2.5OP-B对PC-3细胞凋亡相关蛋白表达的影响 与空白对照组相比,OP-B不同剂量组及阳性对照组PC-3细胞中Bax、cleaved caspase-3、cleaved PARP蛋白表达均显著升高(均P<0.05),高剂量组与阳性对照组均显著高于低剂量组、中剂量组(均P<0.05);与空白对照组相比,OP-B不同剂量组及阳性对照组PC-3细胞中Bcl-2蛋白表达均显著降低(P<0.05),高剂量组与阳性对照组均显著低于低剂量组、中剂量组(P<0.05),高剂量组与阳性对照组相比无明显差异性(P>0.05),见表3、图3。

1~5:空白对照组、阳性对照组、低剂量组、中剂量组、高剂量组,下图同图2 各组PC-3细胞Notch1、Hes1蛋白表达
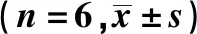
表3 各组PC-3细胞Notch1、Hes1蛋白及凋亡相关蛋白表达比较

图3 OP-B对PC-3细胞凋亡相关蛋白表达的影响
3 讨 论
Notch通路可参与细胞增殖、分化及凋亡等多种生物学过程,通过抑制Notch通路及其受体表达可抑制PC细胞增殖、侵袭,同时可抑制PC细胞中蛋白激酶B(AKT)、哺乳动物雷帕霉素靶蛋白(mTOR)等细胞通路〔9,10〕。推测针对Notch信号通路的靶向药物可增强PC患者放疗敏感性。
OP-B可通过抑制AKT/mTOR信号通路进而促使肝癌细胞发生自噬进而诱导癌细胞凋亡,通过激活c-Jun氨基末端激酶(JNK)/c-Jun信号通路进而诱导结肠癌细胞、胃癌细胞自噬及凋亡〔11~13〕。OP-B可通过激活肺癌细胞自噬进而增强肿瘤细胞凋亡敏感性〔14〕,影响不同信号通路诱导癌细胞凋亡,但对Notch1/Hes信号通路在PC细胞中的研究却未发现相关报道。研究表明二甲双胍可通过抑制Notch1/Hes信号通路进而抑制PC-3细胞增殖并促使其凋亡〔15〕。本研究说明OP-B可抑制PC-3细胞增殖。LDH漏出率与癌细胞增殖密切相关,LDH漏出率降低时表明宫颈癌细胞增殖受到抑制,宫颈癌细胞对电离辐射的敏感性增加〔7〕。本研究说明OP-B可抑制PC-3细胞增殖并提高PC-3细胞对电离辐射的敏感性。高剂量OP-B可增强电离辐射介导的PC-3细胞凋亡并增强其放疗敏感性。Notch信号通路可调控多种肿瘤细胞分化及迁移等过程,其中Notch受体Notch1与配体结合后可激活Notch信号通路进而激活下游靶基因Hes1表达〔16,17〕。Notch1及其下游靶基因Hes1在前列腺癌中呈高表达,抑制其表达可明显抑制癌细胞增殖并促进其凋亡,研究发现抑制Notch1信号通路可增强乳腺癌放疗敏感性〔18,19〕。本研究提示OP-B与Notch1信号通路抑制剂的作用相同。电离辐射可杀死肿瘤细胞,其可能作用机制为激活细胞凋亡通路进而诱导细胞坏死,若凋亡相关蛋白表达异常或缺失可促使其对外界刺激的敏感性降低进而产生抗性〔20〕。Caspase家族在细胞凋亡等信号通路中发挥重要作用,其中抗凋亡蛋白Bcl-2与促细胞凋亡蛋白Bax比例失衡可引起联级反应并激活Caspase通路促进Caspase-3、PARP表达进而促使细胞内蛋白质降解导致细胞凋亡〔21〕。本研究提示高剂量OP-B可通过激活细胞凋亡通路并促使细胞凋亡进而增强PC-3细胞对放疗的敏感性。

