外源性CGRP对ALI大鼠肺组织AQP1及p-JNK表达的影响
唐书福 赵建军 张建勇 肖雯雯 张红
(遵义医科大学附属医院呼吸与危重症医学科呼吸二病区,贵州 遵义 563000)
急性肺损伤(ALI)或其更加严重的阶段急性呼吸窘迫综合征(ARDS)是由多种因素(包括肺内和肺外直接或间接病因等)导致的,肺的组织病理学主要为血管内皮细胞和肺泡上皮细胞受到损伤引起的非心源性肺水肿〔1,2〕。ALI/ARDS起病急、进展快,死亡率高达30%~50%〔3,4〕。研究发现,炎症反应机制是ALI重要致病机制,而水通道蛋白(AQPs)与ALI肺水肿的发生和发展的关系密切〔5〕。另有研究报道,内毒素对AQPs的调控作用主要通过抑制丝裂原活化蛋白激酶(MAPK)信号通路中的c-Jun氨基端蛋白激酶(JNK)和细胞外信号调节激酶(ERK)两条途径完成〔6〕。降钙素基因相关肽(CGRP)作为具有抗炎作用的一种新型抗炎介质,文献报道其具有减轻ALI肺水肿的作用。在ALI肺水肿中AQP1与JNK信号传导间的关系尚未完全明确。本研究旨在探讨静脉注射药物CGRP对ALI大鼠肺组织AQP1及磷酸化(P)-JNK表达的影响。
1 材料和方法
1.1实验动物及分组 本实验动物SD雄性大鼠(n=42,体重178~225 g)购于第三军医大学动物实验中心。将42只大鼠随机分为NS对照组(NS组,n=7)、CGRP对照组(CGRP组,n=7)、急性肺损伤组(ALI组,n=14)和干预组(Control组,n=14)共四个大组,其中ALI组分为6 h ALI组和12 h ALI组两个亚组(各亚组n=7),Control组分为6 h Control和12 h Control组两个亚组(各亚组n=7)。
1.2主要实验试剂及实验药物 本实验中主要试剂脂多糖(LPS)、CGRP试剂和小鼠AQP1单克隆抗体分别购于Sigma、Tocris和abcam公司,p-JNK1/2多克隆抗体、GAPDH于美国Affinity公司购买。
1.3构建实验模型 本研究中按LPS以10 mg/kg以尾静脉注射建立ALI组大鼠模型,分别在6 h和12 h取标本;Control组按5 μg/kg尾静脉注射药物CGRP,成功注射CGRP后1 h按10 mg/kg尾静脉注射LPS,分别于6 h和12 h取材;CGRP组按5 μg/kg尾静脉注CGRP后6 h取标本;NS组按0.2 ml(1 ml/kg)尾静脉注射NS后6 h取标本。
1.4指标检测
1.4.1肺泡灌洗液(BALF)细胞计数 收集各组SD大鼠的BALF,取10 μl的标本滴在细胞计数板上,光镜下计数细胞数;取离心后的BALF沉淀20 μl涂片(2~3张/标本),待晾干玻片后进行姬姆萨染色,在油镜下(单盲法)计数 200个细胞,计算出细胞数。
1.4.2肺组织湿/干重比值(W/D) 取各组大鼠右上叶肺标本,用滤纸将其表面血液和水分吸干尽,电子天平称肺组织重量,计为湿重(W);后将其置于80℃烤箱中烘烤48 h后称肺组织重量,计为干重(D),计算出各组大鼠肺组织标本W/D值。
1.4.3免疫组化(IHC)法测定各组大鼠肺组织AQP1和p-JNK蛋白表达水平 本实验按IHC试剂盒说明,采用IHC方法(二步法),观察AQP1和p-JNK蛋白表达。各组肺组织石蜡切片标本脱蜡、脱水后,热修复抗原,山羊血清封闭非特异性抗原,依次滴加入一抗、二抗和卵白素-生物素-酶复合物(ABC)复合物,然后使用二氨基联苯胺(DAB)显色后进行脱水和中性树胶封片等处理。用磷酸盐缓冲液(PBS)替代一抗设为空白对照,呈现棕黄色的颗粒者为阳性。
1.4.4Western印迹检测AQP1和p-JNK蛋白水平 称量20 mg的各组大鼠肺组织标本后用组织细胞快速放射免疫沉淀(RIPA)裂解液匀浆,在离心机(温度为4℃、转速12 000 r/min)下离心10 min,取上清液测样本蛋白浓度。取25 μg蛋白上样于制备好的凝胶中的每个孔上进行电泳、转膜和封闭处理后稀释一抗(浓度1∶1 000),环境温度4℃下孵育过夜后次日加入辣根过氧化物酶标记二抗(稀释比例1∶10 000)中,37℃孵箱中孵育1 h后经增强型化学发光试剂处理。暗室中曝光胶片,并做好标记后扫描图片存储备用。AQP1和p-JNK表达量分别用AQP1阳性着色面积(IOD值)/内参GAPDH阳性着色面积(IOD值)和p-JNK阳性着色面积(IOD值)/内参GAPDH阳性着色面积(IOD值)来计算。
1.5统计学方法 采用SPSS17.0软件进行方差分析,LSD-t检验。
2 结 果
2.1各组BALF中细胞数及分类所占比 在6 h ALI组、6 h Control组、12 h ALI 组和12 h Control组BALF中白细胞数目及中性粒细胞所占比较NS组明显增多,以12 h ALI组最多,差异有统计学意义(均P<0.01);6 h Control组、12 h ALI组BALF中白细胞数目及中性粒细胞所占比明显小于6 h ALI组(均P<0.01),12 h Control组BALF中白细胞数目及中性粒细胞所占比明显小于12 h ALI组(均P<0.01)。见表1。
表1 各组BALF中细胞数及分类所占比
2.2各组肺组织W/D值 在6 h ALI组(6.19±0.61)、12 h ALI组(7.52±0.42)、6 h Control组(5.58±0.29)和12 h Control组肺组织W/D值(6.03±0.16)较NS组(4.04±0.37)明显增大(均P<0.01),以12 h ALI组最大。6 h Control组肺组织中W/D值较6 h ALI组明显减小(P<0.01)。12 h Control组W/D值较12 h ALI组明显减小(P<0.01)。
2.3IHC法测定大鼠AQP1和p-JNK蛋白表达水平 AQP1主要在血管内皮细胞核和细胞质中表达,部分肺泡上皮及小气道上皮细胞核和胞质中有少量表达。6 h和12 h ALI、Control组肺组织中AQP1表达水平明均较NS组明显减少(P<0.05);6 h ALI组较6 h Control组、12 h ALI组较12 h Control组大鼠肺组织中AQP1蛋白表达量均明显减少(均P<0.05)。见表2、图1。
表2 IHC法测得各组大鼠肺组织AQP1、p-JNK蛋白表达水平
图1 IHC法各组肺组织 AQP1的表达(×20)
p-JNK IHC结果显示:其阳性细胞在小气道上皮、肺泡上皮和血管内皮的细胞核和胞质中少量表达;与NS组比较,6 h ALI组、6 h Control组、12 h ALI 组和12 h Control组p-JNK表达显著增多,其广泛表达于气道和肺泡的上皮细胞,血管内皮细胞及间质细胞当中。6 h Control组和12 h Control组阳性细胞较NS组和CGRP组明显增多(P<0.05);6 h Control组和12 h Control组大鼠肺组织中p-JNK表达较相同时段的ALI组明显增多(P<0.05)。见表2、图2。
图2 IHC 法各组肺组织p-JNK的表达(×20)
2.4Western印迹测各组大鼠肺组织AQP1和p-JNK表达 6 h ALI组、12 h ALI组、6 h Control组、12 h Control组AQP1表达明显低于NS组(P<0.05),p-JNK表达明显高于NS组(P<0.05);与6 h ALI组比较,6 h Control组AQP1表达量均明显增加,p-JNK表达明显减少(均P<0.05);12 h Control组AQP1表达明显高于12 h ALI组,p-JNK表达明显低于12 h ALI组(均P<0.05)。见图3、表3。
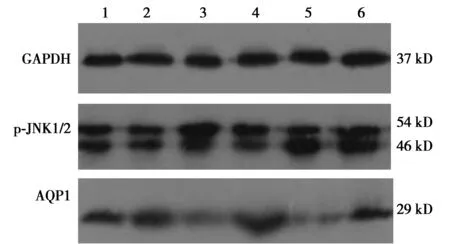
1~6:NS组、CGRP对照组、6 h ALI组、6 h Control组、12 h ALI组、12 h Control组图3 Western印迹测各组大鼠肺组织AQP1和p-JNK的蛋白表达
表3 Western印迹测得各组大鼠肺组织AQP1、p-JNK的表达量
3 讨 论
ALI/ARDS是由多种因素如重症感染、休克和中毒等造成全身炎症反应综合征,组织病理改变主要为肺泡上皮和血管内皮受损致其通透性增加而导致肺泡和间质的水肿,其主要表现为逐渐加重的呼吸困难和难以纠正的低氧血症。肺部X线或肺部CT检查主要表现为双肺浸润性或渗出性改变〔7,8〕。ALI/ARDS是内科的常见急危重症,其起病急骤、进展快,常可致多脏器功能受损而导致死亡率高。
炎症反应机制为ALI/ARDS主要致病机制之一。炎症反应过度失控是其致病的核心环节,炎症反应失控进一步加重肺泡上皮及血管内皮的损伤,使血管内皮通透性增加,Ⅱ型肺泡上皮细胞损伤,表面活性物质生成减少,导致肺表面张力增大与顺应性降低,肺泡塌陷和有效通气面积减少,因此出现呼吸窘迫、难以纠正的低氧血症的表现。由于肺与全身血液及淋巴循环相通,肺是脓毒症最早受累的脏器。研究表明,革兰阴性杆菌感染〔9,10〕是最容易导致脓毒症,而脓毒症是导致ALI最常见因素之一〔11〕。LPS是革兰阴性菌细胞壁的主要成分,在脓毒症的致病机制中扮演着重要角色〔12〕。在构建ALI的模型时,因干预药物及干预方式的不同,ALI模型的严重程度亦有所不同。本实验在肺组织学改变中,病理改变以毛细血管充血、肺泡及间质中大量炎性细胞浸润为主,同时见肺泡腔内红细胞渗出及肺泡间隔增宽和紊乱,从另一角度说明本实验中,通过尾静脉注射LPS建议大鼠的ALI模型亦是成功的。在本研究不足之处在于,BALF中中细胞计数及分类计数偏少,与相关文献报道之间存在一定差异〔13〕,分析其原因可能为尾静脉注射所致的ALI模型中血管内皮损伤早,而肺泡和大气道内活化多形核白细胞迁移晚,而非直接气管内滴入导致的ALI模型中的多形细胞计数明显。
ALI/ARDS时主因肺泡液清除功能下降导致了肺水肿发生和发展。研究发现,AQP1分子量约29 kD,主要分布于肺毛细血管内皮,对肺组织水分的平衡和新生血管的生成等功能的调节以及维持机体正常的呼吸功能具有重要的意义〔14〕。AQP1数量多少或者功能的改变对肺泡内液的形成和祛除具有重要的意义〔15〕。本研究结果提示过多肺泡内液聚集于肺组织内,AQP1参与了ALI时肺水肿的病理生理进程。研究发现,MAPK信号通路是参与ALI时调控炎症反应的重要通路之一,而AQPs的改变亦受到MAPK信号通路所调控。MAPK信号传导通路家族中JNK信号通路在ALI/ARDS的致病过程中发挥着至关重要的作用。本研究结果说明LPS可致使炎症因子释放增多,进一步激活p-JNK,导致炎症级联式放大效应,进一步推动ALI发生与发展的病理进程。
新发现的抗炎性介质CGRP,其在ALI的致病过程中具有重要的抗炎的生物效应。黄亮等〔16〕研究发现,CGRP干预可上调脑死亡大鼠中的肺组织AQP1表达水平,降低肺水含量而发挥减轻肺水肿的作用。CGRP除了具有扩张血管、减轻肺水肿的作用以外,尚具有抗炎这一生物学效应。本研究说明外源性CGRP可减轻ALI时肺内的炎性反应,提高AQP1的表达而达到减轻肺水肿的作用。同时间点的干预组大鼠肺组织p-JNK量比ALI组有减少,与陈龙等〔17,18〕的研究报道较为吻合,提示静脉注射CGRP可抑制炎性介质的释放,致p-JNK失活,阻断JNK信号通路以减轻ALI时肺脏的炎症反应和肺水肿程度而达到保护肺的作用。
综上,炎症反应机制是ALI重要的致病机制,而MAPK信号通路参与与炎性反应进程。研究表明MAPK信号通路激活后,促进了炎症级联放大效应,加速了ALI发生和发展的病理进程。CGRP作为新型炎症消退介质,其静脉注射可抑制炎症因子如TNF-α、IL-1β等的释放,引起p-JNK活化受阻并且阻断JNK信号通路的传导,促进ALI大鼠肺组织AQP1的表达,产生减轻ALI/ARDS时肺内炎症反应和肺水肿的生物学功能。目前,对CGRP干预可以减轻ALI所致肺内炎症和肺水肿的机制研究中,AQP1的表达水平是直接提高或是通过JNK信号通路间接因素上调AQP1的表达尚未完全明确,有待进一步研究阐明。

