吡格列酮对猪卵母细胞体外成熟及孤雌胚胎发育的影响
吕玲燕 汪燕玲 潘星辰


摘要:为探讨吡格列酮(PIO)对猪卵母细胞体外成熟及孤雌胚胎发育的影响,比较了不同浓度PIO对卵母细胞的体外成熟状况以及孤雌胚胎体外发育潜能的影响。结果表明,成熟培养液中添加1.0 μmol/L PIO组的极体排出率显著高于0.5 μmol/L添加组(P<0.05),极显著高于对照和1.5 μmol/L添加组(P<0.01)。对在4种PIO浓度中培养成熟的卵母细胞进行孤雌激活,结果表明,添加1.0 μmol/L PIO组的卵裂率显著高于0.5 μmol/L添加组(P<0.05),极显著高于对照和1.5 μmol/L添加组(P<0.01);就囊胚率及细胞总数而言,1.0 μmol/L PIO添加组极显著高于对照、0.5、1.5 μmol/ L这3个PIO添加组(P<0.01),表明成熟培养液中添加1.0 μmol/L PIO有助于提高猪卵母细胞的成熟率,以及孤雌胚胎的囊胚率和囊胚细胞总数。
关键词:吡格列酮;猪;卵母细胞;孤雌胚胎;发育效果
中图分类号:S828;Q954.4 文献标识码:A
文章编号:0439-8114(2020)17-0093-04
Abstract: Aiming to investigate the effects of pioglitazone(PIO) on oocytesmaturation in vitro and parthenogenetic embryos development of pig, the effect of different concentration PIO on oocytes maturation in vitro and parthenogenetic embryos developmental potency were compared. The results showed that the polar body excretion rate of 1.0 μmol/L PIO-treated group was significantly higher than that of 0.5 μmol/L PIO-treated group in maturation medium(P<0.05),was very significantly higher that of control an 1.5 μmol/L PIO-treated group(P<0.01). The mature oocytes cultured in different concentrations PIO were parthenogenetic activated, the experimental results showed that the cleavage rate of the 1.0 μmol/L PIO group was significantly higher than of the 0.5 μmol/L group in embryo culture medium(P<0.05), was very significantly higher than that of the control and 1.5 μmol/L PIO group (P<0.01), as for the blastocyst rate and the total number of cells, the group of the 1.0 μmol/L PIO-treated group was the highest among the groups (P<0.01). In conclusion, 1.0 μmol/L PIO in maturation medium could improve the maturation rate of porcine oocyte, also could significantly improve the blastocyst rate and the total number of cells of porcine parthenogenetic embryos.
Key words: pioglitazone; pig;oocytes; parthenogenetic embryos; developmental effect
猪胚胎工程的发展极大地推进了畜牧业和医学的进程,通过它可以改良品種、培育抗病猪种提高肉质、生产转基因猪或基因组修饰猪、制备人类疾病模型、进行器官移植、生产药物蛋白、研究发育机理等[1]。胚胎的体外培养是猪胚胎工程的主要环节之一,无论是孤雌激活、体外受精(IVF) 、核移植技术还是基因打靶、基因敲除技术,所生产的胚胎都要经过体外培养,发育到适当的阶段才能进行后续的研究,然而后续的胚胎发育过程都离不开前期卵母细胞的成熟培养。猪的卵母细胞与其他物种的卵母细胞相比,其含有较丰富的脂肪滴[2],脂肪滴作为一种特殊的细胞器,广泛存在于各种细胞中尤其是脂肪细胞中[3,4]。Goodman[5]、Brown[6]研究表明脂肪滴是一种存储能量、调节脂质动态平衡及细胞内信号传导的重要细胞器,Kikuch等[7]研究表明脂肪滴在卵母细胞成熟和早期胚胎发育过程中具有重要的作用。目前学者对卵母细胞和早期胚胎发育过程中关于脂质合成、沉积、代谢等方面的研究相对较少,因此本试验首次加入吡格列酮(PIO,治疗糖尿病药物),探索添加PIO对猪卵母细胞脂质的合成、代谢、沉积等方面的影响,以及PIO对猪卵母细胞成熟状况及孤雌胚胎早期发育的影响,为更好地提高体外生产(IVP)猪胚胎的囊胚发育率提供理论依据。
1 材料与方法
1.1 主要试剂和器材
胎牛血清(FBS)购自Hyclone公司,TCM-199粉剂、DMEM粉剂购自美国Gbico公司,激素eCG、hCG购自美国Sigma公司,其余的化学试剂如无特殊说明均购自美国Sigma Aldrich公司。配制溶液的水均为dd H2O。
试验器材有:实体显微镜(日本NIKON)、CO2培养箱(Thermo Life Science)、细胞融合仪(型号:ECM2001)、融合槽(型号:BTX 450)、卵母细胞成熟培养皿(35 mm及60 mm塑料平皿)、胚胎培养皿(四孔板)。
1.2 试验方法
1.2.1 卵母细胞的成熟培养 猪的卵巢来源于南宁市屠宰场,装入含有双抗(青霉素、链霉素)25~35 ℃的生理盐水中,用保温壶4 h之内送回实验室。取卵巢表面2~6 mm的卵泡,试管中静置,弃去上清,留沉淀部分分装。挑选含有3层及以上有颗粒,卵丘细胞包被、折光性良好的卵丘卵母细胞复合体(COCs),放入成熟液中(含10 IU/mL hCG+10 IU/mL eCG)培养,将卵母细胞随机分成4组:第一组为空白对照组;第二组添加0.5 μmol/L PIO;第三组添加1.0 μmol/L PIO;第四组添加1.5 μmol/L PIO,20~22 h后换成不含激素的培养液,继续培养18~20 h至细胞成熟。
1.2.2 孤雌胚胎的激活、培养以及囊胚细胞计数 将在不同浓度PIO中培养的成熟卵母细胞进行孤雌激活,参数为:125 V/mm,80 μs,1 DC,激活液成分为0.3 mol/L甘露醇+0.1 mmol/L MgSO4+0.1 mmol/L CaCl2+0.01% PVA(聚乙烯醇)。激活完成后,将激活后的孤雌胚胎放入PZM-3(胚胎培养液-3)中培养,胚胎标记为4组,分别为对照组(CK)、0.5 μmol/L PIO组、1.0 μmol/L PIO组、1.5 μmol/L PIO组。48 h后观察卵裂率,160~168 h后观察囊胚率。在培养的第6至第7天收集囊胚,置于Hoechst33342染液中,石蜡-凡士林封片,荧光显微镜下观察记录囊胚细胞的总数目。
1.3 统计分析
试验数据用SPSS 17.0软件进行统计分析,所有试验4次重复。
2 结果与分析
2.1 不同浓度PIO对卵母细胞体外成熟效率的影响
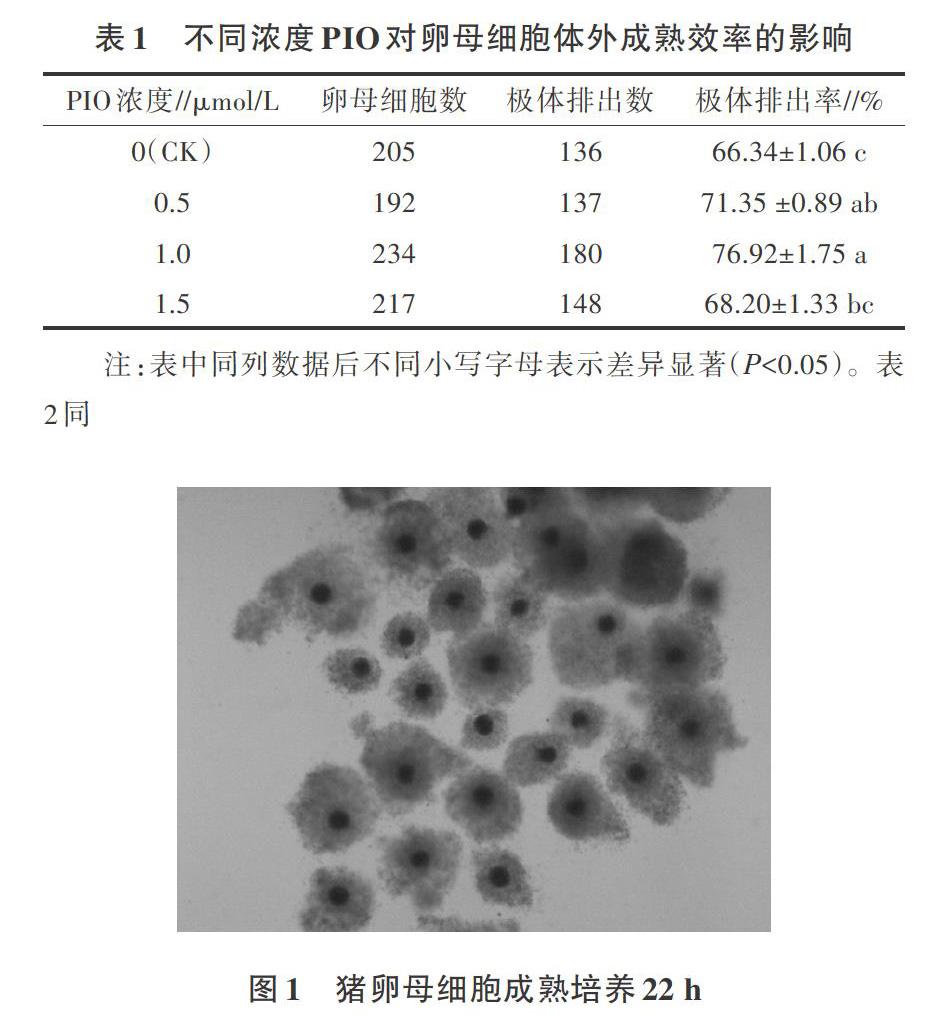
从表1可以看出,在卵母细胞的成熟培养液中添加不同浓度的PIO,培养40~44 h后,添加1.0 μmol/L PIO组的极体排出率最高,显著高于对照和1.5 μmol/L PIO组。卵母细胞成熟液中添加1.0 μmol/L PIO能显著促进卵母细胞第一极体的排出;从图1可以看出,卵母细胞成熟液中添加1.0 μmol/L PIO能显著促进卵母细胞的成熟发育。
2.2 成熟培养液中不同浓度PIO对孤雌胚胎发育效果的影响
对在不同浓度PIO中培养成熟的卵母细胞进行孤雌激活,培养160~168 h。试验结果(表2)表明,添加1.0 μmol/L PIO组的卵裂率显著高于对照和1.5 μmol/L PIO添加组;就囊胚率及细胞总数而言,1.0 μmol/L PIO添加组显著高于其他3个处理;试验结果(图2)表明,1.0 μmol/L PIO中培养成熟的卵母细胞进行孤雌激活后的胚胎发育良好,经Hoechst 33342染色后的囊胚细胞数目显著增加。
3 小结与讨论
优化培养体系对于卵母细胞的体外成熟以及后续胚胎发育至关重要[8]。大多学者认为代谢异常能减低卵母细胞在体外培养的成熟率以及胚胎的发育能力。因此研究者们[9, 10]通过在培养体系中改变温度、补充各类生长因子、活化剂、抗氧化剂等途径来改善卵母细胞的成熟和胚胎的发育。猪的卵母细胞和胚胎与其他物种的相比,其含有较丰富的脂肪滴[2],正是由于它的内脂质含量较高,从而为人们更好地了解卵母细胞在成熟过程中脂质和脂肪酸代谢提供了一种很好的模型。Dunning等[11]、Gardner等[12]研究表明,脂质代谢通过脂肪酸氧化途径在线粒体中产生能量物质ATP。而Guan等[13]、Sanchez-Lazo等[14]研究则表明,脂肪酸的合成和氧化对促进卵母细胞成熟和胚胎发育是必不可少的。在体外成熟过程中,脂肪酸氧化下调能减少小鼠胚胎的增殖[15]以及扰乱牛胚胎的发育[16]。因此, 脂质代谢的调节对于改善哺乳动物卵母细胞体外成熟和胚胎发育具有重要的意义。
PIO是一种抗糖尿病和高血糖的药物,属于噻唑烷二酮家族,尤其是对2型糖尿病效果显著。Phongnimitr等[8]、Wang等[17]研究表明,PIO也是一种PPARG激动剂,通过调节兔、牛体内活性氧、谷胱甘肽和酶的活性来防止氧化应激。此外,Bogacka等[18]研究结果表明,PIO能通过改变碳水化合物和脂质代谢相关基因的表达从而促进脂肪细胞中的脂质沉积和增强β氧化反应。然而PIO對猪卵母细胞体外成熟以及后续胚胎发育的影响鲜有相关报道。
因此本试验试图探索添加PIO对猪卵母细胞体外成熟的影响,以及对孤雌胚胎早期发育的影响。试验结果表明,与对照相比,成熟培养液中添加不同浓度的PIO均能有效提高猪卵母细胞的成熟率,其中1.0 μmol/L PIO效果最好;添加1.0 μmol/L PIO还能显著提高猪孤雌胚胎的卵裂率、囊胚率及囊胚细胞总数。Sang-Gi等[19]研究结果表明,用1.0 μmol/L PIO处理体外成熟的卵母细胞,通过在卵母细胞中提高脂质代谢和抗氧化应激,从而促进卵母细胞的成熟以及改善后续孤雌胚胎的发育、增加孤雌胚胎的囊胚细胞数,本试验的研究成果与Sang-Gi等[19]得出的结论相一致。Song等[20]研究结果表明,用50 μmol/L PPARG激动剂罗格列酮(Rosiglitazone)处理体外成熟的卵母细胞能显著增加其成熟率,本试验中添加的PIO(同属于噻唑烷二酮家族)也具有相同的作用。徐礼杰等[21]研究结果表明,抗氧化物质PIO可促进小鼠胚胎发育,有效克服胚胎体外2-细胞发育阻滞现象,本试验的研究结果与徐礼杰等[21]得出的结论相一致。至于PIO促进卵母细胞体外成熟以及孤雌胚胎发育、增加孤雌囊胚细胞数的具体作用机制还有待进一步研究。
參考文献:
[1] LAI L X, KOLBER-SIMONDS D, PARK K W, et al. Production of α-1, 3-galactosyltransferase knockout pigs by nuclear transfer cloning[J]. Science, 2002, 2959(5557): 1089-1092.
[2] PRATES E G, NUNES J T, PEREIRA R M. A role of lipid metabolism during cumulus-oocyte complex maturation: Impact of lipid modulators to improve embryo production[J]. Mediators of inflammation, 2014: doi: 10.1155/2014/692067.
[3] MURPHYD J. The biogenesis and functions of lipid bodies in animals, plants and microorganisms[J]. Progress in lipid research, 2001, 40(5): 325-438.
[4] ZEHMER J K, HUANG Y, PENG G, et al. A role for lipid droplets in inter-membrane lipid traffic[J]. Proteomics, 2009, 9(4):914-921.
[5] GOODMAN J M. The gregarious lipid droplet[J]. Journal of biological chemistry, 2008, 283(42):28005-28009.
[6] BROWN D A. Lipid droplets: Proteins floating on a pool of fat[J]. Current biology, 2001, 11(11):R446-R449.
[7] KIKUCH K,EKWALL H,TIENTHAI P,et al. Morphological features of lipid droplet transition during porcine oocyte fertilization and early embryonic development to blastocyst in vivo and in vitro[J]. Zygote, 2002,10(4):355-366.
[8] PHONGNIMITR T, LIANG Y, SRIRATTANA K, et al. Effect of L-carnitine onmaturation, cryo-tolerance and embryo developmental competence ofbovine oocytes[J]. Animal science journal, 2013, 84(11): 719-725.
[9] CETICA P D, PINTOS L N, DALVIT G C, et al. Antioxidant enzyme activity and oxidative stress in bovine oocyte in vitro maturation[J]. IUBMB life, 2001, 51(1):57-64.
[10] WANG W H, MENG L, HACKETT R J, et al. The spindle observation and its relationship with fertilization after intracytoplasmic sperm injection in living human oocytes[J]. Fertility and sterility, 2001, 75(2):348-353.
[11] DUNNING K R, CASHMAN K, RUSSELL D L, et al. Beta-oxidation is essential for mouse oocytedevelopmental competence and early embryo development[J]. Biology of peproduction,2010, 83(6):909-918.
[12] GARDNER D K, POOL T B, LANE M. Embryo nutrition and energy metabolism and its relationship to embryo growth, differentiation, and viability[J]. Seminars in reproductive medicine, 2000, 18(2):205-218.
[13] GUAN Y, ZHANG Y, BREYER M D. The role of PPARs in the transcriptional control of cellular processes[J]. Drug news & perspectives, 2002, 15(3):147-154.
[14] SANCHEZ-LAZO L, BRISARD D, ELIS S, et al. Fatty acid synthesis and oxidation in cumulus cells support oocyte maturation in bovine[J]. Molecular endocrinology, 2014, 28(9):1502-1521.

